第二章 第四节 化学反应的调控 课时练(含答案)2023-2024学年化学人教(2019)
文档属性
| 名称 | 第二章 第四节 化学反应的调控 课时练(含答案)2023-2024学年化学人教(2019) |
|
|
| 格式 | docx | ||
| 文件大小 | 518.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 00:00:00 | ||
图片预览



文档简介
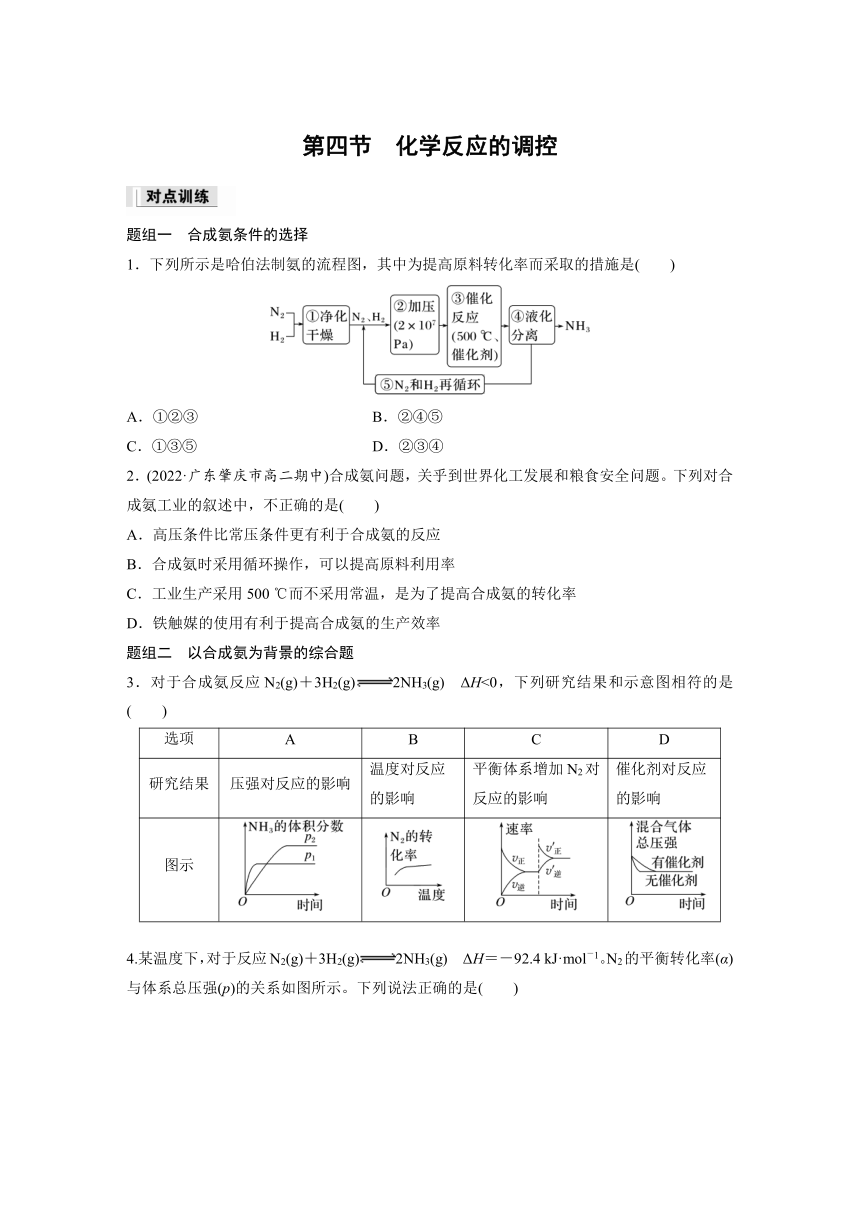
第四节 化学反应的调控
题组一 合成氨条件的选择
1.下列所示是哈伯法制氨的流程图,其中为提高原料转化率而采取的措施是( )
A.①②③ B.②④⑤
C.①③⑤ D.②③④
2.(2022·广东肇庆市高二期中)合成氨问题,关乎到世界化工发展和粮食安全问题。下列对合成氨工业的叙述中,不正确的是( )
A.高压条件比常压条件更有利于合成氨的反应
B.合成氨时采用循环操作,可以提高原料利用率
C.工业生产采用500 ℃而不采用常温,是为了提高合成氨的转化率
D.铁触媒的使用有利于提高合成氨的生产效率
题组二 以合成氨为背景的综合题
3.对于合成氨反应N2(g)+3H2(g)2NH3(g) ΔH<0,下列研究结果和示意图相符的是( )
选项 A B C D
研究结果 压强对反应的影响 温度对反应的影响 平衡体系增加N2对反应的影响 催化剂对反应的影响
图示
4.某温度下,对于反应N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
A.将1 mol氮气、3 mol氢气置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变为B时,平衡常数K(A)C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡常数K增大
5.相同温度下,有体积相同的甲、乙两个容器,甲容器中充入1 g N2和1 g H2,乙容器中充入2 g N2和2 g H2,分别进行合成氨反应。下列叙述错误的是( )
A.化学反应速率:乙>甲
B.平衡后N2的浓度:乙>甲
C.H2的平衡转化率:乙>甲
D.平衡混合气体中H2的体积分数:乙>甲
题组三 化学反应的调控
6.下列关于化学反应的调控措施说法不正确的是( )
A.硫酸工业中,为提高SO2的转化率,通入过量的空气
B.工业上增加炼铁高炉的高度可以有效降低尾气中CO的含量
C.合成氨工业中,从生产实际条件考虑,不盲目增大反应压强
D.合成氨工业中,为提高氮气和氢气的利用率,采用循环操作
7.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g),下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300 ℃下进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
8.纳米钴常用于CO加氢反应的催化剂:CO(g)+3H2(g)CH4(g)+H2O(g) ΔH<0,下列说法正确的是( )
A.纳米技术的应用,优化了催化剂的性能,提高了反应的转化率
B.缩小容器体积,平衡向正反应方向移动,CO的浓度增大
C.从平衡体系中分离出H2O(g)能加快正反应速率
D.工业生产中采用高温条件下进行,其目的是提高CO的平衡转化率
9.某研究小组为探究催化剂对尾气中CO、NO转化的影响,将含NO和CO的尾气在不同温度下,以一定的流速通过两种不同的催化剂进行反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,测量相同时间内逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。下列说法正确的是( )
①两种催化剂均能降低反应的活化能,但ΔH均不变
②相同条件下,改变压强对脱氮率没有影响
③曲线Ⅱ中的催化剂的最适宜温度为450 ℃左右
④a点的脱氮率是对应温度下的平衡脱氮率
⑤若低于200 ℃,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是催化剂的活性不高
A.①②③ B.①③④
C.②③④ D.①③⑤
10.CH4-CO2催化重整可以得到合成气(CO和H2),有利于缓解温室效应,其主要反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1,同时存在以下反应:CH4(g)??C(s)+2H2(g) ΔH=+75 kJ·mol-1(积碳反应),CO2(g)+C(s)2CO(g) ΔH=+172 kJ·mol-1(消碳反应),假设体系温度恒定。积碳反应会影响催化剂的活性,一定时间内积碳量和反应温度的关系如图所示。下列说法正确的是( )
A.高压有利于提高CH4的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.升高温度,积碳反应的化学平衡常数K1减小,消碳反应的化学平衡常数K2增大
D.温度高于600 ℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快,积碳量减少
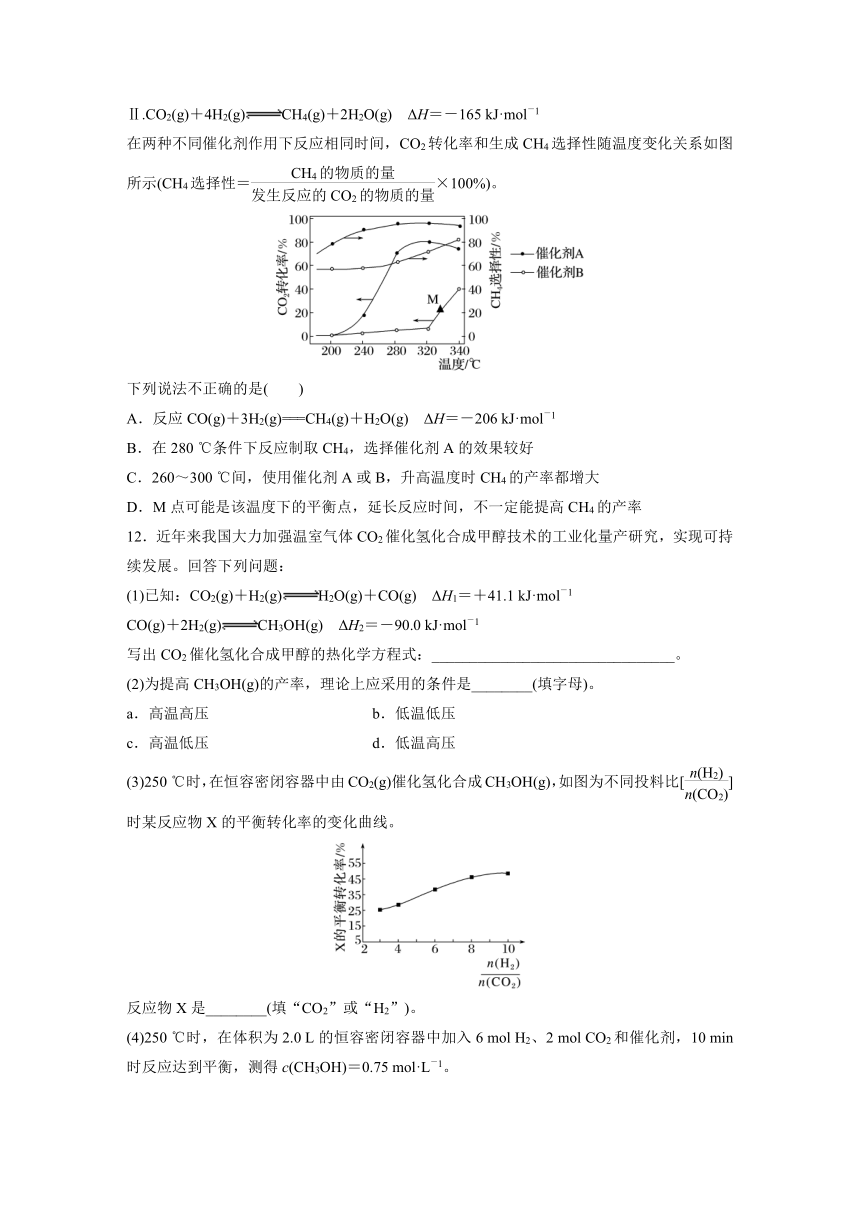
11.(2022·江苏南通期中)一定条件下,将一定量的CO2和H2混合气体通过装有催化剂的反应器可得到甲烷。
已知:Ⅰ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41 kJ·mol-1
Ⅱ.CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-165 kJ·mol-1
在两种不同催化剂作用下反应相同时间,CO2转化率和生成CH4选择性随温度变化关系如图所示(CH4选择性=×100%)。
下列说法不正确的是( )
A.反应CO(g)+3H2(g)===CH4(g)+H2O(g) ΔH=-206 kJ·mol-1
B.在280 ℃条件下反应制取CH4,选择催化剂A的效果较好
C.260~300 ℃间,使用催化剂A或B,升高温度时CH4的产率都增大
D.M点可能是该温度下的平衡点,延长反应时间,不一定能提高CH4的产率
12.近年来我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:CO2(g)+H2(g)H2O(g)+CO(g) ΔH1=+41.1 kJ·mol-1
CO(g)+2H2(g)CH3OH(g) ΔH2=-90.0 kJ·mol-1
写出CO2催化氢化合成甲醇的热化学方程式:________________________________。
(2)为提高CH3OH(g)的产率,理论上应采用的条件是________(填字母)。
a.高温高压 b.低温低压
c.高温低压 d.低温高压
(3)250 ℃时,在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[]时某反应物X的平衡转化率的变化曲线。
反应物X是________(填“CO2”或“H2”)。
(4)250 ℃时,在体积为2.0 L的恒容密闭容器中加入6 mol H2、2 mol CO2和催化剂,10 min时反应达到平衡,测得c(CH3OH)=0.75 mol·L-1。
①前10 min内平均反应速率v(H2)=________ mol·L-1·min-1。
②化学平衡常数K=______________________________________________________。
③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到的四组实验数据如表所示:
实验编号 温度/K 催化剂 CO2的转化率/% 甲醇的选择性/%
A 543 Cu/ZnO纳米棒 12.3 42.3
B 543 Cu/ZnO纳米片 11.9 72.7
C 553 Cu/ZnO纳米棒 15.3 39.1
D 553 Cu/ZnO纳米片 12.0 70.6
根据上表所给数据,用CO2生产甲醇的最优条件为________(填实验编号)。
13.(2022·陕西眉县高二期中)CO2可用来生产燃料甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=- 49 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和2 mol H2,一定条件下发生上述反应,测得CH3OH(g)浓度随时间的变化如表所示:
时间/min 0 3 5 10 15
浓度/(mol·L-1) 0 0.3 0.45 0.5 0.5
(1)H2的平衡转化率为________。该条件下上述反应的平衡常数K=________。
(2)下列措施中能使平衡体系中增大且不减慢化学反应速率的是________(填字母)。
A.升高温度
B.充入He(g),使体系压强增大
C.再充入1 mol H2
D.将H2O(g)从体系中分离出去
(3)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________(填“>”“<”或“=”)c2。
(4)要提高CO2的转化率,可以采取的措施是____(填字母)。
A.加入催化剂
B.增大CO2的浓度
C.通入惰性气体
D.通入H2
E.分离出甲醇
(5)在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如图所示。
则催化效果最佳的是催化剂____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。如果a点已经达到平衡状态,则b点的v正_____(填“>”“<”或“=”)v逆,c点转化率比a点低的原因是______________。
14.(2022·莱州市高二检测)Ⅰ.“丁烯裂解法”是一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。反应如下:
主反应:3C4H84C3H6;
副反应:C4H82C2H4。
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:
(1)平衡体系中的丙烯和乙烯的质量比[]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是________(填字母)。
A.300 ℃ 0.1 MPa B.700 ℃ 0.1 MPa
C.300 ℃ 0.5 MPa D.700 ℃ 0.5 MPa
(2)有研究者结合图1数据并综合考虑各种因素,认为450 ℃的反应温度比300 ℃或700 ℃更合适,从反应原理角度分析其理由可能是____________________________________
________________________________________________________________________。
(3)图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是________________________________________________________________________
________________________________________________________________________。
Ⅱ.353 K时,在刚性容器中充入CH3OH,发生反应:CH3OHCO+2H2 ΔH>0。体系的总压强p随时间t的变化如表所示。
t/min 0 5 10 15 20 ∞
p/kPa 101.2 107.4 112.6 116.4 118.6 121.2
(4)若升高反应温度至373 K,则CH3OH分解后体系压强p∞________(填“大于”“小于”或“等于”)121.2 kPa,原因是_________________________________。
(5)353 K时,当该反应达到平衡后,继续充入少量CO(g),反应经过一段时候后重新达到平衡,此时与旧平衡相比,CH3OH的体积分数________(填“增大”“减小”或“不变”)。
第四节 化学反应的调控
1.B 2.C 3.C
4.C [该反应为可逆反应,加入的1 mol N2和3 mol H2不可能完全反应生成NH3,所以反应放出的热量小于92.4 kJ,A项错误;从状态A到状态B,改变的是压强,温度未发生变化,所以平衡常数不变,B项错误;该反应是反应前后气体分子数减小的反应,增大压强平衡向正反应方向移动,H2的转化率增大,C项正确;升高温度,平衡逆向移动,K减小,D项错误。]
5.D [因为乙容器中的原料投入量正好是甲的2倍,故A项正确;假设开始时乙容器的体积是甲的2倍(如图甲、虚拟乙),再将虚拟乙容器的体积压缩至与甲相等(如图乙),
则在此过程中化学平衡要向正反应方向移动,即N2、H2的平衡转化率增大,它们在平衡混合气体中的体积分数减小,故C项正确、D项错误;平衡时,乙中N2、H2、NH3的浓度分别比甲中N2、H2、NH3的浓度大,但乙中N2、H2的浓度要分别小于甲中N2、H2浓度的2倍,而乙中NH3的浓度要大于甲中NH3浓度的2倍,故B项正确。]
6.B 7.B 8.B
9.D [①催化剂可降低反应的活化能,但不改变反应的ΔH,正确;②该反应为气体分子数减小的反应,改变压强平衡发生移动,则改变压强对脱氮率有影响,错误;③由图可知,曲线Ⅱ中450 ℃左右脱氮率最大,则曲线Ⅱ中的催化剂的最适宜温度为450 ℃左右,正确;④因为该反应是放热反应,降低温度,平衡正向移动,则a点对应温度下的平衡脱氮率应大于450 ℃下的脱氮率,错误;⑤催化剂的活性受温度的影响,则低于200 ℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是催化剂的活性不高,正确。]
10.B
11.D [根据盖斯定律反应Ⅱ-反应Ⅰ可得CO(g)+3H2(g)===CH4(g)+H2O(g) ΔH=
-165 kJ·mol-1-(+41 kJ·mol-l)=-206 kJ·mol-1,A正确;据图可知在280 ℃条件下反应,使用催化剂A时CH4的选择性更高,B正确;由图可知,260~300 ℃间,使用催化剂A或B,升高温度时CO2的转化率都增大,CH4的选择性都增大,则产率都增大,C正确;据图可知选用催化剂A时,在与M点相同温度条件下,CO2有更高的转化率,而催化剂不影响平衡,说明M点一定不是平衡点,D错误。]
12.(1)3H2(g)+CO2(g)CH3OH(g)+H2O(g) ΔH=-48.9 kJ·mol-1 (2)d (3)CO2
(4)①0.225 ② ③B
解析 (1)根据盖斯定律,将题述两个热化学方程式相加可得:3H2(g)+CO2(g)CH3OH(g)+H2O(g) ΔH=-48.9 kJ·mol-1。(2)根据热化学方程式可知,生成CH3OH(g)的反应是放热反应,也是气体体积减小的反应,故要想提高CH3OH(g)的产率,需要低温高压。(3)图中的横坐标为,假设n(CO2)为定值,则CO2的平衡转化率随n(H2)的增大而增大,故反应物X为CO2。(4)①CH3OH(g)的浓度变化量为0.75 mol·L-1,则:
3H2(g)+CO2(g)CH3OH(g)+H2O(g)
起始/(mol·L-1) 3 1 0 0
转化/(mol·L-1) 2.25 0.75 0.75 0.75
平衡/(mol·L-1) 0.75 0.25 0.75 0.75
H2的浓度变化量为2.25 mol·L-1,则前10 min内平均反应速率v(H2)=0.225 mol·L-1·min-1。②K===。③选择性是指产物的专一性,在一个化学反应中若有多个产物,其中某一产物是目标产物,若这个物质的产率越高,说明该反应的选择性越好。观察四组数据,相比之下,B、D中甲醇的选择性好,虽然B中CO2的转化率比D中的稍低些,但是B中CH3OH(g)的选择性比D中的好,故B为最优条件。
13.(1)75% 4 (2)C (3)< (4)DE
(5)Ⅰ > 该反应放热,温度升高,平衡逆向移动
14.(1)C
(2)450 ℃比300 ℃的反应速率快,比700 ℃的副反应程度小;该温度下丁烯转化为丙烯的转化率高;该温度下催化剂的选择性最高;该温度是催化剂的活性温度
(3)压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,从而使丙烯的含量增大
(4)大于 CH3OH(g)CO(g)+2H2(g)的正反应为气体体积增大的吸热反应,温度升高,平衡右移,气体总物质的量增大,容器体积不变,总压强变大 (5)减小
题组一 合成氨条件的选择
1.下列所示是哈伯法制氨的流程图,其中为提高原料转化率而采取的措施是( )
A.①②③ B.②④⑤
C.①③⑤ D.②③④
2.(2022·广东肇庆市高二期中)合成氨问题,关乎到世界化工发展和粮食安全问题。下列对合成氨工业的叙述中,不正确的是( )
A.高压条件比常压条件更有利于合成氨的反应
B.合成氨时采用循环操作,可以提高原料利用率
C.工业生产采用500 ℃而不采用常温,是为了提高合成氨的转化率
D.铁触媒的使用有利于提高合成氨的生产效率
题组二 以合成氨为背景的综合题
3.对于合成氨反应N2(g)+3H2(g)2NH3(g) ΔH<0,下列研究结果和示意图相符的是( )
选项 A B C D
研究结果 压强对反应的影响 温度对反应的影响 平衡体系增加N2对反应的影响 催化剂对反应的影响
图示
4.某温度下,对于反应N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
A.将1 mol氮气、3 mol氢气置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变为B时,平衡常数K(A)
D.升高温度,平衡常数K增大
5.相同温度下,有体积相同的甲、乙两个容器,甲容器中充入1 g N2和1 g H2,乙容器中充入2 g N2和2 g H2,分别进行合成氨反应。下列叙述错误的是( )
A.化学反应速率:乙>甲
B.平衡后N2的浓度:乙>甲
C.H2的平衡转化率:乙>甲
D.平衡混合气体中H2的体积分数:乙>甲
题组三 化学反应的调控
6.下列关于化学反应的调控措施说法不正确的是( )
A.硫酸工业中,为提高SO2的转化率,通入过量的空气
B.工业上增加炼铁高炉的高度可以有效降低尾气中CO的含量
C.合成氨工业中,从生产实际条件考虑,不盲目增大反应压强
D.合成氨工业中,为提高氮气和氢气的利用率,采用循环操作
7.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g),下列叙述错误的是( )
A.使用Cu-Zn-Fe催化剂可大大提高生产效率
B.反应需在300 ℃下进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
8.纳米钴常用于CO加氢反应的催化剂:CO(g)+3H2(g)CH4(g)+H2O(g) ΔH<0,下列说法正确的是( )
A.纳米技术的应用,优化了催化剂的性能,提高了反应的转化率
B.缩小容器体积,平衡向正反应方向移动,CO的浓度增大
C.从平衡体系中分离出H2O(g)能加快正反应速率
D.工业生产中采用高温条件下进行,其目的是提高CO的平衡转化率
9.某研究小组为探究催化剂对尾气中CO、NO转化的影响,将含NO和CO的尾气在不同温度下,以一定的流速通过两种不同的催化剂进行反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,测量相同时间内逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。下列说法正确的是( )
①两种催化剂均能降低反应的活化能,但ΔH均不变
②相同条件下,改变压强对脱氮率没有影响
③曲线Ⅱ中的催化剂的最适宜温度为450 ℃左右
④a点的脱氮率是对应温度下的平衡脱氮率
⑤若低于200 ℃,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是催化剂的活性不高
A.①②③ B.①③④
C.②③④ D.①③⑤
10.CH4-CO2催化重整可以得到合成气(CO和H2),有利于缓解温室效应,其主要反应为CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1,同时存在以下反应:CH4(g)??C(s)+2H2(g) ΔH=+75 kJ·mol-1(积碳反应),CO2(g)+C(s)2CO(g) ΔH=+172 kJ·mol-1(消碳反应),假设体系温度恒定。积碳反应会影响催化剂的活性,一定时间内积碳量和反应温度的关系如图所示。下列说法正确的是( )
A.高压有利于提高CH4的平衡转化率并减少积碳
B.增大CO2与CH4的物质的量之比有助于减少积碳
C.升高温度,积碳反应的化学平衡常数K1减小,消碳反应的化学平衡常数K2增大
D.温度高于600 ℃,积碳反应的化学反应速率减慢,消碳反应的化学反应速率加快,积碳量减少
11.(2022·江苏南通期中)一定条件下,将一定量的CO2和H2混合气体通过装有催化剂的反应器可得到甲烷。
已知:Ⅰ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41 kJ·mol-1
Ⅱ.CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=-165 kJ·mol-1
在两种不同催化剂作用下反应相同时间,CO2转化率和生成CH4选择性随温度变化关系如图所示(CH4选择性=×100%)。
下列说法不正确的是( )
A.反应CO(g)+3H2(g)===CH4(g)+H2O(g) ΔH=-206 kJ·mol-1
B.在280 ℃条件下反应制取CH4,选择催化剂A的效果较好
C.260~300 ℃间,使用催化剂A或B,升高温度时CH4的产率都增大
D.M点可能是该温度下的平衡点,延长反应时间,不一定能提高CH4的产率
12.近年来我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:CO2(g)+H2(g)H2O(g)+CO(g) ΔH1=+41.1 kJ·mol-1
CO(g)+2H2(g)CH3OH(g) ΔH2=-90.0 kJ·mol-1
写出CO2催化氢化合成甲醇的热化学方程式:________________________________。
(2)为提高CH3OH(g)的产率,理论上应采用的条件是________(填字母)。
a.高温高压 b.低温低压
c.高温低压 d.低温高压
(3)250 ℃时,在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[]时某反应物X的平衡转化率的变化曲线。
反应物X是________(填“CO2”或“H2”)。
(4)250 ℃时,在体积为2.0 L的恒容密闭容器中加入6 mol H2、2 mol CO2和催化剂,10 min时反应达到平衡,测得c(CH3OH)=0.75 mol·L-1。
①前10 min内平均反应速率v(H2)=________ mol·L-1·min-1。
②化学平衡常数K=______________________________________________________。
③催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到的四组实验数据如表所示:
实验编号 温度/K 催化剂 CO2的转化率/% 甲醇的选择性/%
A 543 Cu/ZnO纳米棒 12.3 42.3
B 543 Cu/ZnO纳米片 11.9 72.7
C 553 Cu/ZnO纳米棒 15.3 39.1
D 553 Cu/ZnO纳米片 12.0 70.6
根据上表所给数据,用CO2生产甲醇的最优条件为________(填实验编号)。
13.(2022·陕西眉县高二期中)CO2可用来生产燃料甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=- 49 kJ·mol-1。在体积为1 L的恒容密闭容器中,充入1 mol CO2和2 mol H2,一定条件下发生上述反应,测得CH3OH(g)浓度随时间的变化如表所示:
时间/min 0 3 5 10 15
浓度/(mol·L-1) 0 0.3 0.45 0.5 0.5
(1)H2的平衡转化率为________。该条件下上述反应的平衡常数K=________。
(2)下列措施中能使平衡体系中增大且不减慢化学反应速率的是________(填字母)。
A.升高温度
B.充入He(g),使体系压强增大
C.再充入1 mol H2
D.将H2O(g)从体系中分离出去
(3)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________(填“>”“<”或“=”)c2。
(4)要提高CO2的转化率,可以采取的措施是____(填字母)。
A.加入催化剂
B.增大CO2的浓度
C.通入惰性气体
D.通入H2
E.分离出甲醇
(5)在使用不同催化剂时,相同时间内测得CO2的转化率随温度的变化如图所示。
则催化效果最佳的是催化剂____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。如果a点已经达到平衡状态,则b点的v正_____(填“>”“<”或“=”)v逆,c点转化率比a点低的原因是______________。
14.(2022·莱州市高二检测)Ⅰ.“丁烯裂解法”是一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。反应如下:
主反应:3C4H84C3H6;
副反应:C4H82C2H4。
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:
(1)平衡体系中的丙烯和乙烯的质量比[]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是________(填字母)。
A.300 ℃ 0.1 MPa B.700 ℃ 0.1 MPa
C.300 ℃ 0.5 MPa D.700 ℃ 0.5 MPa
(2)有研究者结合图1数据并综合考虑各种因素,认为450 ℃的反应温度比300 ℃或700 ℃更合适,从反应原理角度分析其理由可能是____________________________________
________________________________________________________________________。
(3)图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是________________________________________________________________________
________________________________________________________________________。
Ⅱ.353 K时,在刚性容器中充入CH3OH,发生反应:CH3OHCO+2H2 ΔH>0。体系的总压强p随时间t的变化如表所示。
t/min 0 5 10 15 20 ∞
p/kPa 101.2 107.4 112.6 116.4 118.6 121.2
(4)若升高反应温度至373 K,则CH3OH分解后体系压强p∞________(填“大于”“小于”或“等于”)121.2 kPa,原因是_________________________________。
(5)353 K时,当该反应达到平衡后,继续充入少量CO(g),反应经过一段时候后重新达到平衡,此时与旧平衡相比,CH3OH的体积分数________(填“增大”“减小”或“不变”)。
第四节 化学反应的调控
1.B 2.C 3.C
4.C [该反应为可逆反应,加入的1 mol N2和3 mol H2不可能完全反应生成NH3,所以反应放出的热量小于92.4 kJ,A项错误;从状态A到状态B,改变的是压强,温度未发生变化,所以平衡常数不变,B项错误;该反应是反应前后气体分子数减小的反应,增大压强平衡向正反应方向移动,H2的转化率增大,C项正确;升高温度,平衡逆向移动,K减小,D项错误。]
5.D [因为乙容器中的原料投入量正好是甲的2倍,故A项正确;假设开始时乙容器的体积是甲的2倍(如图甲、虚拟乙),再将虚拟乙容器的体积压缩至与甲相等(如图乙),
则在此过程中化学平衡要向正反应方向移动,即N2、H2的平衡转化率增大,它们在平衡混合气体中的体积分数减小,故C项正确、D项错误;平衡时,乙中N2、H2、NH3的浓度分别比甲中N2、H2、NH3的浓度大,但乙中N2、H2的浓度要分别小于甲中N2、H2浓度的2倍,而乙中NH3的浓度要大于甲中NH3浓度的2倍,故B项正确。]
6.B 7.B 8.B
9.D [①催化剂可降低反应的活化能,但不改变反应的ΔH,正确;②该反应为气体分子数减小的反应,改变压强平衡发生移动,则改变压强对脱氮率有影响,错误;③由图可知,曲线Ⅱ中450 ℃左右脱氮率最大,则曲线Ⅱ中的催化剂的最适宜温度为450 ℃左右,正确;④因为该反应是放热反应,降低温度,平衡正向移动,则a点对应温度下的平衡脱氮率应大于450 ℃下的脱氮率,错误;⑤催化剂的活性受温度的影响,则低于200 ℃时,图中曲线Ⅰ脱氮率随温度升高变化不大的主要原因是催化剂的活性不高,正确。]
10.B
11.D [根据盖斯定律反应Ⅱ-反应Ⅰ可得CO(g)+3H2(g)===CH4(g)+H2O(g) ΔH=
-165 kJ·mol-1-(+41 kJ·mol-l)=-206 kJ·mol-1,A正确;据图可知在280 ℃条件下反应,使用催化剂A时CH4的选择性更高,B正确;由图可知,260~300 ℃间,使用催化剂A或B,升高温度时CO2的转化率都增大,CH4的选择性都增大,则产率都增大,C正确;据图可知选用催化剂A时,在与M点相同温度条件下,CO2有更高的转化率,而催化剂不影响平衡,说明M点一定不是平衡点,D错误。]
12.(1)3H2(g)+CO2(g)CH3OH(g)+H2O(g) ΔH=-48.9 kJ·mol-1 (2)d (3)CO2
(4)①0.225 ② ③B
解析 (1)根据盖斯定律,将题述两个热化学方程式相加可得:3H2(g)+CO2(g)CH3OH(g)+H2O(g) ΔH=-48.9 kJ·mol-1。(2)根据热化学方程式可知,生成CH3OH(g)的反应是放热反应,也是气体体积减小的反应,故要想提高CH3OH(g)的产率,需要低温高压。(3)图中的横坐标为,假设n(CO2)为定值,则CO2的平衡转化率随n(H2)的增大而增大,故反应物X为CO2。(4)①CH3OH(g)的浓度变化量为0.75 mol·L-1,则:
3H2(g)+CO2(g)CH3OH(g)+H2O(g)
起始/(mol·L-1) 3 1 0 0
转化/(mol·L-1) 2.25 0.75 0.75 0.75
平衡/(mol·L-1) 0.75 0.25 0.75 0.75
H2的浓度变化量为2.25 mol·L-1,则前10 min内平均反应速率v(H2)=0.225 mol·L-1·min-1。②K===。③选择性是指产物的专一性,在一个化学反应中若有多个产物,其中某一产物是目标产物,若这个物质的产率越高,说明该反应的选择性越好。观察四组数据,相比之下,B、D中甲醇的选择性好,虽然B中CO2的转化率比D中的稍低些,但是B中CH3OH(g)的选择性比D中的好,故B为最优条件。
13.(1)75% 4 (2)C (3)< (4)DE
(5)Ⅰ > 该反应放热,温度升高,平衡逆向移动
14.(1)C
(2)450 ℃比300 ℃的反应速率快,比700 ℃的副反应程度小;该温度下丁烯转化为丙烯的转化率高;该温度下催化剂的选择性最高;该温度是催化剂的活性温度
(3)压强增大,生成乙烯的副反应平衡逆向移动,丁烯浓度增大,导致主反应的平衡正向移动,从而使丙烯的含量增大
(4)大于 CH3OH(g)CO(g)+2H2(g)的正反应为气体体积增大的吸热反应,温度升高,平衡右移,气体总物质的量增大,容器体积不变,总压强变大 (5)减小
