2.1.3碳酸钠和碳酸氢钠 焰色试验 课件(共37张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.3碳酸钠和碳酸氢钠 焰色试验 课件(共37张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 124.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 20:34:49 | ||
图片预览








文档简介
(共37张PPT)
2.1 钠及其化合物
第三课时 碳酸钠和碳酸氢钠 焰色试验
【温故知新,可以为师】
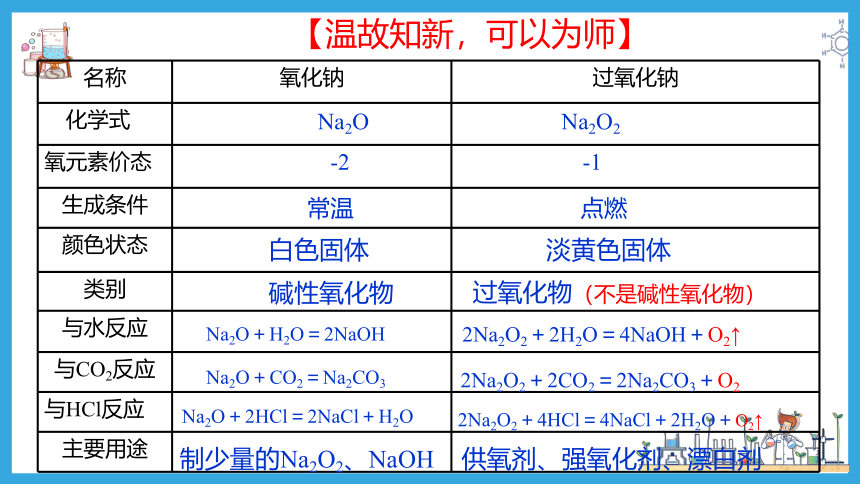
名称 氧化钠 过氧化钠
化学式
氧元素价态
生成条件
颜色状态
类别
与水反应
与CO2反应
与HCl反应
主要用途
过氧化物(不是碱性氧化物)
碱性氧化物
-2 -1
常温 点燃
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
淡黄色固体
白色固体
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
Na2O Na2O2
供氧剂、强氧化剂、漂白剂
制少量的Na2O2、NaOH
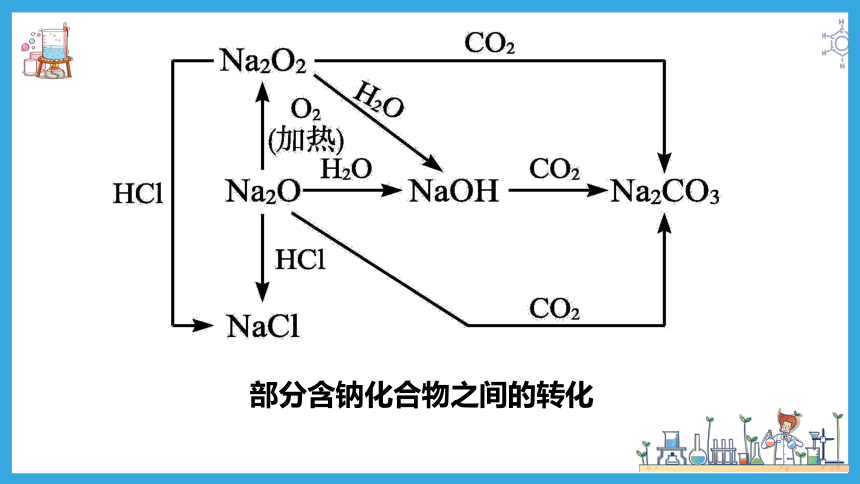
部分含钠化合物之间的转化
在烹制面包时常常用到小苏打,你知道小苏打的成分是什么吗?
苏氏三兄弟
Na2S2O3
硫代硫酸钠
大苏打(海波)
Na2CO3
NaHCO3
苏 打(纯碱)
小苏打
碳酸氢钠
碳酸钠
素养要求
1. 通过实验认识Na2CO3、NaHCO3的性质,培养科学探究意识。
2.了解焰色试验的操作和原理,并能作出解释。
1
碳酸钠和碳酸氢钠
在2支试管中分别加入少量Na2CO3和NaHCO3(各1 g),完成下列实验,并将实验现象和相应的结论填入表中。
实验目的:
【实验2-4】
Na2CO3和NaHCO3在水中的溶解性及其溶液的酸碱性
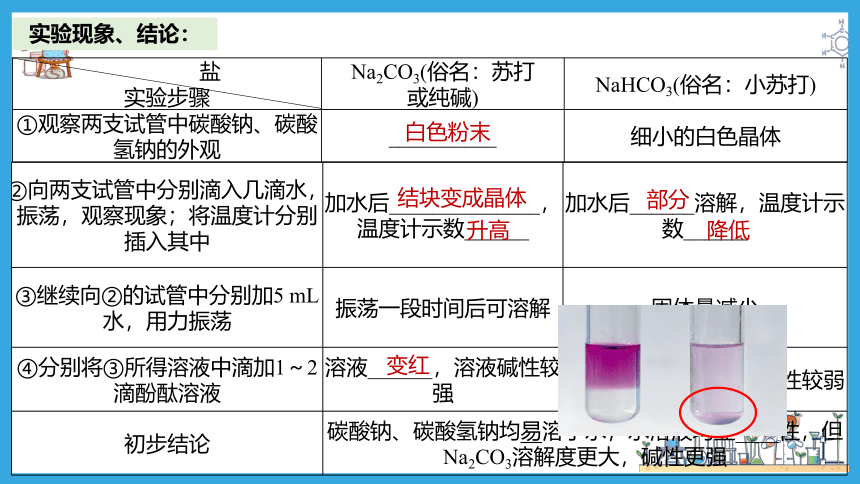
实验现象、结论:
盐 实验步骤 Na2CO3(俗名:苏打 或纯碱) NaHCO3(俗名:小苏打)
①观察两支试管中碳酸钠、碳酸氢钠的外观 __________ 细小的白色晶体
白色粉末
②向两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中 加水后______________,温度计示数______ 加水后______溶解,温度计示数______
③继续向②的试管中分别加5 mL水,用力振荡 振荡一段时间后可溶解 固体量减少
④分别将③所得溶液中滴加1~2滴酚酞溶液 溶液______,溶液碱性较强 溶液________,溶液碱性较弱
初步结论 碳酸钠、碳酸氢钠均易溶于水,水溶液均显____性,但Na2CO3溶解度更大,碱性更强 结块变成晶体
升高
部分
降低
变红
变浅红
碱
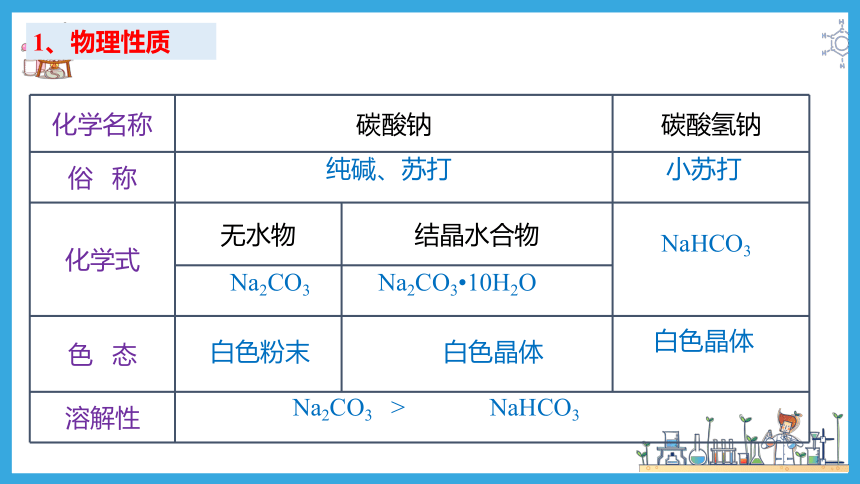
1、物理性质
化学名称 碳酸钠 碳酸氢钠
俗 称
化学式 无水物 结晶水合物
色 态
溶解性 纯碱、苏打
小苏打
Na2CO3
Na2CO3 10H2O
NaHCO3
白色粉末
白色晶体
白色晶体
Na2CO3 >
NaHCO3
碳酸钠粉末吸湿性很强,遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3 xH2O)。碳酸钠晶体在干燥空气中容易风化失去结晶水而变成碳酸钠粉末。
碳酸钠和碳酸氢钠都是盐,但溶液都呈碱性。日常的食用碱主要是十水碳酸钠,俗称洗涤碱;NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。
小知识
2.碳酸钠、碳酸氢钠的化学性质
【实验2-5】
(1)碳酸钠、碳酸氢钠的热稳定性
实验操作 实验现象 实验结论
澄清石灰水 _________ _________________________________
澄清石灰水_______ ;
化学方程式:_________________
______________________
不变浑浊
变浑浊
Na2CO3很稳定,受热不易发生分解
NaHCO3不稳定,受热容易分解
Na2CO3+CO2↑+H2O
(2)探究Na2CO3和NaHCO3与稀盐酸的反应
实验 步骤 在两支试管中分别加入3 mL同一稀盐酸,将两个分别装有0.3 g Na2CO3和0.3 g NaHCO3固体的小气球套在两支试管口,将气球内固体同时倒入试管中,观察现象
实验 操作
实验现象 两支试管中都产生无色 ,气球 ,加入碳酸氢钠的试管中气泡产生得 ,气球膨胀得更大。
气泡
膨胀
更快
NaHCO3
Na2CO3
+2H+= H2O + CO2↑
NaHCO3+HCl=NaCl+ H2O + CO2 ↑
+H+=H2O+CO2↑
分步反应:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+ H2O + CO2↑
快
慢
化学方程式:
离子方程式:
离子方程式:
化学方程式:
Na2CO3+2HCl=2NaCl+ H2O+CO2 ↑
思 考:向饱和Na2CO3溶液中通入过量的CO2,有何现象?为什么?
原因:Na2CO3 + CO2 + H2O = 2NaHCO3
溶解度: Na2CO3 > NaHCO3 、CaCO3 < Ca(HCO3)2
现象:溶液变浑浊。
由于同温下,NaHCO3的溶解度比Na2CO3的溶解度小,所以有固体析出。
(3)探究Na2CO3、NaHCO3和盐(CaCl2)及碱[Ca(OH)2]的反应
盐(CaCl2) 碱[Ca(OH)2]
实验操作及步骤
现象及结论
①加入稀Na2CO3溶液,立即产生白色沉淀,离子方程式:__________ ;
②加入少量稀NaHCO3溶液,无明显现象,说明稀CaCl2和少量稀NaHCO3溶液_______
Ca2++CO32-=CaCO3↓
不反应
两支试管中都产生____ 。离子方程式分别为__________________ 、________________________
白色沉淀
Ca2++CO32-=CaCO3↓
HCO3-+Ca2++OH-=CaCO3↓+H2O
3.Na2CO3和NaHCO3 用途
制玻璃
制肥皂
造纸
纺织等
发酵剂
灭火剂等
Na2CO3
NaHCO3
制药
4.碳酸钠的工业制备
侯氏(联合)制碱法生产原理流程:
【科学史话】
【思考】碳酸钠与碳酸氢钠的鉴别
溶液
固体
沉淀法:
气体法:
酚酞法:
测pH法:
加热法:
加酸法:
加少量水:
加入BaCl2(CaCl2)溶液,产生沉淀的是Na2CO3
逐滴加入盐酸,立即产生气泡的是NaHCO3
向等浓度的Na2CO3和NaHCO3溶液中滴入几滴酚酞,溶液明显变红的是Na2CO3溶液。
用pH试纸测溶液的pH,pH大的是Na2CO3溶液
加热产生使澄清石灰水变浑浊的气体的是NaHCO3
加少量水Na2CO3结块,且有明显的放热现象,加大量水Na2CO3完全溶解,NaHCO3部分溶解。
加入少量的酸,NaHCO3比Na2CO3反应更剧烈。
【思维在线】
【思考】常用的除杂(提纯)方法
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
1.判断正误
(1)碳酸氢钠可用于治疗胃酸过多
(2) 在强酸性、强碱性溶液中均不能大量存在
(3)Na2CO3、NaHCO3都能与NaOH溶液反应
(4)Na2CO3俗称纯碱,所以Na2CO3属于碱
(5)可用加热法除去Na2CO3固体中少量的NaHCO3杂质
(6)只用盐酸无法鉴别等浓度的NaHCO3和Na2CO3溶液
×
×
√
√
√
×
加热
通入足量CO2气体
【思维在线】
【思考】Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O),且在干燥空气中失去结晶水变成碳酸钠粉末,那么钠露置在空气中,最终会完全转变成什么?
【思维在线】
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
2
焰色试验
利用很多 或它们的 在灼烧时都会使火焰呈现出特征颜色判断试样所含的金属元素,化学上把这样的 分析操作称为焰色试验。焰色试验是元素的 性质。
金属
化合物
定性
物理
1.定义
2、应用:
(1)检验 的存在。
(2)利用焰色试验制节日烟花。
金属元素
3.实验操作
洗:将铂丝(或光洁的铁丝)用________洗净。烧:将洗净的铂丝在火焰上灼烧至与原火焰颜色相同。蘸:蘸取试样。烧:在无色火焰上灼烧,并观察火焰________。洗:再用________洗净铂丝,并在火焰上灼烧至________。
盐酸
颜色
盐酸
无色
一些金属及化合物的焰色反应
4.几种金属元素的焰色
元素 锂 钠 钾 铷 钙 锶 钡 铜
焰色 _______色 ____色 ____色(透过 __________) 紫色 ______ 色 洋红 色 ______色 ______色
紫红
黄
紫
蓝色钴玻璃
砖红
黄绿
绿
思 考: 1.在洗涤时能否把盐酸改为硝酸或硫酸?
不能,盐酸是低沸点酸易挥发。用盐酸清洗是洗去铂丝上沾有的杂质,以免干扰实验。硫酸不易挥发,在灼烧时不易挥发除去。而硝酸在加热时发生分解,产生较多的污染性气体。
不是,如铂丝,铁,铝等都不能发生。
2.所有的金属元素都能发生颜色反应吗?
【思维在线】
一 碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠 焰色试验
二 焰色试验
1. Na2CO3、NaHCO3性质探究
1. 定义
2. Na2CO3、NaHCO3的应用
2. 实验操作
3. 一些金属元素的焰色
1. 某些物理性质
2. 热稳定性
3. 与钙盐、钡盐等反应
4. 与某些碱的反应
5. 与盐酸的反应
【课堂小结】
物质 Na2CO3 NaHCO3
俗名
色态
水溶性 与酚酞作用
热稳定性
与酸反应
与碱反应
小苏打
纯碱、苏打
白色粉末
细小白色晶体
易溶
溶液变红,显碱性
稳定,加热不分解
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
易溶
Na2CO3 > NaHCO3
溶液变红,显碱性
不稳定,加热分解
Na2CO3==不反应
CO32- + 2H+=H2O+CO2↑
HCO3- + H+=H2O+CO2↑
反应速率:Na2CO3 < NaHCO3
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
Na2CO3+NaOH 不反应
NaOH、Ca(OH)2
Ba(OH)2
2NaHCO3== Na2CO3+H2O+CO2↑
物质 Na2CO3 NaHCO3
与CaCl2 或BaCl2反应
相互转化
Na2CO3 NaHCO3
CO2+H2O
①加热,②OH-
区别Na2CO3和NaHCO3的方法:
①加热
加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3
②滴入CaCl2或BaCl2溶液
产生白色沉淀的是Na2CO3
③逐滴滴入稀HCl
首先产生气体且反应较剧烈的是NaHCO3
Na2CO3+CaCl2=CaCO3↓+2NaCl
不反应
Na2CO3+BaCl2=BaCO3↓+2NaCl
【例1】对Na2O2与CO2和H2O(g)混合气体的反应来说,下列说法错误的是
A.只要参加反应的Na2O2一定,反应生成的氧气就一定
B.只要CO2和H2O(g)的总量一定,反应所消耗的Na2O2的量就一定
C.只要气体的总数量一定,反应中所转移的电子的数量就一定
D.只要混合气体的总数量一定,固体所增加的质量就一定
D
【典例分析】
3
课堂检测
1.(2023·桂林高一检测)在做面包、蛋糕等面食点心时需要加入一定量的发酵粉,下列物质是发酵粉的主要成分之一的是( )
A.氯化钠 B.碳酸钠
C.硫酸钠 D.碳酸氢钠
D
2.下列有关焰色试验的叙述正确的是( )
A.可用铜丝代替铂丝进行试验
B.观察钾的焰色试验要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色试验是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化学性质
B
3.以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是( )
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤⑥说明Na2O2可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应等
B
4.某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验如图。请观察如图实验装置并分析实验原理,判断下列说法错误的是
A.甲为Na2CO3,乙为NaHCO3
B.甲为NaHCO3,乙为Na2CO3
C.要证明物质受热能产生水,可在两支试管
内塞入沾有无水硫酸铜粉末的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
A
5.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸氢钠的化学式是________,俗称________,其水溶液显_____(填“酸”“碱”或“中”)性。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_________________________。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量:前者_____(填“>”“<”或“=”)后者。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为_______________
____________________。
NaHCO3
小苏打
碱
<
Na2CO3+H2O+CO2↑
2.1 钠及其化合物
第三课时 碳酸钠和碳酸氢钠 焰色试验
【温故知新,可以为师】
名称 氧化钠 过氧化钠
化学式
氧元素价态
生成条件
颜色状态
类别
与水反应
与CO2反应
与HCl反应
主要用途
过氧化物(不是碱性氧化物)
碱性氧化物
-2 -1
常温 点燃
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
淡黄色固体
白色固体
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
Na2O Na2O2
供氧剂、强氧化剂、漂白剂
制少量的Na2O2、NaOH
部分含钠化合物之间的转化
在烹制面包时常常用到小苏打,你知道小苏打的成分是什么吗?
苏氏三兄弟
Na2S2O3
硫代硫酸钠
大苏打(海波)
Na2CO3
NaHCO3
苏 打(纯碱)
小苏打
碳酸氢钠
碳酸钠
素养要求
1. 通过实验认识Na2CO3、NaHCO3的性质,培养科学探究意识。
2.了解焰色试验的操作和原理,并能作出解释。
1
碳酸钠和碳酸氢钠
在2支试管中分别加入少量Na2CO3和NaHCO3(各1 g),完成下列实验,并将实验现象和相应的结论填入表中。
实验目的:
【实验2-4】
Na2CO3和NaHCO3在水中的溶解性及其溶液的酸碱性
实验现象、结论:
盐 实验步骤 Na2CO3(俗名:苏打 或纯碱) NaHCO3(俗名:小苏打)
①观察两支试管中碳酸钠、碳酸氢钠的外观 __________ 细小的白色晶体
白色粉末
②向两支试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中 加水后______________,温度计示数______ 加水后______溶解,温度计示数______
③继续向②的试管中分别加5 mL水,用力振荡 振荡一段时间后可溶解 固体量减少
④分别将③所得溶液中滴加1~2滴酚酞溶液 溶液______,溶液碱性较强 溶液________,溶液碱性较弱
初步结论 碳酸钠、碳酸氢钠均易溶于水,水溶液均显____性,但Na2CO3溶解度更大,碱性更强 结块变成晶体
升高
部分
降低
变红
变浅红
碱
1、物理性质
化学名称 碳酸钠 碳酸氢钠
俗 称
化学式 无水物 结晶水合物
色 态
溶解性 纯碱、苏打
小苏打
Na2CO3
Na2CO3 10H2O
NaHCO3
白色粉末
白色晶体
白色晶体
Na2CO3 >
NaHCO3
碳酸钠粉末吸湿性很强,遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3 xH2O)。碳酸钠晶体在干燥空气中容易风化失去结晶水而变成碳酸钠粉末。
碳酸钠和碳酸氢钠都是盐,但溶液都呈碱性。日常的食用碱主要是十水碳酸钠,俗称洗涤碱;NaHCO3是发酵粉的主要成分,也用于制灭火剂、焙粉或清凉饮料等方面的原料,在橡胶工业中作发泡剂。
小知识
2.碳酸钠、碳酸氢钠的化学性质
【实验2-5】
(1)碳酸钠、碳酸氢钠的热稳定性
实验操作 实验现象 实验结论
澄清石灰水 _________ _________________________________
澄清石灰水_______ ;
化学方程式:_________________
______________________
不变浑浊
变浑浊
Na2CO3很稳定,受热不易发生分解
NaHCO3不稳定,受热容易分解
Na2CO3+CO2↑+H2O
(2)探究Na2CO3和NaHCO3与稀盐酸的反应
实验 步骤 在两支试管中分别加入3 mL同一稀盐酸,将两个分别装有0.3 g Na2CO3和0.3 g NaHCO3固体的小气球套在两支试管口,将气球内固体同时倒入试管中,观察现象
实验 操作
实验现象 两支试管中都产生无色 ,气球 ,加入碳酸氢钠的试管中气泡产生得 ,气球膨胀得更大。
气泡
膨胀
更快
NaHCO3
Na2CO3
+2H+= H2O + CO2↑
NaHCO3+HCl=NaCl+ H2O + CO2 ↑
+H+=H2O+CO2↑
分步反应:Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+ H2O + CO2↑
快
慢
化学方程式:
离子方程式:
离子方程式:
化学方程式:
Na2CO3+2HCl=2NaCl+ H2O+CO2 ↑
思 考:向饱和Na2CO3溶液中通入过量的CO2,有何现象?为什么?
原因:Na2CO3 + CO2 + H2O = 2NaHCO3
溶解度: Na2CO3 > NaHCO3 、CaCO3 < Ca(HCO3)2
现象:溶液变浑浊。
由于同温下,NaHCO3的溶解度比Na2CO3的溶解度小,所以有固体析出。
(3)探究Na2CO3、NaHCO3和盐(CaCl2)及碱[Ca(OH)2]的反应
盐(CaCl2) 碱[Ca(OH)2]
实验操作及步骤
现象及结论
①加入稀Na2CO3溶液,立即产生白色沉淀,离子方程式:__________ ;
②加入少量稀NaHCO3溶液,无明显现象,说明稀CaCl2和少量稀NaHCO3溶液_______
Ca2++CO32-=CaCO3↓
不反应
两支试管中都产生____ 。离子方程式分别为__________________ 、________________________
白色沉淀
Ca2++CO32-=CaCO3↓
HCO3-+Ca2++OH-=CaCO3↓+H2O
3.Na2CO3和NaHCO3 用途
制玻璃
制肥皂
造纸
纺织等
发酵剂
灭火剂等
Na2CO3
NaHCO3
制药
4.碳酸钠的工业制备
侯氏(联合)制碱法生产原理流程:
【科学史话】
【思考】碳酸钠与碳酸氢钠的鉴别
溶液
固体
沉淀法:
气体法:
酚酞法:
测pH法:
加热法:
加酸法:
加少量水:
加入BaCl2(CaCl2)溶液,产生沉淀的是Na2CO3
逐滴加入盐酸,立即产生气泡的是NaHCO3
向等浓度的Na2CO3和NaHCO3溶液中滴入几滴酚酞,溶液明显变红的是Na2CO3溶液。
用pH试纸测溶液的pH,pH大的是Na2CO3溶液
加热产生使澄清石灰水变浑浊的气体的是NaHCO3
加少量水Na2CO3结块,且有明显的放热现象,加大量水Na2CO3完全溶解,NaHCO3部分溶解。
加入少量的酸,NaHCO3比Na2CO3反应更剧烈。
【思维在线】
【思考】常用的除杂(提纯)方法
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
1.判断正误
(1)碳酸氢钠可用于治疗胃酸过多
(2) 在强酸性、强碱性溶液中均不能大量存在
(3)Na2CO3、NaHCO3都能与NaOH溶液反应
(4)Na2CO3俗称纯碱,所以Na2CO3属于碱
(5)可用加热法除去Na2CO3固体中少量的NaHCO3杂质
(6)只用盐酸无法鉴别等浓度的NaHCO3和Na2CO3溶液
×
×
√
√
√
×
加热
通入足量CO2气体
【思维在线】
【思考】Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O),且在干燥空气中失去结晶水变成碳酸钠粉末,那么钠露置在空气中,最终会完全转变成什么?
【思维在线】
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
2
焰色试验
利用很多 或它们的 在灼烧时都会使火焰呈现出特征颜色判断试样所含的金属元素,化学上把这样的 分析操作称为焰色试验。焰色试验是元素的 性质。
金属
化合物
定性
物理
1.定义
2、应用:
(1)检验 的存在。
(2)利用焰色试验制节日烟花。
金属元素
3.实验操作
洗:将铂丝(或光洁的铁丝)用________洗净。烧:将洗净的铂丝在火焰上灼烧至与原火焰颜色相同。蘸:蘸取试样。烧:在无色火焰上灼烧,并观察火焰________。洗:再用________洗净铂丝,并在火焰上灼烧至________。
盐酸
颜色
盐酸
无色
一些金属及化合物的焰色反应
4.几种金属元素的焰色
元素 锂 钠 钾 铷 钙 锶 钡 铜
焰色 _______色 ____色 ____色(透过 __________) 紫色 ______ 色 洋红 色 ______色 ______色
紫红
黄
紫
蓝色钴玻璃
砖红
黄绿
绿
思 考: 1.在洗涤时能否把盐酸改为硝酸或硫酸?
不能,盐酸是低沸点酸易挥发。用盐酸清洗是洗去铂丝上沾有的杂质,以免干扰实验。硫酸不易挥发,在灼烧时不易挥发除去。而硝酸在加热时发生分解,产生较多的污染性气体。
不是,如铂丝,铁,铝等都不能发生。
2.所有的金属元素都能发生颜色反应吗?
【思维在线】
一 碳酸钠和碳酸氢钠
碳酸钠和碳酸氢钠 焰色试验
二 焰色试验
1. Na2CO3、NaHCO3性质探究
1. 定义
2. Na2CO3、NaHCO3的应用
2. 实验操作
3. 一些金属元素的焰色
1. 某些物理性质
2. 热稳定性
3. 与钙盐、钡盐等反应
4. 与某些碱的反应
5. 与盐酸的反应
【课堂小结】
物质 Na2CO3 NaHCO3
俗名
色态
水溶性 与酚酞作用
热稳定性
与酸反应
与碱反应
小苏打
纯碱、苏打
白色粉末
细小白色晶体
易溶
溶液变红,显碱性
稳定,加热不分解
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
易溶
Na2CO3 > NaHCO3
溶液变红,显碱性
不稳定,加热分解
Na2CO3==不反应
CO32- + 2H+=H2O+CO2↑
HCO3- + H+=H2O+CO2↑
反应速率:Na2CO3 < NaHCO3
NaHCO3+Ca(OH)2=CaCO3↓+NaOH+H2O
Na2CO3+NaOH 不反应
NaOH、Ca(OH)2
Ba(OH)2
2NaHCO3== Na2CO3+H2O+CO2↑
物质 Na2CO3 NaHCO3
与CaCl2 或BaCl2反应
相互转化
Na2CO3 NaHCO3
CO2+H2O
①加热,②OH-
区别Na2CO3和NaHCO3的方法:
①加热
加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3
②滴入CaCl2或BaCl2溶液
产生白色沉淀的是Na2CO3
③逐滴滴入稀HCl
首先产生气体且反应较剧烈的是NaHCO3
Na2CO3+CaCl2=CaCO3↓+2NaCl
不反应
Na2CO3+BaCl2=BaCO3↓+2NaCl
【例1】对Na2O2与CO2和H2O(g)混合气体的反应来说,下列说法错误的是
A.只要参加反应的Na2O2一定,反应生成的氧气就一定
B.只要CO2和H2O(g)的总量一定,反应所消耗的Na2O2的量就一定
C.只要气体的总数量一定,反应中所转移的电子的数量就一定
D.只要混合气体的总数量一定,固体所增加的质量就一定
D
【典例分析】
3
课堂检测
1.(2023·桂林高一检测)在做面包、蛋糕等面食点心时需要加入一定量的发酵粉,下列物质是发酵粉的主要成分之一的是( )
A.氯化钠 B.碳酸钠
C.硫酸钠 D.碳酸氢钠
D
2.下列有关焰色试验的叙述正确的是( )
A.可用铜丝代替铂丝进行试验
B.观察钾的焰色试验要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色试验是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化学性质
B
3.以不同类别物质间的转化为线索,认识钠及其化合物。
下列分析不正确的是( )
A.反应③表明CO2具有酸性氧化物的性质
B.反应④说明NaHCO3的稳定性强于Na2CO3
C.反应⑤⑥说明Na2O2可用于潜水艇中氧气的供给
D.上述转化中发生的反应有分解反应、化合反应、置换反应等
B
4.某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验如图。请观察如图实验装置并分析实验原理,判断下列说法错误的是
A.甲为Na2CO3,乙为NaHCO3
B.甲为NaHCO3,乙为Na2CO3
C.要证明物质受热能产生水,可在两支试管
内塞入沾有无水硫酸铜粉末的棉花球
D.整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
A
5.碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题:
(1)碳酸氢钠的化学式是________,俗称________,其水溶液显_____(填“酸”“碱”或“中”)性。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_________________________。等质量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量:前者_____(填“>”“<”或“=”)后者。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为_______________
____________________。
NaHCO3
小苏打
碱
<
Na2CO3+H2O+CO2↑
