第三章 第一节 第2课时 电离平衡常数 强酸与弱酸的比较 课时练(含答案)2023-2024学年化学人教(2019)
文档属性
| 名称 | 第三章 第一节 第2课时 电离平衡常数 强酸与弱酸的比较 课时练(含答案)2023-2024学年化学人教(2019) |  | |
| 格式 | docx | ||
| 文件大小 | 541.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 20:20:53 | ||
图片预览


文档简介
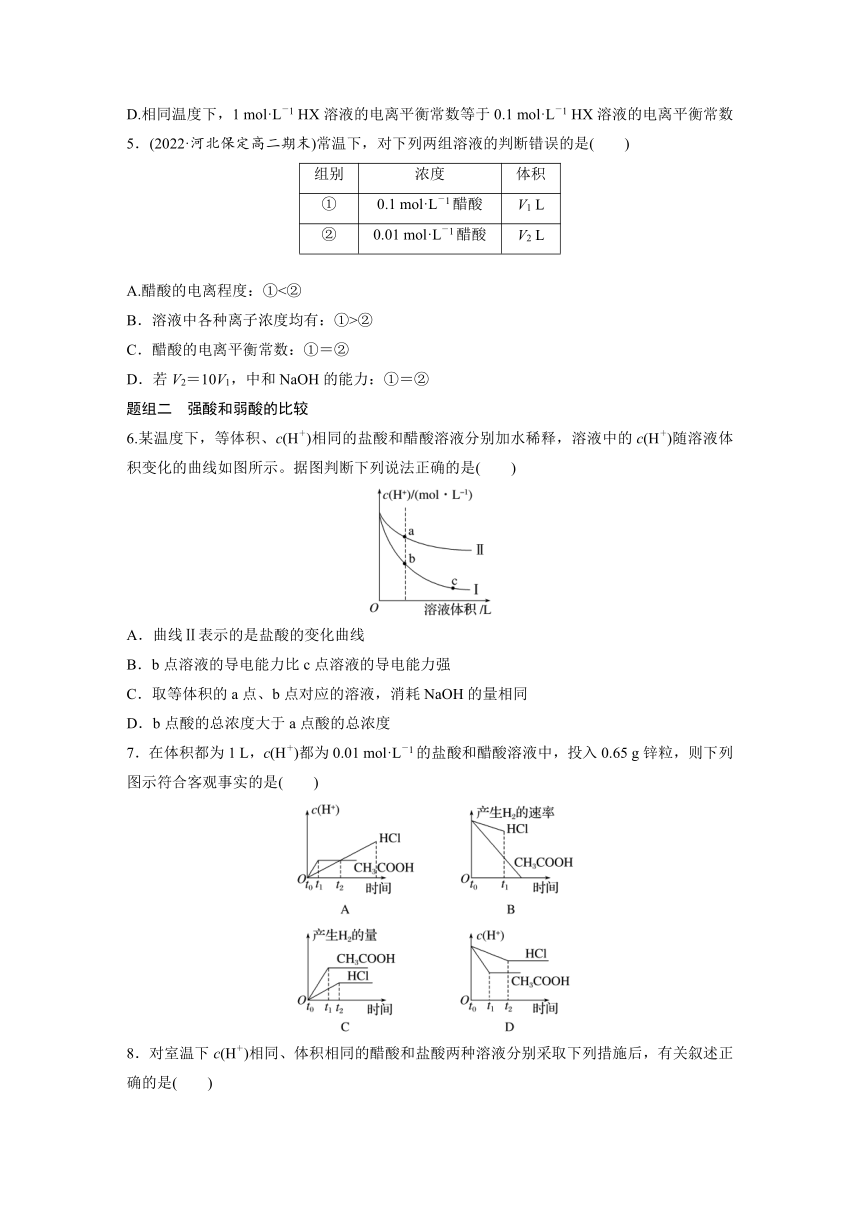
第2课时 电离平衡常数 强酸与弱酸的比较
题组一 电离平衡常数和电离度
1.下列关于电离常数的说法正确的是( )
A.Ka大的酸溶液中c(H+)一定比Ka小的酸溶液中的c(H+)大
B.CH3COOH的电离常数表达式为Ka=
C.向CH3COOH溶液中加入少量CH3COONa固体,电离常数减小
D.电离常数只与温度有关,与浓度无关
2.已知25 ℃下,CH3COOH溶液中各微粒的浓度存在以下关系:Ka==1.75×10-5。下列有关结论可能成立的是( )
A.25 ℃下,向该溶液中加入一定量的盐酸时,Ka=8×10-5
B.25 ℃下,向该溶液中加入一定量的氢氧化钠时,Ka=2×10-4
C.标准状况下,醋酸中Ka=1.75×10-5
D.升高到一定温度,Ka=7.2×10-5
3.下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离程度和浓度关系的是( )
4.相同温度下,三种酸的电离平衡常数如表所示,下列判断正确的是( )
酸 HX HY HZ
电离平衡常数Ka 9×10-7 9×10-6 1×10-2
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-===HY+Z-不能发生
C.由电离平衡常数可以判断:HZ属于强酸,HX和HY属于弱酸
D.相同温度下,1 mol·L-1 HX溶液的电离平衡常数等于0.1 mol·L-1 HX溶液的电离平衡常数
5.(2022·河北保定高二期末)常温下,对下列两组溶液的判断错误的是( )
组别 浓度 体积
① 0.1 mol·L-1醋酸 V1 L
② 0.01 mol·L-1醋酸 V2 L
A.醋酸的电离程度:①<②
B.溶液中各种离子浓度均有:①>②
C.醋酸的电离平衡常数:①=②
D.若V2=10V1,中和NaOH的能力:①=②
题组二 强酸和弱酸的比较
6.某温度下,等体积、c(H+)相同的盐酸和醋酸溶液分别加水稀释,溶液中的c(H+)随溶液体积变化的曲线如图所示。据图判断下列说法正确的是( )
A.曲线Ⅱ表示的是盐酸的变化曲线
B.b点溶液的导电能力比c点溶液的导电能力强
C.取等体积的a点、b点对应的溶液,消耗NaOH的量相同
D.b点酸的总浓度大于a点酸的总浓度
7.在体积都为1 L,c(H+)都为0.01 mol·L-1的盐酸和醋酸溶液中,投入0.65 g锌粒,则下列图示符合客观事实的是( )
8.对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施后,有关叙述正确的是( )
A.加适量的醋酸钠晶体后,两溶液的c(H+)均减小
B.使温度升高20 ℃后,两溶液的c(H+)均不变
C.加水稀释两倍后,两溶液的c(H+)均增大
D.加足量的锌充分反应后,两溶液产生的氢气一样多
9.(2022·鸡西高二月考)在溶液导电性实验装置里,相同温度下分别注入20 mL 6 mol·L-1醋酸和20 mL 6 mol·L-1氨水,灯光明暗程度相同,如果把这两种溶液混合后再实验,则下列说法正确的是( )
A.灯光变暗;CH3COOH的电离常数等于NH3·H2O
B.灯光变暗;CH3COOH的电离常数大于NH3·H2O
C.灯光变亮;CH3COOH的电离常数小于NH3·H2O
D.灯光变亮;CH3COOH的电离常数等于NH3·H2O
10.常温下,CH3COOH、HCOOH(甲酸)的电离平衡常数分别为1.75×10-5、1.8×10-4,以下关于0.1 mol·L-1 CH3COOH溶液、0.1 mol·L-1 HCOOH溶液的说法正确的是( )
A.c(H+):CH3COOH>HCOOH
B.等体积的两溶液中,分别加入过量的镁,产生氢气的体积:HCOOH>CH3COOH
C.HCOOH可能与NaOH发生反应:H++OH-===H2O
D.将CH3COOH溶液稀释100倍过程中,保持不变
11.高氯酸、硫酸、HCl和硝酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 HClO4 H2SO4 HCl HNO3
Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
由表格中的数据判断下列说法不正确的是( )
A.在冰醋酸中这四种酸都没有全部电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO
D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
12.(2022·聊城高二检测)已知25 ℃时,测得浓度为0.1 mol·L-1的碱BOH的溶液中,c(OH-)=1×10-3 mol·L-1。
(1)写出BOH的电离方程式:______________________________________________。
(2)BOH的电离平衡常数Kb=______________________________________________。
(3)某温度T ℃时,BOH的电离平衡常数为1×10-7,结合(2)的计算可知T________25。若该碱的起始浓度也为0.1 mol·L-1,则溶液中c(B+)=________mol·L-1。
13.(1)已知酸性:H2SO3>>HSO>,水杨酸()与Na2SO3溶液反应,生成物为________(填字母)。
A. B.SO2
C.NaHCO3 D.
(2)亚硫酸电离常数为Ka1、Ka2,改变0.1 mol·L-1亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,则=______。
14.(1)25 ℃时,a mol·L-1 CH3COOH溶液中c(H+)=10-b mol·L-1,用含a和b的代数式表示CH3COOH的电离常数Ka=____________。
(2)已知25 ℃时,Ka(CH3COOH)=1.75×10-5,Ka(HSCN)=0.13。在该温度下将20 mL 0.1 mol·
L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的曲线如图,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___________________________________________
_____________________________________________________________________________。
(3)下表是几种弱酸常温下的电离常数:
CH3COOH H2CO3 H2S H3PO4
Ka=1.75×10-5 Ka1=4.5×10-7 Ka2=4.7×10-11 Ka1=1.1×10-7 Ka2=1.3×10-13 Ka1=6.9×10-3 Ka2=6.2×10-8 Ka3=4.8×10-13
①CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为________________
________________________________________________________________________。
②多元弱酸的二级电离程度远小于一级电离的主要原因是______________________(从电离平衡角度考虑)。
③同浓度的CH3COO-、HCO、CO、S2-结合H+的能力由强到弱的顺序为________
________________________________________________________________________。
第2课时 电离平衡常数 强酸与弱酸的比较
1.D 2.D 3.B
4.D [A项,酸的电离平衡常数越大,酸的电离程度越大,其酸性越强,根据表中数据可知,酸的电离平衡常数:HZ>HY>HX,则酸性强弱:HZ>HY>HX,错误;B项,根据强酸制弱酸可知HZ+Y-===HY+Z-能够发生,错误;C项,完全电离的为强酸、部分电离的为弱酸,这三种酸都部分电离,均为弱酸,错误;D项,电离平衡常数只与温度有关,温度不变,电离平衡常数不变,正确。]
5.B [醋酸浓度越小,电离程度越大,A项正确;将①加水稀释可得到②,醋酸加水稀释,c(CH3COO-)、c(H+)均减小,但c(OH-)增大,B项错误;温度不变,醋酸的电离平衡常数不变,C项正确;若V2=10V1,两种醋酸的物质的量相同,中和NaOH的能力相同,D项正确。]
6.B 7.C 8.A
9.D [相同温度下,20 mL 6 mol·L-1醋酸和20 mL 6 mol·L-1氨水装置中的灯光亮度相同,说明等浓度的二者溶液中离子浓度相等,即二者电离常数相等;醋酸和氨水两种溶液混合生成强电解质醋酸铵,自由移动的离子浓度变大,溶液的导电能力增强,灯光变亮。]
10.D [等浓度的甲酸和乙酸溶液,甲酸酸性强、电离程度大,所以溶液中的c(H+):CH3COOH<HCOOH,故A错误;等浓度等体积的甲酸和乙酸溶液中,甲酸和乙酸的物质的量相等,分别加入过量的镁,产生氢气的体积相等,故B错误;HCOOH是弱酸,与NaOH发生反应:HCOOH+OH-===HCOO-+H2O,故C错误;=,将CH3COOH溶液稀释100倍过程中,保持不变,故D正确。]
11.C
12.(1)BOH??B++OH- (2)1×10-5
(3)< 1×10-4
13.(1)A (2)105
解析 (1)已知酸性:H2SO3>>HSO>,则根据强酸制弱酸可知,水杨酸()与亚硫酸钠溶液反应生成与NaHSO3,故选A。
(2)c(H2SO3)=c(HSO)时,Ka1(H2SO3)=c(H+)=10-pH=10-2,当c(SO)=c(HSO)时,Ka2(H2SO3)=c(H+)=10-pH=10-7,==105。
14.(1)
(2)Ka(CH3COOH)(3)①H3PO4>CH3COOH>H2CO3>H2S
②一级电离产生的氢离子对二级电离起抑制作用
③S2->CO>HCO>CH3COO-
题组一 电离平衡常数和电离度
1.下列关于电离常数的说法正确的是( )
A.Ka大的酸溶液中c(H+)一定比Ka小的酸溶液中的c(H+)大
B.CH3COOH的电离常数表达式为Ka=
C.向CH3COOH溶液中加入少量CH3COONa固体,电离常数减小
D.电离常数只与温度有关,与浓度无关
2.已知25 ℃下,CH3COOH溶液中各微粒的浓度存在以下关系:Ka==1.75×10-5。下列有关结论可能成立的是( )
A.25 ℃下,向该溶液中加入一定量的盐酸时,Ka=8×10-5
B.25 ℃下,向该溶液中加入一定量的氢氧化钠时,Ka=2×10-4
C.标准状况下,醋酸中Ka=1.75×10-5
D.升高到一定温度,Ka=7.2×10-5
3.下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离程度和浓度关系的是( )
4.相同温度下,三种酸的电离平衡常数如表所示,下列判断正确的是( )
酸 HX HY HZ
电离平衡常数Ka 9×10-7 9×10-6 1×10-2
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-===HY+Z-不能发生
C.由电离平衡常数可以判断:HZ属于强酸,HX和HY属于弱酸
D.相同温度下,1 mol·L-1 HX溶液的电离平衡常数等于0.1 mol·L-1 HX溶液的电离平衡常数
5.(2022·河北保定高二期末)常温下,对下列两组溶液的判断错误的是( )
组别 浓度 体积
① 0.1 mol·L-1醋酸 V1 L
② 0.01 mol·L-1醋酸 V2 L
A.醋酸的电离程度:①<②
B.溶液中各种离子浓度均有:①>②
C.醋酸的电离平衡常数:①=②
D.若V2=10V1,中和NaOH的能力:①=②
题组二 强酸和弱酸的比较
6.某温度下,等体积、c(H+)相同的盐酸和醋酸溶液分别加水稀释,溶液中的c(H+)随溶液体积变化的曲线如图所示。据图判断下列说法正确的是( )
A.曲线Ⅱ表示的是盐酸的变化曲线
B.b点溶液的导电能力比c点溶液的导电能力强
C.取等体积的a点、b点对应的溶液,消耗NaOH的量相同
D.b点酸的总浓度大于a点酸的总浓度
7.在体积都为1 L,c(H+)都为0.01 mol·L-1的盐酸和醋酸溶液中,投入0.65 g锌粒,则下列图示符合客观事实的是( )
8.对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施后,有关叙述正确的是( )
A.加适量的醋酸钠晶体后,两溶液的c(H+)均减小
B.使温度升高20 ℃后,两溶液的c(H+)均不变
C.加水稀释两倍后,两溶液的c(H+)均增大
D.加足量的锌充分反应后,两溶液产生的氢气一样多
9.(2022·鸡西高二月考)在溶液导电性实验装置里,相同温度下分别注入20 mL 6 mol·L-1醋酸和20 mL 6 mol·L-1氨水,灯光明暗程度相同,如果把这两种溶液混合后再实验,则下列说法正确的是( )
A.灯光变暗;CH3COOH的电离常数等于NH3·H2O
B.灯光变暗;CH3COOH的电离常数大于NH3·H2O
C.灯光变亮;CH3COOH的电离常数小于NH3·H2O
D.灯光变亮;CH3COOH的电离常数等于NH3·H2O
10.常温下,CH3COOH、HCOOH(甲酸)的电离平衡常数分别为1.75×10-5、1.8×10-4,以下关于0.1 mol·L-1 CH3COOH溶液、0.1 mol·L-1 HCOOH溶液的说法正确的是( )
A.c(H+):CH3COOH>HCOOH
B.等体积的两溶液中,分别加入过量的镁,产生氢气的体积:HCOOH>CH3COOH
C.HCOOH可能与NaOH发生反应:H++OH-===H2O
D.将CH3COOH溶液稀释100倍过程中,保持不变
11.高氯酸、硫酸、HCl和硝酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 HClO4 H2SO4 HCl HNO3
Ka 1.6×10-5 6.3×10-9 1.6×10-9 4.2×10-10
由表格中的数据判断下列说法不正确的是( )
A.在冰醋酸中这四种酸都没有全部电离
B.在冰醋酸中高氯酸是这四种酸中酸性最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO
D.水对这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱
12.(2022·聊城高二检测)已知25 ℃时,测得浓度为0.1 mol·L-1的碱BOH的溶液中,c(OH-)=1×10-3 mol·L-1。
(1)写出BOH的电离方程式:______________________________________________。
(2)BOH的电离平衡常数Kb=______________________________________________。
(3)某温度T ℃时,BOH的电离平衡常数为1×10-7,结合(2)的计算可知T________25。若该碱的起始浓度也为0.1 mol·L-1,则溶液中c(B+)=________mol·L-1。
13.(1)已知酸性:H2SO3>>HSO>,水杨酸()与Na2SO3溶液反应,生成物为________(填字母)。
A. B.SO2
C.NaHCO3 D.
(2)亚硫酸电离常数为Ka1、Ka2,改变0.1 mol·L-1亚硫酸溶液的pH,其平衡体系中含硫元素微粒物质的量分数δ与pH的关系如图,则=______。
14.(1)25 ℃时,a mol·L-1 CH3COOH溶液中c(H+)=10-b mol·L-1,用含a和b的代数式表示CH3COOH的电离常数Ka=____________。
(2)已知25 ℃时,Ka(CH3COOH)=1.75×10-5,Ka(HSCN)=0.13。在该温度下将20 mL 0.1 mol·
L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的曲线如图,反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是___________________________________________
_____________________________________________________________________________。
(3)下表是几种弱酸常温下的电离常数:
CH3COOH H2CO3 H2S H3PO4
Ka=1.75×10-5 Ka1=4.5×10-7 Ka2=4.7×10-11 Ka1=1.1×10-7 Ka2=1.3×10-13 Ka1=6.9×10-3 Ka2=6.2×10-8 Ka3=4.8×10-13
①CH3COOH、H2CO3、H2S、H3PO4四种酸的酸性由强到弱的顺序为________________
________________________________________________________________________。
②多元弱酸的二级电离程度远小于一级电离的主要原因是______________________(从电离平衡角度考虑)。
③同浓度的CH3COO-、HCO、CO、S2-结合H+的能力由强到弱的顺序为________
________________________________________________________________________。
第2课时 电离平衡常数 强酸与弱酸的比较
1.D 2.D 3.B
4.D [A项,酸的电离平衡常数越大,酸的电离程度越大,其酸性越强,根据表中数据可知,酸的电离平衡常数:HZ>HY>HX,则酸性强弱:HZ>HY>HX,错误;B项,根据强酸制弱酸可知HZ+Y-===HY+Z-能够发生,错误;C项,完全电离的为强酸、部分电离的为弱酸,这三种酸都部分电离,均为弱酸,错误;D项,电离平衡常数只与温度有关,温度不变,电离平衡常数不变,正确。]
5.B [醋酸浓度越小,电离程度越大,A项正确;将①加水稀释可得到②,醋酸加水稀释,c(CH3COO-)、c(H+)均减小,但c(OH-)增大,B项错误;温度不变,醋酸的电离平衡常数不变,C项正确;若V2=10V1,两种醋酸的物质的量相同,中和NaOH的能力相同,D项正确。]
6.B 7.C 8.A
9.D [相同温度下,20 mL 6 mol·L-1醋酸和20 mL 6 mol·L-1氨水装置中的灯光亮度相同,说明等浓度的二者溶液中离子浓度相等,即二者电离常数相等;醋酸和氨水两种溶液混合生成强电解质醋酸铵,自由移动的离子浓度变大,溶液的导电能力增强,灯光变亮。]
10.D [等浓度的甲酸和乙酸溶液,甲酸酸性强、电离程度大,所以溶液中的c(H+):CH3COOH<HCOOH,故A错误;等浓度等体积的甲酸和乙酸溶液中,甲酸和乙酸的物质的量相等,分别加入过量的镁,产生氢气的体积相等,故B错误;HCOOH是弱酸,与NaOH发生反应:HCOOH+OH-===HCOO-+H2O,故C错误;=,将CH3COOH溶液稀释100倍过程中,保持不变,故D正确。]
11.C
12.(1)BOH??B++OH- (2)1×10-5
(3)< 1×10-4
13.(1)A (2)105
解析 (1)已知酸性:H2SO3>>HSO>,则根据强酸制弱酸可知,水杨酸()与亚硫酸钠溶液反应生成与NaHSO3,故选A。
(2)c(H2SO3)=c(HSO)时,Ka1(H2SO3)=c(H+)=10-pH=10-2,当c(SO)=c(HSO)时,Ka2(H2SO3)=c(H+)=10-pH=10-7,==105。
14.(1)
(2)Ka(CH3COOH)
②一级电离产生的氢离子对二级电离起抑制作用
③S2->CO>HCO>CH3COO-
