1.1.2物质的转化 课件(共21张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 1.1.2物质的转化 课件(共21张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 764.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 00:00:00 | ||
图片预览





文档简介
(共21张PPT)
第一章 物质及其变化
第一节 物质的分类及转化
第2课时 物质的转化
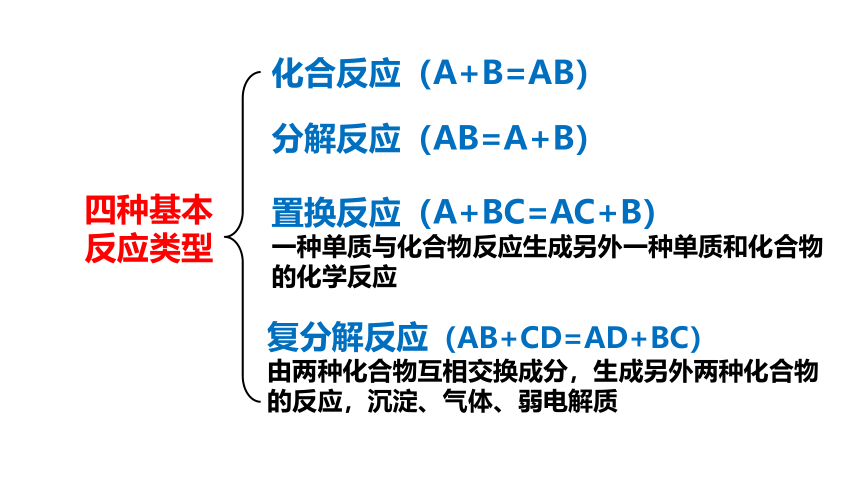
四种基本
反应类型
化合反应(A+B=AB)
分解反应(AB=A+B)
置换反应(A+BC=AC+B)
一种单质与化合物反应生成另外一种单质和化合物的化学反应
复分解反应(AB+CD=AD+BC)
由两种化合物互相交换成分,生成另外两种化合物的反应,沉淀、气体、弱电解质
置换反应:
金属+酸→盐+H2↑
(1)金属的活动性比氢强
(2)酸除浓硫酸、硝酸
(3)铁与酸反应生成亚铁盐(+2价)
金属+盐→新金属+新盐
(1)参于反应的盐应可溶
(2)金属的活动性“强”置换“弱”
(3)除K、Ca、Na外
(4)铁与盐反应生成亚铁盐(+2价)
四大基本反应的条件或规律
酸+盐→新盐+新酸(碳酸盐+酸→新盐+H2O+CO2↑)
弱酸不能与强酸盐反应;低沸点酸不能和高沸点酸盐反应
碱+盐→新碱+新盐
(1)反应物皆可溶
(2)生成物有沉淀
盐+盐→新盐+新盐
(1)反应物皆可溶
(2)生成物有沉淀
复分解反应:生成难电离的物质如:水、气体、沉淀等
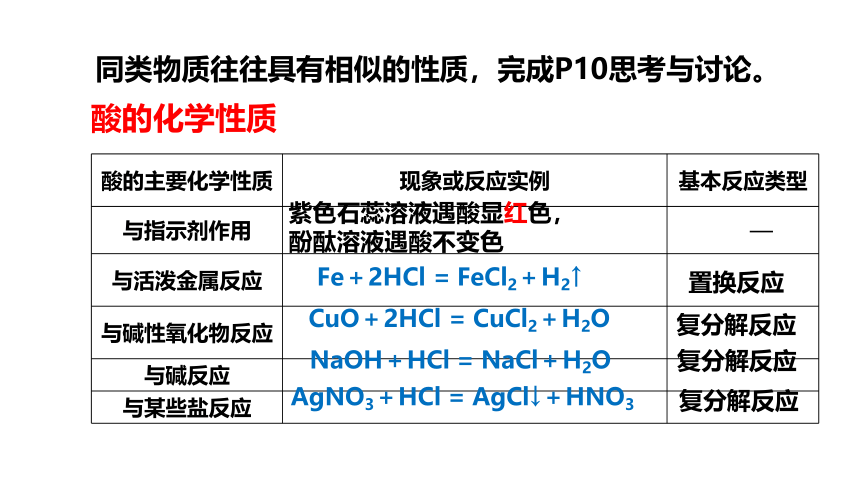
酸的主要化学性质 现象或反应实例 基本反应类型
与指示剂作用 —
与活泼金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
Fe+2HCl = FeCl2+H2↑
CuO+2HCl = CuCl2+H2O
NaOH+HCl = NaCl+H2O
AgNO3+HCl = AgCl↓+HNO3
紫色石蕊溶液遇酸显红色,
酚酞溶液遇酸不变色
置换反应
复分解反应
复分解反应
复分解反应
酸的化学性质
同类物质往往具有相似的性质,完成P10思考与讨论。
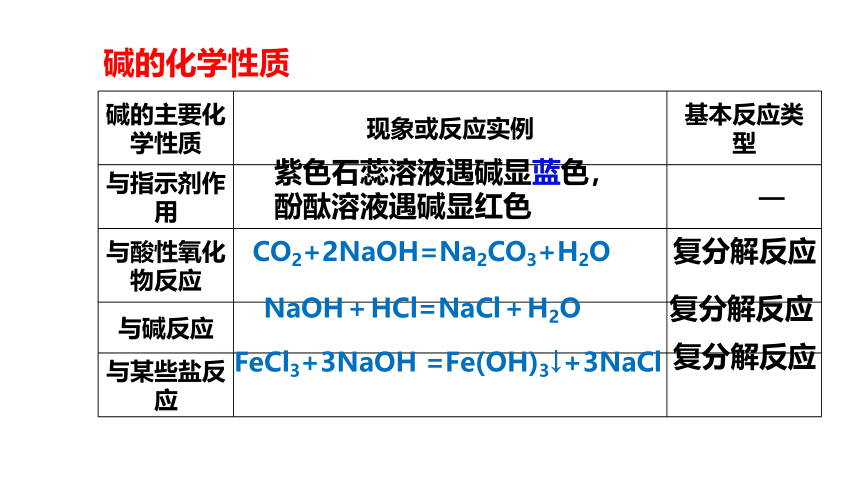
碱的主要化学性质 现象或反应实例 基本反应类型
与指示剂作用 —
与酸性氧化物反应
与碱反应
与某些盐反应
NaOH+HCl=NaCl+H2O
紫色石蕊溶液遇碱显蓝色,
酚酞溶液遇碱显红色
CO2+2NaOH=Na2CO3+H2O
FeCl3+3NaOH =Fe(OH)3↓+3NaCl
复分解反应
复分解反应
复分解反应
碱的化学性质
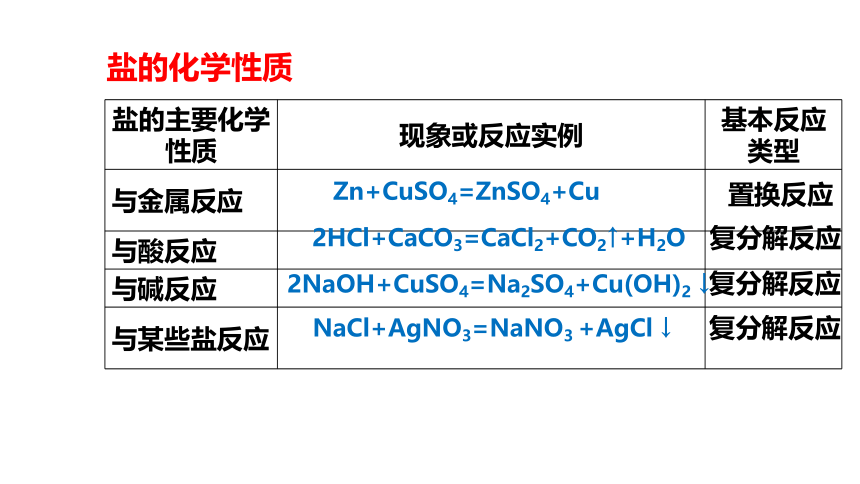
盐的主要化学性质 现象或反应实例 基本反应类型
与金属反应
与酸反应
与碱反应
与某些盐反应
Zn+CuSO4=ZnSO4+Cu
2HCl+CaCO3=CaCl2+CO2↑+H2O
2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
NaCl+AgNO3=NaNO3 +AgCl ↓
复分解反应
复分解反应
复分解反应
置换反应
盐的化学性质
金属的化学性质
(1)与非金属反应:2Mg+O2
3Fe+2O2
2Cu+O2
2CuO
2MgO
Fe3O4
(2)与酸反应:Fe+2HCl=FeCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
(3)与盐反应:Fe+CuSO4=FeSO4+Cu
Al+3CuSO4=Al2(SO4)3+3Cu
酸性氧化物的性质:
(1)能与水反应:H2O+CO2
H2CO3
(2)能与碱性氧化物反应:CaO+CO2=CaCO3
(3)能与碱反应:CO2+Ca(OH)2=CaCO3↓+H2O
(4)能与某些盐反应:CO2+CaCO3+H2O=Ca(HCO3)2
碱性氧化物的性质
(1)能与水反应:H2O+CaO=Ca(OH)2
(2)能与酸性氧化物反应:Na2O+CO2=Na2CO3
(3)能与酸反应:MgO+2HCl=MgCl2+H2O
(4)能与某些盐反应:
H2O+CaO+Na2CO3=CaCO3↓+2NaOH
物质的转化
碳及其化合物间的转化关系
写出图中序号所示转化所需反应物的化学式:
①_________ ②________ ③__________ ④________ ⑤___________。
O2
H2O
Ca(OH)2
CaO
Ca(OH)2
④____________________________________,_____________________;
⑤____________________________________,_____________________;
⑥__________________________________, _____________________ 。
①______________________, _________;
②_____________________ , _________;
③ ____________________ , _________;
2Ca+O2===2CaO
化合反应
CaO+H2O=Ca(OH )2
化合反应
CaO+CO2 = CaCO3
化合反应
钙及其化合物间的转化关系
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
复分解反应
Ca(OH)2+2HCl===CaCl2+2H2O
复分解反应
CaCO3+2HCl===CaCl2+CO2↑+H2O
复分解反应
能与水反应生成可溶性碱的常见金属氧化物只有4种:CaO、Na2O、K2O、BaO。
单质到盐的一般转化关系:
O2
H2O
酸或酸性氧化物
部分金属单质
碱性
氧化物
碱
盐
O2
H2O
碱或碱性氧化物
部分非金属单质
酸性
氧化物
酸
盐
金属单质Ca
碱性氧化物
非金属单质C
酸性氧化物
盐
碱
盐
酸
盐
盐和水
碱+盐
酸+盐
两种新盐
②
①
③
④
⑤
⑥
⑦
⑧
⑨
不同类物质之间的相互转化
物质分类角度构建物质转化规律的模型认知
设计以Na为原料制备Na2SO3的转化路径。
物质转化规律的模型应用——制备Na2SO3
物质转化规律的模型应用——制备NaOH
1、要制取氢氧化钠可以采用哪些方法?
(1)碱性氧化物与水反应
Na2O + H2O = 2NaOH
(2)用盐与另一种碱反应
Na2CO3 + Ca(OH)2 ═ CaCO3 + 2NaOH
2NaCl + 2H2O == 2NaOH + H2↑ + Cl2↑
通电
2、工业上如何制取氢氧化钠?
1.秒判正误,正确的打“√”,错误的打“×”
(1)Cu可与AgNO3溶液发生置换反应( )
(2)由H2SO4可以与BaCl2反应,可类推HCl也可以与BaCl2反应( )
(3)利用稀硫酸或盐酸与块状石灰石反应,都常用于制取CO2( )
(4)Na2CO3溶液遇酚酞变红,所以Na2CO3是碱( )
×
√
×
×
1. A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )
A.铜 B.碳 C.铁 D.钙
D
D
1. 实现下列物质的转化时,只有加入酸才能通过一步反应实现的是( )
A.Fe2O3―→Fe2(SO4)3 B.Zn―→ZnCl2
C.NaOH―→NaCl D. BaCl2―→BaSO4
A
大家认为方案二优于方案一,理由是①节约能源;②Cu产率高;③产品纯净;④操作安全。其中评价正确的是( )
A.①②③ B.①②④ C.①③④ D.②③
2. 一同学设计了两种由CuO―→Cu的实验方案:
B
第一章 物质及其变化
第一节 物质的分类及转化
第2课时 物质的转化
四种基本
反应类型
化合反应(A+B=AB)
分解反应(AB=A+B)
置换反应(A+BC=AC+B)
一种单质与化合物反应生成另外一种单质和化合物的化学反应
复分解反应(AB+CD=AD+BC)
由两种化合物互相交换成分,生成另外两种化合物的反应,沉淀、气体、弱电解质
置换反应:
金属+酸→盐+H2↑
(1)金属的活动性比氢强
(2)酸除浓硫酸、硝酸
(3)铁与酸反应生成亚铁盐(+2价)
金属+盐→新金属+新盐
(1)参于反应的盐应可溶
(2)金属的活动性“强”置换“弱”
(3)除K、Ca、Na外
(4)铁与盐反应生成亚铁盐(+2价)
四大基本反应的条件或规律
酸+盐→新盐+新酸(碳酸盐+酸→新盐+H2O+CO2↑)
弱酸不能与强酸盐反应;低沸点酸不能和高沸点酸盐反应
碱+盐→新碱+新盐
(1)反应物皆可溶
(2)生成物有沉淀
盐+盐→新盐+新盐
(1)反应物皆可溶
(2)生成物有沉淀
复分解反应:生成难电离的物质如:水、气体、沉淀等
酸的主要化学性质 现象或反应实例 基本反应类型
与指示剂作用 —
与活泼金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
Fe+2HCl = FeCl2+H2↑
CuO+2HCl = CuCl2+H2O
NaOH+HCl = NaCl+H2O
AgNO3+HCl = AgCl↓+HNO3
紫色石蕊溶液遇酸显红色,
酚酞溶液遇酸不变色
置换反应
复分解反应
复分解反应
复分解反应
酸的化学性质
同类物质往往具有相似的性质,完成P10思考与讨论。
碱的主要化学性质 现象或反应实例 基本反应类型
与指示剂作用 —
与酸性氧化物反应
与碱反应
与某些盐反应
NaOH+HCl=NaCl+H2O
紫色石蕊溶液遇碱显蓝色,
酚酞溶液遇碱显红色
CO2+2NaOH=Na2CO3+H2O
FeCl3+3NaOH =Fe(OH)3↓+3NaCl
复分解反应
复分解反应
复分解反应
碱的化学性质
盐的主要化学性质 现象或反应实例 基本反应类型
与金属反应
与酸反应
与碱反应
与某些盐反应
Zn+CuSO4=ZnSO4+Cu
2HCl+CaCO3=CaCl2+CO2↑+H2O
2NaOH+CuSO4=Na2SO4+Cu(OH)2 ↓
NaCl+AgNO3=NaNO3 +AgCl ↓
复分解反应
复分解反应
复分解反应
置换反应
盐的化学性质
金属的化学性质
(1)与非金属反应:2Mg+O2
3Fe+2O2
2Cu+O2
2CuO
2MgO
Fe3O4
(2)与酸反应:Fe+2HCl=FeCl2+H2↑
2Al+6HCl=2AlCl3+3H2↑
(3)与盐反应:Fe+CuSO4=FeSO4+Cu
Al+3CuSO4=Al2(SO4)3+3Cu
酸性氧化物的性质:
(1)能与水反应:H2O+CO2
H2CO3
(2)能与碱性氧化物反应:CaO+CO2=CaCO3
(3)能与碱反应:CO2+Ca(OH)2=CaCO3↓+H2O
(4)能与某些盐反应:CO2+CaCO3+H2O=Ca(HCO3)2
碱性氧化物的性质
(1)能与水反应:H2O+CaO=Ca(OH)2
(2)能与酸性氧化物反应:Na2O+CO2=Na2CO3
(3)能与酸反应:MgO+2HCl=MgCl2+H2O
(4)能与某些盐反应:
H2O+CaO+Na2CO3=CaCO3↓+2NaOH
物质的转化
碳及其化合物间的转化关系
写出图中序号所示转化所需反应物的化学式:
①_________ ②________ ③__________ ④________ ⑤___________。
O2
H2O
Ca(OH)2
CaO
Ca(OH)2
④____________________________________,_____________________;
⑤____________________________________,_____________________;
⑥__________________________________, _____________________ 。
①______________________, _________;
②_____________________ , _________;
③ ____________________ , _________;
2Ca+O2===2CaO
化合反应
CaO+H2O=Ca(OH )2
化合反应
CaO+CO2 = CaCO3
化合反应
钙及其化合物间的转化关系
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
复分解反应
Ca(OH)2+2HCl===CaCl2+2H2O
复分解反应
CaCO3+2HCl===CaCl2+CO2↑+H2O
复分解反应
能与水反应生成可溶性碱的常见金属氧化物只有4种:CaO、Na2O、K2O、BaO。
单质到盐的一般转化关系:
O2
H2O
酸或酸性氧化物
部分金属单质
碱性
氧化物
碱
盐
O2
H2O
碱或碱性氧化物
部分非金属单质
酸性
氧化物
酸
盐
金属单质Ca
碱性氧化物
非金属单质C
酸性氧化物
盐
碱
盐
酸
盐
盐和水
碱+盐
酸+盐
两种新盐
②
①
③
④
⑤
⑥
⑦
⑧
⑨
不同类物质之间的相互转化
物质分类角度构建物质转化规律的模型认知
设计以Na为原料制备Na2SO3的转化路径。
物质转化规律的模型应用——制备Na2SO3
物质转化规律的模型应用——制备NaOH
1、要制取氢氧化钠可以采用哪些方法?
(1)碱性氧化物与水反应
Na2O + H2O = 2NaOH
(2)用盐与另一种碱反应
Na2CO3 + Ca(OH)2 ═ CaCO3 + 2NaOH
2NaCl + 2H2O == 2NaOH + H2↑ + Cl2↑
通电
2、工业上如何制取氢氧化钠?
1.秒判正误,正确的打“√”,错误的打“×”
(1)Cu可与AgNO3溶液发生置换反应( )
(2)由H2SO4可以与BaCl2反应,可类推HCl也可以与BaCl2反应( )
(3)利用稀硫酸或盐酸与块状石灰石反应,都常用于制取CO2( )
(4)Na2CO3溶液遇酚酞变红,所以Na2CO3是碱( )
×
√
×
×
1. A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是( )
A.铜 B.碳 C.铁 D.钙
D
D
1. 实现下列物质的转化时,只有加入酸才能通过一步反应实现的是( )
A.Fe2O3―→Fe2(SO4)3 B.Zn―→ZnCl2
C.NaOH―→NaCl D. BaCl2―→BaSO4
A
大家认为方案二优于方案一,理由是①节约能源;②Cu产率高;③产品纯净;④操作安全。其中评价正确的是( )
A.①②③ B.①②④ C.①③④ D.②③
2. 一同学设计了两种由CuO―→Cu的实验方案:
B
