3.1.2电离平衡常数 课件(共28张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1.2电离平衡常数 课件(共28张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 08:24:03 | ||
图片预览







文档简介
(共28张PPT)
请你解释!
通过上节课的学习解释下列原因
盐酸主要用于卫生清洁,如洁厕剂的主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)?
去污原理
CaCO3+2H+ CO2↑+H2O+Ca2+
CaCO3 +2CH3COOH→(CH3COO)2Ca +CO2↑+H2O
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度
第一节
电离平衡
第三章 水溶液中的离子反应与平衡
赵健
第2课时 弱电解质的电离平衡 电离平衡常数
meiyangyang8602
meiyangyang8602
01
强电解质和弱电解质的比较
赵健
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
思考与讨论:
向两个锥形瓶中各加入0.05 g镁条,塞紧橡胶塞,然后用注射器分别注入2 mL2mol/L盐酸、2 mL2 mol/L醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。
请回答下列问题:
(1)两个反应的反应速率及其变化有什么特点?
(2)反应结束时,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论?
课本P59页
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
Mg条与盐酸、醋酸反应的化学方程式分别为
反应本质为Mg失去电子,H+得到电子生成H2
c(H+)为影响反应速率的主要因素
问题分析
Mg +2HCl
MgCl2+H2↑
Mg + 2CH3COOH
(CH3COO)2Mg + H2↑
2 mol/L 的盐酸和醋酸,初始阶段的c(H+)
2 mol/L
HCl H+ + Cl
CH3COOH CH3COO + H+
小于 2 mol/L
2 mol/L
2 mol/L
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
与Mg条反应,初始阶段的反应速率
盐酸 > 醋酸
随着反应的进行
HCl H+ + Cl
CH3COOH CH3COO + H+
+
+
Mg
Mg
c(H+)下降更为明显
c(H+)下降,电离平衡正向移动
c(H+)下降幅度不如盐酸中明显
与Mg条化学反应速率的变化,盐酸的减小非常明显,醋酸的相对变化幅度小
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
2 mL 2 mol/L 的盐酸和2 mL 2 mol/L醋酸可电离的n(H+)
Mg +2HCl
MgCl2+H2↑
Mg + 2CH3COOH
(CH3COO)2Mg + H2↑
2 mL 2 mol/L
2 mL 2 mol/L
0.004 mol
0.004 mol
0.002 mol
0.002 mol
相同条件下,两锥形瓶压强基本相等
meiyangyang8602
盐酸、醋酸的对比
盐酸导电能力的变化
冰醋酸和盐酸加水稀释过程离子浓度变化
醋酸导电能力的变化
冰醋酸稀释
开始加水时,电离平衡向右移动,离子数目增多,离子浓度增大,导电能力增强;离子浓度增大到最大后再加水稀释电离平衡向右移动,离子数目增多,电离程度增大,但离子浓度减小,导电能力减弱。
离子浓度减小,导电能力减弱
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
讨论完成表格
1mol/L HCl A 1mol/LCH3COOH B
C(H+) 与Zn反应快慢 与足量Zn产生H2量 中和能力 同倍数稀释C(H+) 与等量不足的金属反应所需时间 A>B
A>B
A=B
A=B
为原来的1/n
大于原来的1/n
A﹤B
等体积,等浓度的盐酸和醋酸
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
讨论完成表格
溶液的浓度
开始时反应速率
反应过程中平均反应速率
生成等量氢气所需的时间
反应过程中速率下降快慢
生成等量的氢气消耗Zn
与足量的Zn反应产生H2量
AA=B
AA>B
A>B
A=B
A体积、PH(C(H+))相同的盐酸(A)与醋酸(B)分别与锌反应
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
pH
时间/s
0
50
100
150
1
2
3
4
盐酸和醋酸稀释过程中溶液的pH随时间的变化示意图
同时将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,稀释过程中溶液的pH随时间的变化
a
b
【思考与讨论】
1、哪条曲线代表盐酸(或醋酸)稀释过程中溶液的pH变化?你的理由是什么?
2、分别将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,二者的pH各变化了多少?为什么?
meiyangyang8602
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
同时将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,酸的浓度和氢离子浓度分别为多少?
0.1 mol/L
0.1 mol/L
HCl H+ + Cl
CH3COOH CH3COO + H+
0.01 mol/L
稀释到原浓度的1/10
0.01 mol/L
0.01 mol/L
?
0.1 mol/L
?
HCl完全电离
酸的浓度与氢离子浓度相等
CH3COOH部分电离
酸的浓度与氢离子浓度不相等
如何定量表示弱电解质电离程度的大小
赵健
02
电离平衡常数
meiyangyang8602
meiyangyang8602
meiyangyang8602
请你联想!
根据化学平衡常数表达式类推电离平衡常数表达式
写出醋酸的电离方程式,并写出该电离方程式的平衡常数表达式
CH3COOH CH3COO + H+
弱酸的电离常数 Ka
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数。
弱酸、弱碱的电离常数通常分别用Ka、 Kb表示
meiyangyang8602
meiyangyang8602
电离平衡常数
表示方法
AB A++B-
K=
c(B-)
·c(A+)
c(AB)
CH3COOH CH3COO- + H+
NH3·H2O NH4++ OH-
meiyangyang8602
练习
meiyangyang8602
电离平衡常数
在某温度时,溶质的物质的量浓度为 0.2 mol·L 1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算该温度下NH3·H2O的电离常数(Kb)。
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.2
0
0
NH3·H2O NH4++ OH-
1.7×10 3
1.7×10 3
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
c(NH3·H2O)=(0.2 1.7×10 3) mol·L 1 ≈ 0.2 mol·L 1
=
(1.7×10 3)·(1.7×10 3)
0.2
c(NH3·H2O)
Kb=
c(NH4+ )·c(OH )
≈
1.4×10 5
meiyangyang8602
练习
meiyangyang8602
电离平衡常数
1,0.1 mol·L-1 CH3COOH溶液中,存在电离平衡
CH3COOH CH3COO-。经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka= 。
1.96×10-5
meiyangyang8602
meiyangyang8602
电离平衡常数
多元弱酸、多元弱碱的电离常数
多元弱酸的电离分步进行,各步的电离常数通常分别用Ka1、Ka2、Ka3等
Ka1=
c(H+)×c(HCO3-)
c(H2CO3)
H2CO3 H++HCO3-
HCO3- H++CO32-
Ka2=
c(H+)×c(CO32-)
c(HCO3-)
=4.5×10-7
=4.7×10-11
一般多元弱酸各步电离常数的大小为Ka1》Ka2 》Ka3等,因此,多元弱酸的酸性主要由第一步电离决定。
多元弱碱的情况与多元弱酸类似
以上数值是25 ℃时测定,不同温度电离常数是否相同?
03
电离平衡常数的影响因素
赵健
meiyangyang8602
meiyangyang8602
请你类推!
根据化学平衡常数的影响因素类推电离平衡常数的影响因素
类比化学平衡常数,对于给定的化学反应,化学平衡常数大小通常与温度相关
电离平衡常数的影响因素
外因---温度
pH计测定不同温度下0.05 mol/L 醋酸的pH
温度 20 ℃ 24 ℃
pH 3.05 3.03
升高温度电离平衡正向移动
随着温度的升高而增大
CH3COOH CH3COO- + H+
meiyangyang8602
电离平衡常数的影响因素
内因(决定因素)
弱电解质本身的性质
25 ℃时CH3COOH、HCN的电离常数
CH3COOH HCN
Ka 1.75×10 5 6.2×10 10
CH3COOH > HCN
酸性
meiyangyang8602
电离平衡常数的影响因素
内因(决定因素)
课本P121页
一定温度下,弱电解质的K值越大,电离程度越大,酸性(或碱性)越强。
04
电离平衡常数的应用
赵健
meiyangyang8602
meiyangyang8602
meiyangyang8602
电离平衡常数的应用
相同温度下,直接比较弱电解质的相对强弱
实验:
如图所示,向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L Na2CO3溶液。观察现象。你能否由此推测CH3COOH的Ka和H2CO3的Ka1的大小?
课本P59页
实验操作 向盛有2 mL 1mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液
实验现象
原理
结论
反应生成了CO2,化学方程式为
2CH3COOH + Na2CO3=2CH3COONa + H2O +CO2↑
CH3COOH的酸性比H2CO3的强,Ka(CH3COOH)>Kal(H2CO3)
有气泡产生
meiyangyang8602
meiyangyang8602
电离平衡的影响因素
练习
B
meiyangyang8602
meiyangyang8602
电离平衡的相关计算
电离程度
C(已电离)
C(初始)
α % =
×100 %
C(已电离)
C(初始)
α % =
×100 %
=
C初/mol·L-1 m 0 0
C/mol·L-1 x x x
C平/mol·L-1 m-x x x
m
×100 %
x
meiyangyang8602
电离平衡的相关计算
利用电离平衡常数计算
已知25 ℃,NH3·H2O的Kb=1.8×10–5。若氨水的浓度为 2.0 mol·L–1。求溶液中的氢氧根离子浓度c(OH–)。
6.0×10–3
=
2 - x
x x
C初/mol·L-1 2.0 0 0
C/mol·L-1 x x x
C平/mol·L-1 2-x x x
NH3·H2O NH4+ + OH-
=
1.8×10–5
请你解释!
通过上节课的学习解释下列原因
盐酸主要用于卫生清洁,如洁厕剂的主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)?
去污原理
CaCO3+2H+ CO2↑+H2O+Ca2+
CaCO3 +2CH3COOH→(CH3COO)2Ca +CO2↑+H2O
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度
第一节
电离平衡
第三章 水溶液中的离子反应与平衡
赵健
第2课时 弱电解质的电离平衡 电离平衡常数
meiyangyang8602
meiyangyang8602
01
强电解质和弱电解质的比较
赵健
meiyangyang8602
meiyangyang8602
meiyangyang8602
meiyangyang8602
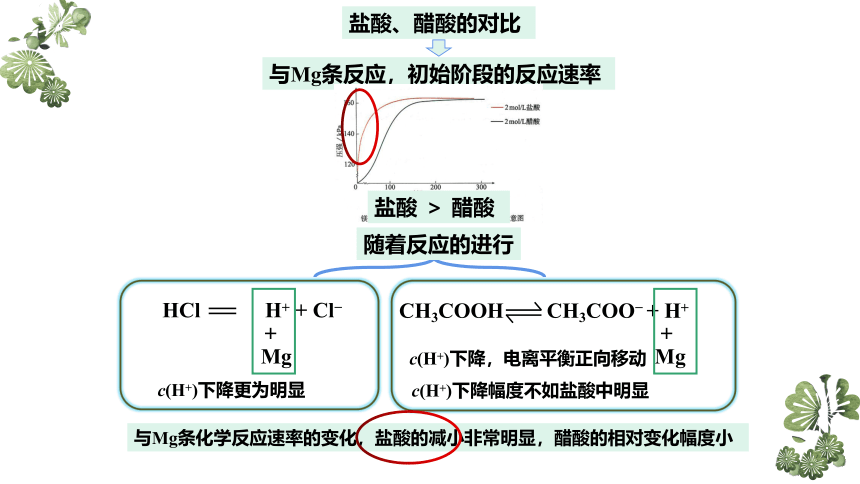
盐酸、醋酸的对比
思考与讨论:
向两个锥形瓶中各加入0.05 g镁条,塞紧橡胶塞,然后用注射器分别注入2 mL2mol/L盐酸、2 mL2 mol/L醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。
请回答下列问题:
(1)两个反应的反应速率及其变化有什么特点?
(2)反应结束时,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论?
课本P59页
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
Mg条与盐酸、醋酸反应的化学方程式分别为
反应本质为Mg失去电子,H+得到电子生成H2
c(H+)为影响反应速率的主要因素
问题分析
Mg +2HCl
MgCl2+H2↑
Mg + 2CH3COOH
(CH3COO)2Mg + H2↑
2 mol/L 的盐酸和醋酸,初始阶段的c(H+)
2 mol/L
HCl H+ + Cl
CH3COOH CH3COO + H+
小于 2 mol/L
2 mol/L
2 mol/L
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
与Mg条反应,初始阶段的反应速率
盐酸 > 醋酸
随着反应的进行
HCl H+ + Cl
CH3COOH CH3COO + H+
+
+
Mg
Mg
c(H+)下降更为明显
c(H+)下降,电离平衡正向移动
c(H+)下降幅度不如盐酸中明显
与Mg条化学反应速率的变化,盐酸的减小非常明显,醋酸的相对变化幅度小
meiyangyang8602
meiyangyang8602
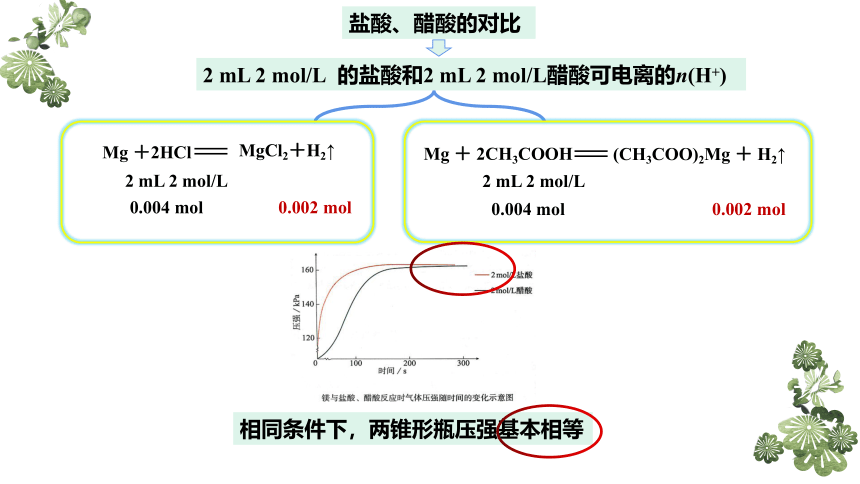
盐酸、醋酸的对比
2 mL 2 mol/L 的盐酸和2 mL 2 mol/L醋酸可电离的n(H+)
Mg +2HCl
MgCl2+H2↑
Mg + 2CH3COOH
(CH3COO)2Mg + H2↑
2 mL 2 mol/L
2 mL 2 mol/L
0.004 mol
0.004 mol
0.002 mol
0.002 mol
相同条件下,两锥形瓶压强基本相等
meiyangyang8602
盐酸、醋酸的对比
盐酸导电能力的变化
冰醋酸和盐酸加水稀释过程离子浓度变化
醋酸导电能力的变化
冰醋酸稀释
开始加水时,电离平衡向右移动,离子数目增多,离子浓度增大,导电能力增强;离子浓度增大到最大后再加水稀释电离平衡向右移动,离子数目增多,电离程度增大,但离子浓度减小,导电能力减弱。
离子浓度减小,导电能力减弱
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
讨论完成表格
1mol/L HCl A 1mol/LCH3COOH B
C(H+) 与Zn反应快慢 与足量Zn产生H2量 中和能力 同倍数稀释C(H+) 与等量不足的金属反应所需时间 A>B
A>B
A=B
A=B
为原来的1/n
大于原来的1/n
A﹤B
等体积,等浓度的盐酸和醋酸
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
讨论完成表格
溶液的浓度
开始时反应速率
反应过程中平均反应速率
生成等量氢气所需的时间
反应过程中速率下降快慢
生成等量的氢气消耗Zn
与足量的Zn反应产生H2量
A
A
A>B
A=B
A
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
pH
时间/s
0
50
100
150
1
2
3
4
盐酸和醋酸稀释过程中溶液的pH随时间的变化示意图
同时将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,稀释过程中溶液的pH随时间的变化
a
b
【思考与讨论】
1、哪条曲线代表盐酸(或醋酸)稀释过程中溶液的pH变化?你的理由是什么?
2、分别将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,二者的pH各变化了多少?为什么?
meiyangyang8602
meiyangyang8602
meiyangyang8602
盐酸、醋酸的对比
同时将0.1mol/L盐酸和醋酸中溶质的浓度稀释到原浓度的1/10,酸的浓度和氢离子浓度分别为多少?
0.1 mol/L
0.1 mol/L
HCl H+ + Cl
CH3COOH CH3COO + H+
0.01 mol/L
稀释到原浓度的1/10
0.01 mol/L
0.01 mol/L
?
0.1 mol/L
?
HCl完全电离
酸的浓度与氢离子浓度相等
CH3COOH部分电离
酸的浓度与氢离子浓度不相等
如何定量表示弱电解质电离程度的大小
赵健
02
电离平衡常数
meiyangyang8602
meiyangyang8602
meiyangyang8602
请你联想!
根据化学平衡常数表达式类推电离平衡常数表达式
写出醋酸的电离方程式,并写出该电离方程式的平衡常数表达式
CH3COOH CH3COO + H+
弱酸的电离常数 Ka
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数。
弱酸、弱碱的电离常数通常分别用Ka、 Kb表示
meiyangyang8602
meiyangyang8602
电离平衡常数
表示方法
AB A++B-
K=
c(B-)
·c(A+)
c(AB)
CH3COOH CH3COO- + H+
NH3·H2O NH4++ OH-
meiyangyang8602
练习
meiyangyang8602
电离平衡常数
在某温度时,溶质的物质的量浓度为 0.2 mol·L 1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算该温度下NH3·H2O的电离常数(Kb)。
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.2
0
0
NH3·H2O NH4++ OH-
1.7×10 3
1.7×10 3
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
c(NH3·H2O)=(0.2 1.7×10 3) mol·L 1 ≈ 0.2 mol·L 1
=
(1.7×10 3)·(1.7×10 3)
0.2
c(NH3·H2O)
Kb=
c(NH4+ )·c(OH )
≈
1.4×10 5
meiyangyang8602
练习
meiyangyang8602
电离平衡常数
1,0.1 mol·L-1 CH3COOH溶液中,存在电离平衡
CH3COOH CH3COO-。经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka= 。
1.96×10-5
meiyangyang8602
meiyangyang8602
电离平衡常数
多元弱酸、多元弱碱的电离常数
多元弱酸的电离分步进行,各步的电离常数通常分别用Ka1、Ka2、Ka3等
Ka1=
c(H+)×c(HCO3-)
c(H2CO3)
H2CO3 H++HCO3-
HCO3- H++CO32-
Ka2=
c(H+)×c(CO32-)
c(HCO3-)
=4.5×10-7
=4.7×10-11
一般多元弱酸各步电离常数的大小为Ka1》Ka2 》Ka3等,因此,多元弱酸的酸性主要由第一步电离决定。
多元弱碱的情况与多元弱酸类似
以上数值是25 ℃时测定,不同温度电离常数是否相同?
03
电离平衡常数的影响因素
赵健
meiyangyang8602
meiyangyang8602
请你类推!
根据化学平衡常数的影响因素类推电离平衡常数的影响因素
类比化学平衡常数,对于给定的化学反应,化学平衡常数大小通常与温度相关
电离平衡常数的影响因素
外因---温度
pH计测定不同温度下0.05 mol/L 醋酸的pH
温度 20 ℃ 24 ℃
pH 3.05 3.03
升高温度电离平衡正向移动
随着温度的升高而增大
CH3COOH CH3COO- + H+
meiyangyang8602
电离平衡常数的影响因素
内因(决定因素)
弱电解质本身的性质
25 ℃时CH3COOH、HCN的电离常数
CH3COOH HCN
Ka 1.75×10 5 6.2×10 10
CH3COOH > HCN
酸性
meiyangyang8602
电离平衡常数的影响因素
内因(决定因素)
课本P121页
一定温度下,弱电解质的K值越大,电离程度越大,酸性(或碱性)越强。
04
电离平衡常数的应用
赵健
meiyangyang8602
meiyangyang8602
meiyangyang8602
电离平衡常数的应用
相同温度下,直接比较弱电解质的相对强弱
实验:
如图所示,向盛有2 mL 1 mol/L醋酸的试管中滴加1 mol/L Na2CO3溶液。观察现象。你能否由此推测CH3COOH的Ka和H2CO3的Ka1的大小?
课本P59页
实验操作 向盛有2 mL 1mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液
实验现象
原理
结论
反应生成了CO2,化学方程式为
2CH3COOH + Na2CO3=2CH3COONa + H2O +CO2↑
CH3COOH的酸性比H2CO3的强,Ka(CH3COOH)>Kal(H2CO3)
有气泡产生
meiyangyang8602
meiyangyang8602
电离平衡的影响因素
练习
B
meiyangyang8602
meiyangyang8602
电离平衡的相关计算
电离程度
C(已电离)
C(初始)
α % =
×100 %
C(已电离)
C(初始)
α % =
×100 %
=
C初/mol·L-1 m 0 0
C/mol·L-1 x x x
C平/mol·L-1 m-x x x
m
×100 %
x
meiyangyang8602
电离平衡的相关计算
利用电离平衡常数计算
已知25 ℃,NH3·H2O的Kb=1.8×10–5。若氨水的浓度为 2.0 mol·L–1。求溶液中的氢氧根离子浓度c(OH–)。
6.0×10–3
=
2 - x
x x
C初/mol·L-1 2.0 0 0
C/mol·L-1 x x x
C平/mol·L-1 2-x x x
NH3·H2O NH4+ + OH-
=
1.8×10–5
