2.2.2 炔烃的结构与性质 课件(共18张PPT)人教版(2019)选择性必修第三册
文档属性
| 名称 | 2.2.2 炔烃的结构与性质 课件(共18张PPT)人教版(2019)选择性必修第三册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 00:00:00 | ||
图片预览


文档简介
(共18张PPT)
选择性必修3
第二章 烃
第二节 炔烃
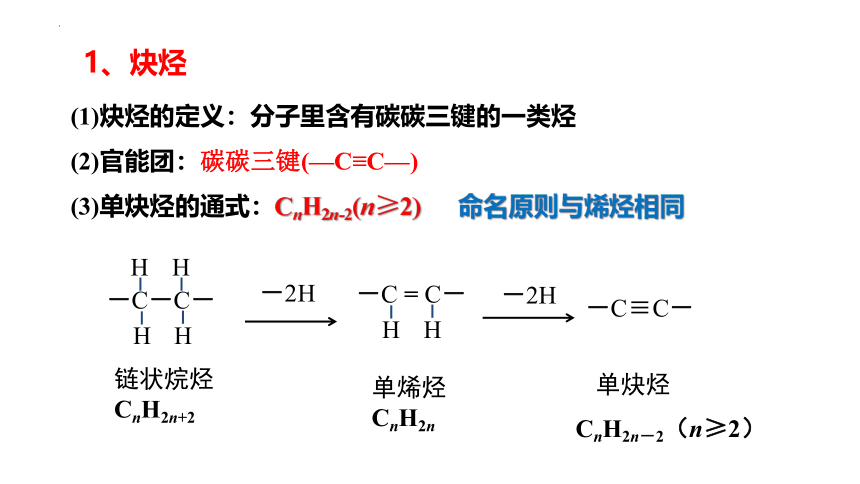
(1)炔烃的定义:分子里含有碳碳三键的一类烃
(2)官能团:碳碳三键(—C≡C—)
(3)单炔烃的通式:CnH2n-2(n≥2) 命名原则与烯烃相同
-C-C-
H
H
H
H
链状烷烃
CnH2n+2
-2H
-C = C-
H
H
单烯烃
CnH2n
-2H
-C≡C-
单炔烃
CnH2n-2(n≥2)
1、炔烃
2、乙炔的物理性质
俗称电石气,无色、无臭的气体,微溶于水,易溶于有机溶剂。
炔烃物理性质的递变规律与烷烃、烯烃的相似:
(1) 常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态。
(2) 随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低。
(3) 随着碳原子数的增多,相对密度逐渐增大。
(4) 密度均比水小,均难溶于水。
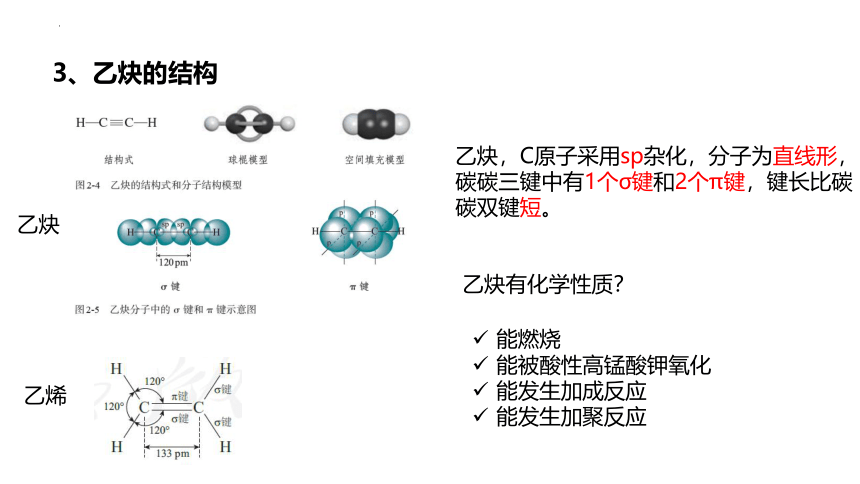
3、乙炔的结构
乙炔
乙烯
乙炔,C原子采用sp杂化,分子为直线形,碳碳三键中有1个σ键和2个π键,键长比碳碳双键短。
乙炔有化学性质?
能燃烧
能被酸性高锰酸钾氧化
能发生加成反应
能发生加聚反应
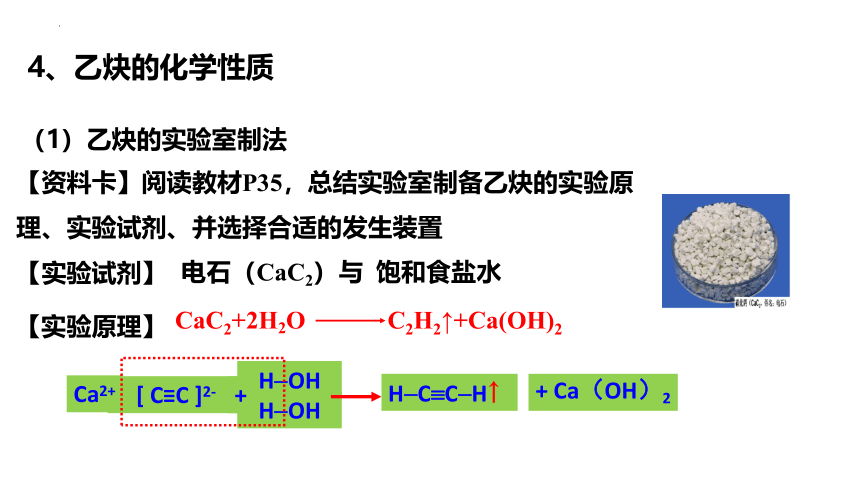
【资料卡】阅读教材P35,总结实验室制备乙炔的实验原理、实验试剂、并选择合适的发生装置
【实验原理】
【实验试剂】
CaC2+2H2O C2H2↑+Ca(OH)2
电石(CaC2)与 饱和食盐水
4、乙炔的化学性质
(1)乙炔的实验室制法
H OH
H OH
[ C≡C ]2-
Ca2+
+
H C C H↑
+ Ca(OH)2
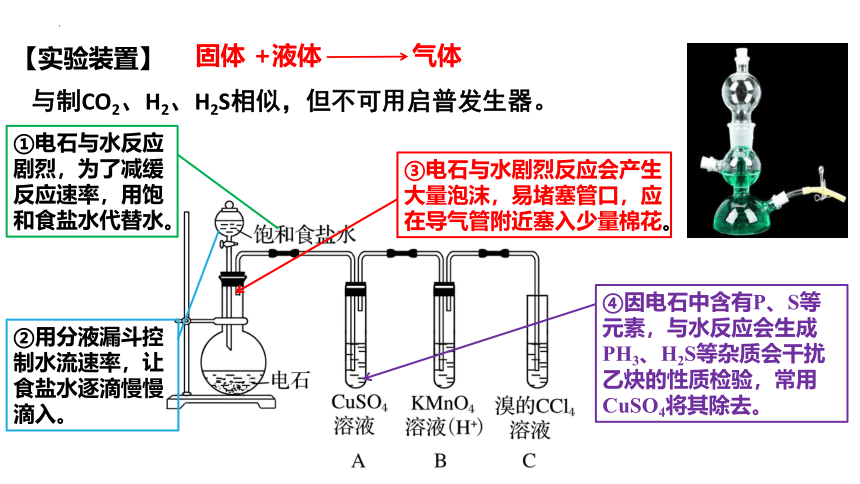
②用分液漏斗控制水流速率,让食盐水逐滴慢慢滴入。
④因电石中含有P、S等元素,与水反应会生成PH3、H2S等杂质会干扰乙炔的性质检验,常用CuSO4将其除去。
③电石与水剧烈反应会产生大量泡沫,易堵塞管口,应在导气管附近塞入少量棉花。
①电石与水反应剧烈,为了减缓反应速率,用饱和食盐水代替水。
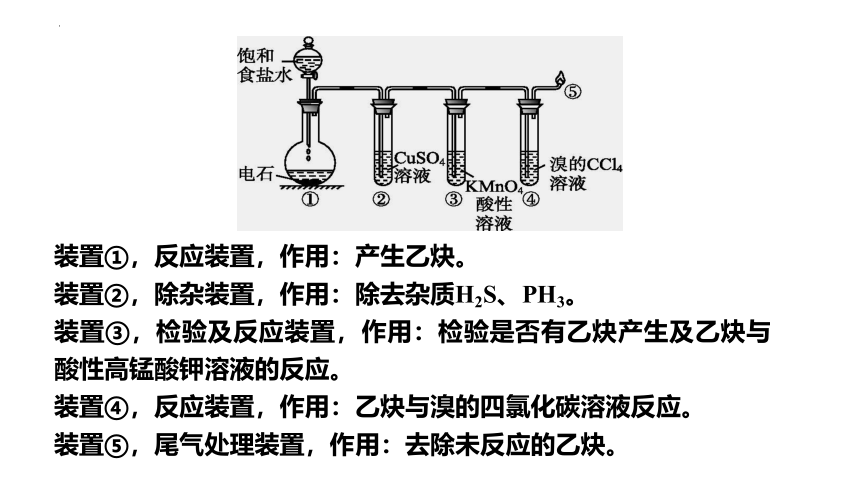
【实验装置】
固体 +液体 气体
与制CO2、H2、H2S相似,但不可用启普发生器。
装置①,反应装置,作用:产生乙炔。
装置②,除杂装置,作用:除去杂质H2S、PH3。
装置③,检验及反应装置,作用:检验是否有乙炔产生及乙炔与酸性高锰酸钾溶液的反应。
装置④,反应装置,作用:乙炔与溴的四氯化碳溶液反应。
装置⑤,尾气处理装置,作用:去除未反应的乙炔。
实验记录
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
产生明亮的火焰,有黑烟
甲烷
乙烯
乙炔
①可燃性
O2
4CO2+2H2O
2C2H2+ 5
火焰明亮,并伴有浓烟
注意:点燃前要验纯!
①乙炔的氧化反应
(2)乙炔的化学性质
根据乙炔通入酸性高锰酸钾溶液时的实验现象,说明乙炔具有怎样的化学性质
乙炔易被氧化
溶液紫色逐渐褪去
图片来自网络
图片来自网络
可使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
可用于鉴别炔烃和烷烃,但不能除杂!!
乙炔能发生加成反应
总反应:CH≡CH + 2Br2 → CHBr2CHBr2
1,2-二溴乙烯
1,1,2,2-四溴乙烷
溴的颜色逐渐褪去,生成无色易溶于四氯化碳的物质。
②加成反应(与反应物的量有关,可分步表示)
②加成反应(与反应物的量有关,可分步表示)
催化加氢
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
△
CH≡CH+H2O CH3CHO
与HX等的反应
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
CH2=CH-OH
(乙烯醇)
与H2O的反应
很不稳定
催化剂
[ CH=CH ]n
nCH≡CH
聚乙炔可用于制备导电高分子材料。
一些高分子的共轭大π 键体系为电荷传递提供了通路,像聚苯胺、聚苯等经过掺杂处理后也具有一定的导电性能。
③加聚反应
【思考与讨论】
(1)请写出戊炔所有属于炔烃的同分异构体的结构简式。
(2)请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
(3)某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
【课堂反馈】为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中可能含有少量还原性的杂质气体。由此他提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式:___________________________________。
(2)甲同学设计的实验___________(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________(填字母)。
a.使溴水褪色的反应,未必是加成反应 b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔 d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是__________;它与溴水反应的化学方程式是_______________________________________________________,所以在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
CaC2+2H2O―→CH≡CH↑+Ca(OH)2、
CH≡CH+Br2―→CHBr=CHBr(或CH≡CH+2Br2―→CHBr2-CHBr2)
不能
ac
H2S
Br2+H2S===S↓+2HBr
c
b
CuSO4溶液
CuSO4溶液
【例】下列各选项能说明分子式为C4H6的某烃是HC≡C—CH2—CH3,而不是CH2=CH—CH=CH2的事实是( )
燃烧有浓烟
能使酸性KMnO4溶液褪色
能与Br2按照1:2的比例发生加成反应
与足量Br2反应,生成物中只有2个碳原子上有溴原子
D
链状烷烃 烯烃 炔烃
通式 CnH2n+2(n≥1) CnH2n(n≥2) CnH2n-2(n≥2)
代表物 CH4 CH2==CH2 CH≡CH
结构特点 全部为单键;饱和链烃 含碳碳双键;不饱和链烃 含碳碳三键;不饱和链烃
化学性质 取代反应 光照卤代 - -
加成反应 - 能与H2、X2、HX、H2O、HCN等发生加成反应 氧化反应 燃烧火焰较明亮 燃烧火焰明亮,伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
不与酸性KMnO4溶液反应 能使酸性KMnO4溶液褪色 加聚反应 - 能发生 鉴别 溴水和酸性KMnO4溶液均不褪色 溴水和酸性KMnO4溶液均褪色 链状烷烃、烯烃、炔烃的结构和化学性质的比较
选择性必修3
第二章 烃
第二节 炔烃
(1)炔烃的定义:分子里含有碳碳三键的一类烃
(2)官能团:碳碳三键(—C≡C—)
(3)单炔烃的通式:CnH2n-2(n≥2) 命名原则与烯烃相同
-C-C-
H
H
H
H
链状烷烃
CnH2n+2
-2H
-C = C-
H
H
单烯烃
CnH2n
-2H
-C≡C-
单炔烃
CnH2n-2(n≥2)
1、炔烃
2、乙炔的物理性质
俗称电石气,无色、无臭的气体,微溶于水,易溶于有机溶剂。
炔烃物理性质的递变规律与烷烃、烯烃的相似:
(1) 常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态。
(2) 随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低。
(3) 随着碳原子数的增多,相对密度逐渐增大。
(4) 密度均比水小,均难溶于水。
3、乙炔的结构
乙炔
乙烯
乙炔,C原子采用sp杂化,分子为直线形,碳碳三键中有1个σ键和2个π键,键长比碳碳双键短。
乙炔有化学性质?
能燃烧
能被酸性高锰酸钾氧化
能发生加成反应
能发生加聚反应
【资料卡】阅读教材P35,总结实验室制备乙炔的实验原理、实验试剂、并选择合适的发生装置
【实验原理】
【实验试剂】
CaC2+2H2O C2H2↑+Ca(OH)2
电石(CaC2)与 饱和食盐水
4、乙炔的化学性质
(1)乙炔的实验室制法
H OH
H OH
[ C≡C ]2-
Ca2+
+
H C C H↑
+ Ca(OH)2
②用分液漏斗控制水流速率,让食盐水逐滴慢慢滴入。
④因电石中含有P、S等元素,与水反应会生成PH3、H2S等杂质会干扰乙炔的性质检验,常用CuSO4将其除去。
③电石与水剧烈反应会产生大量泡沫,易堵塞管口,应在导气管附近塞入少量棉花。
①电石与水反应剧烈,为了减缓反应速率,用饱和食盐水代替水。
【实验装置】
固体 +液体 气体
与制CO2、H2、H2S相似,但不可用启普发生器。
装置①,反应装置,作用:产生乙炔。
装置②,除杂装置,作用:除去杂质H2S、PH3。
装置③,检验及反应装置,作用:检验是否有乙炔产生及乙炔与酸性高锰酸钾溶液的反应。
装置④,反应装置,作用:乙炔与溴的四氯化碳溶液反应。
装置⑤,尾气处理装置,作用:去除未反应的乙炔。
实验记录
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
产生明亮的火焰,有黑烟
甲烷
乙烯
乙炔
①可燃性
O2
4CO2+2H2O
2C2H2+ 5
火焰明亮,并伴有浓烟
注意:点燃前要验纯!
①乙炔的氧化反应
(2)乙炔的化学性质
根据乙炔通入酸性高锰酸钾溶液时的实验现象,说明乙炔具有怎样的化学性质
乙炔易被氧化
溶液紫色逐渐褪去
图片来自网络
图片来自网络
可使酸性KMnO4溶液褪色
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
可用于鉴别炔烃和烷烃,但不能除杂!!
乙炔能发生加成反应
总反应:CH≡CH + 2Br2 → CHBr2CHBr2
1,2-二溴乙烯
1,1,2,2-四溴乙烷
溴的颜色逐渐褪去,生成无色易溶于四氯化碳的物质。
②加成反应(与反应物的量有关,可分步表示)
②加成反应(与反应物的量有关,可分步表示)
催化加氢
CH≡CH+H2
催化剂
△
CH2=CH2
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+2H2
CH3CH3
△
CH≡CH+H2O CH3CHO
与HX等的反应
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
CH2=CH-OH
(乙烯醇)
与H2O的反应
很不稳定
催化剂
[ CH=CH ]n
nCH≡CH
聚乙炔可用于制备导电高分子材料。
一些高分子的共轭大π 键体系为电荷传递提供了通路,像聚苯胺、聚苯等经过掺杂处理后也具有一定的导电性能。
③加聚反应
【思考与讨论】
(1)请写出戊炔所有属于炔烃的同分异构体的结构简式。
(2)请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
(3)某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式。
【课堂反馈】为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中可能含有少量还原性的杂质气体。由此他提出必须先除去杂质,再与溴水反应。请回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式:___________________________________。
(2)甲同学设计的实验___________(填“能”或“不能”)验证乙炔与溴发生加成反应,其理由是________(填字母)。
a.使溴水褪色的反应,未必是加成反应 b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔 d.使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是__________;它与溴水反应的化学方程式是_______________________________________________________,所以在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
CaC2+2H2O―→CH≡CH↑+Ca(OH)2、
CH≡CH+Br2―→CHBr=CHBr(或CH≡CH+2Br2―→CHBr2-CHBr2)
不能
ac
H2S
Br2+H2S===S↓+2HBr
c
b
CuSO4溶液
CuSO4溶液
【例】下列各选项能说明分子式为C4H6的某烃是HC≡C—CH2—CH3,而不是CH2=CH—CH=CH2的事实是( )
燃烧有浓烟
能使酸性KMnO4溶液褪色
能与Br2按照1:2的比例发生加成反应
与足量Br2反应,生成物中只有2个碳原子上有溴原子
D
链状烷烃 烯烃 炔烃
通式 CnH2n+2(n≥1) CnH2n(n≥2) CnH2n-2(n≥2)
代表物 CH4 CH2==CH2 CH≡CH
结构特点 全部为单键;饱和链烃 含碳碳双键;不饱和链烃 含碳碳三键;不饱和链烃
化学性质 取代反应 光照卤代 - -
加成反应 - 能与H2、X2、HX、H2O、HCN等发生加成反应 氧化反应 燃烧火焰较明亮 燃烧火焰明亮,伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
不与酸性KMnO4溶液反应 能使酸性KMnO4溶液褪色 加聚反应 - 能发生 鉴别 溴水和酸性KMnO4溶液均不褪色 溴水和酸性KMnO4溶液均褪色 链状烷烃、烯烃、炔烃的结构和化学性质的比较
