第三章 第四节 第4课时 难溶电解质沉淀溶解平衡图像分析 课时练(含答案)2023-2024学年化学人教(2019)
文档属性
| 名称 | 第三章 第四节 第4课时 难溶电解质沉淀溶解平衡图像分析 课时练(含答案)2023-2024学年化学人教(2019) |  | |
| 格式 | docx | ||
| 文件大小 | 550.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 22:27:51 | ||
图片预览



文档简介
第4课时 难溶电解质沉淀溶解平衡图像分析
题组一 浓度曲线型图像
1.在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
A.t ℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t ℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t ℃时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
2.一定温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入一定量BaCl2固体,可使溶液由d点变到b点
B.加入一定量Na2SO4固体,可使溶液由a点变到c点
C.通过蒸发可以使d点不饱和溶液变为c点饱和溶液
D.a、c点溶液对应的Ksp不同
3.25 ℃时,MnCO3和CaCO3的沉淀溶解平衡曲线如图(M2+代表Mn2+或Ca2+)所示。下列说法不正确的是( )
A.a点可表示CaCO3的饱和溶液
B.c点可表示CaCO3的过饱和溶液,达到新平衡时可达b点
C.d点时溶液中存在c(Mn2+)·c(CO)=1.6×10-11(忽略单位)
D.用0.10 mol·L-1 CaCl2溶液浸泡足量MnCO3,会有部分MnCO3转化为CaCO3
题组二 对数型图像
4.(2022·洛阳高二检测)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
A.Ksp(CuCl)的数量级为10-7
B.除去Cl-的反应为Cu+Cu2++2Cl-===2CuCl
C.加入Cu越多,Cu+浓度越高,除去Cl-的效果越好
D.2Cu+ Cu2++Cu平衡常数很大,反应趋于完全
5.25 ℃时,PbR(R2-为SO或CO)的沉淀溶解平衡关系如图所示。已知25 ℃时,Ksp(PbCO3)A.a表示PbCO3的沉淀溶解平衡曲线
B.Y点溶液是PbCO3的过饱和溶液
C.当PbSO4和PbCO3沉淀共存时,溶液中=1×105
D.向X点对应的饱和溶液中加入少量Pb(NO3)2固体,可转化为Y点对应的溶液
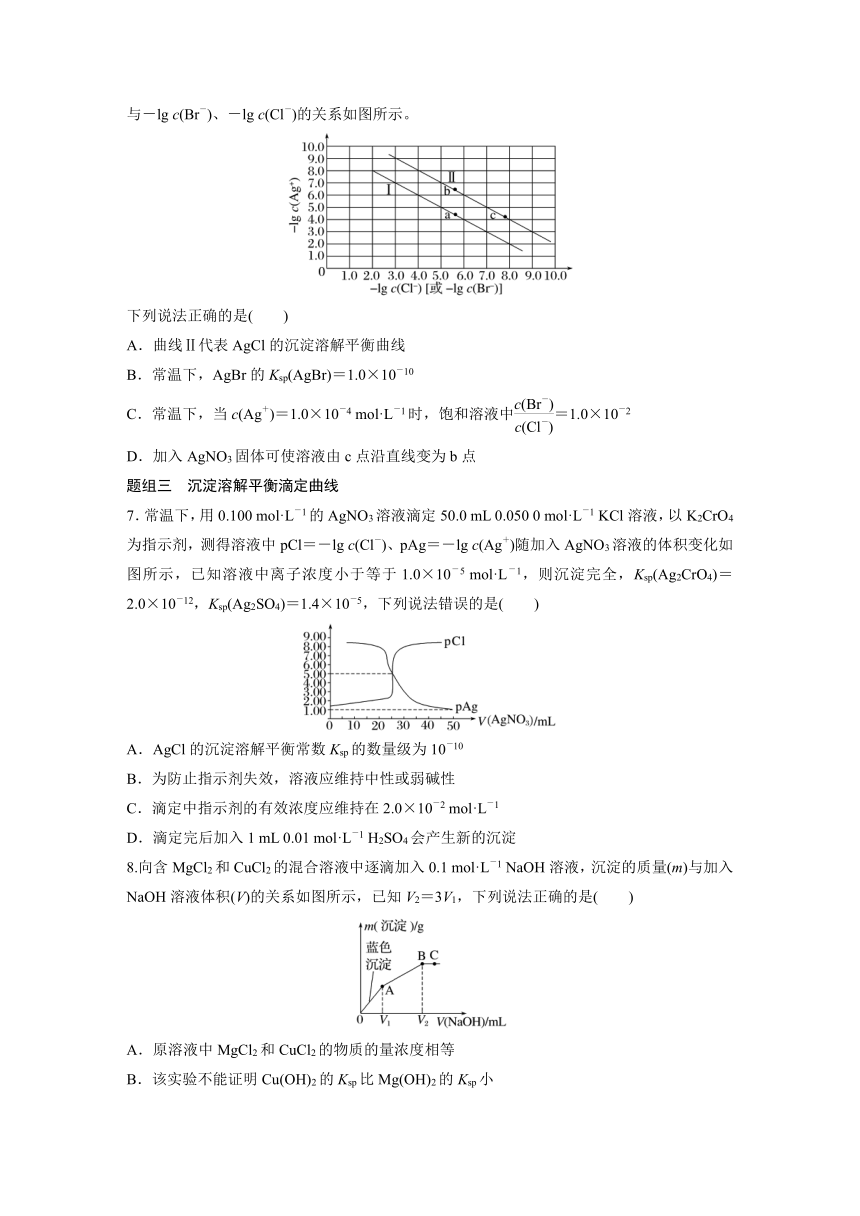
6.(2022·杭州高二调研)已知:常温下,Ksp(AgBr)<Ksp(AgCl)。某温度下,饱和溶液中-lg c(Ag+)与-lg c(Br-)、-lg c(Cl-)的关系如图所示。
下列说法正确的是( )
A.曲线Ⅱ代表AgCl的沉淀溶解平衡曲线
B.常温下,AgBr的Ksp(AgBr)=1.0×10-10
C.常温下,当c(Ag+)=1.0×10-4 mol·L-1时,饱和溶液中=1.0×10-2
D.加入AgNO3固体可使溶液由c点沿直线变为b点
题组三 沉淀溶解平衡滴定曲线
7.常温下,用0.100 mol·L-1的AgNO3溶液滴定50.0 mL 0.050 0 mol·L-1 KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lg c(Cl-)、pAg=-lg c(Ag+)随加入AgNO3溶液的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5 mol·L-1,则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )
A.AgCl的沉淀溶解平衡常数Ksp的数量级为10-10
B.为防止指示剂失效,溶液应维持中性或弱碱性
C.滴定中指示剂的有效浓度应维持在2.0×10-2 mol·L-1
D.滴定完后加入1 mL 0.01 mol·L-1 H2SO4会产生新的沉淀
8.向含MgCl2和CuCl2的混合溶液中逐滴加入0.1 mol·L-1 NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
A.原溶液中MgCl2和CuCl2的物质的量浓度相等
B.该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小
C.水的电离程度:A>B>C
D.若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成
9.一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵坐标p(Mn+)表示-lg c(Mn+),横坐标p(S2-)表示-lg c(S2-),下列说法不正确的是( )
A.该温度下,Ag2S的Ksp=1.6×10-49
B.该温度下,溶解度的大小顺序为NiS>SnS
C.SnS和NiS的饱和溶液中=104
D.向含有等物质的量浓度的Ag+、Ni2+、Sn2+溶液中加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S、SnS、NiS
10.(2021·全国甲卷,12)已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3)。某温度下,饱和溶液中-lg[c(SO)]、-lg[c(CO)]与-lg[c(Ba2+)]的关系如图所示。下列说法正确的是( )
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10
C.加适量BaCl2固体可使溶液由a点变到b点
D.c(Ba2+)=10-5.1时两溶液中=
11.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O的水解,Xn-代表Cl-、C2O)。下列叙述正确的是( )
A.反应Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O(aq)的平衡常数表达式为K=
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O)的混合溶液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ksp(Ag2C2O4)的数量级等于10-7
12.常温时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。请回答下列问题:
(1)A点表示的溶液,离子积Q______(填“>”“<”或“=”)溶度积Ksp。
(2)B点对应的Ksp__________(填“>”“<”或“=”)C点对应的Ksp。
(3)通过蒸发一部分溶剂的方法能否使溶液由A点变到B点?______(填“能”或“不能”),理由是________________________________________________________________________
________________________________________________________________________。
(4)使溶液由C点变到B点的方法可以是____________________________(写一种)。
(5)常温下,Ag2SO4的溶度积Ksp=__________。
13.金属氢氧化物在酸中的溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图所示。
(1)pH=3时溶液中铜元素的主要存在形式是__________________________________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为________(填字母)。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是____________________________________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________________________________________。
第4课时 难溶电解质沉淀溶解平衡图像分析
1.A 2.B
3.B [a点在CaCO3沉淀溶解平衡曲线上,可表示CaCO3的饱和溶液,A正确;c点表示的是CaCO3的过饱和溶液,溶液中存在CaCO3(s)Ca2+(aq)+CO(aq),平衡逆向移动,c(Ca2+)、c(CO)同时减小,达到新平衡后,无法到达b点,B错误;d点在MnCO3的沉淀溶解平衡曲线上,根据图可知,c(Mn2+)·c(CO)=4×10-6×4×10-6=1.6×10-11,C正确;虽然MnCO3的溶度积常数小于CaCO3,但是仍会发生反应Ca2+(aq)+MnCO3(s)CaCO3(s)+Mn2+(aq),用0.10 mol·L-1 CaCl2溶液浸泡足量MnCO3,相当于增大反应物浓度,平衡正向移动,会有部分碳酸锰转化为碳酸钙,D正确。]
4.C [由图像可知,横坐标为1时,lg c(Cu+)大于-6,则Ksp(CuCl)的数量级为10-7,故A正确;涉及反应物为铜、硫酸铜以及氯离子,生成物为CuCl,反应的离子方程式为Cu+Cu2++2Cl-===2CuCl,故B正确;反应Cu+Cu2++2Cl-===2CuCl的效果取决于Cu2+的浓度,如Cu2+不足,则加入再多的Cu也不能改变效果,故C错误;由题图可知,交点处c(Cu+)=c(Cu2+)≈10-6 mol·L-1,则2Cu+Cu2++Cu的平衡常数K=106,该平衡常数很大,反应2Cu+Cu2++Cu趋向于完全,故D正确。]
5.D 6.C
7.D [根据图像,当pCl=pAg时,溶液中c(Ag+)=c(Cl-)=10-5 mol·L-1,则AgCl的沉淀溶解平衡常数Ksp的数量级为10-10,故A正确;指示剂使用的是K2CrO4,溶液中存在Ag+,如果溶液为酸性,则CrO易形成Cr2O,如果溶液是碱性的,则易生成Ag2O,因此溶液需维持中性或弱碱性,故B正确;溶液中Cl-沉淀完全时c(Ag+)=10-5 mol·L-1,形成Ag2CrO4时,所需c(CrO)==2.0×10-2 mol·L-1,故C正确;滴定完后,溶液中c(Ag+)=10-5 mol·L-1,产生Ag2SO4时需要c(SO)==1.4×105 mol·L-1,加入1 mL 0.01 mol·
L-1 H2SO4,显然H2SO4的量是不够的,所以不能产生新的沉淀,故D错误。]
8.C 9.C
10.B [由题可知,曲线上的点均为饱和溶液中微粒浓度关系,由题分析可知,曲线①为BaSO4的沉淀溶解曲线,选项A错误;曲线①为BaSO4溶液中-lg[c(Ba2+)]与-lg[c(SO)]的关系,由图可知,当溶液中-lg[c(Ba2+)]=3时,-lg[c(SO)]=7,则-lg[Ksp(BaSO4)]=7+3=10,因此Ksp(BaSO4)=1.0×10-10,选项B正确;向饱和BaCO3溶液中加入适量BaCl2固体后,溶液中c(Ba2+)增大,根据温度不变则Ksp(BaCO3)不变可知,溶液中c(CO)将减小,因此a点将沿曲线②向左上方移动,选项C错误;由图可知,当溶液中c(Ba2+)=10-5.1时,两溶液中=,选项D错误。]
11.A [Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O(aq)的平衡常数K=,A项正确,n点的离子积Q(AgCl)>Ksp(AgCl),所以该点为氯化银的过饱和溶液,有沉淀析出,B项错误;由图可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小,故向c(Cl-)=c(C2O)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,C项错误;由图中数据可知,Ksp(Ag2C2O4)=c2(Ag+)·c(C2O)=(10-4)2×10-2.46=10-10.46,故数量级为10-11,D项错误。]
12.(1)< (2)= (3)不能 蒸发溶剂,c(SO)和c(Ag+)都变大,A点到B点c(SO)未发生变化,故不能 (4)加入Na2SO4固体或溶液(合理即可) (5)1.6×10-5
13.(1)Cu2+ (2)B (3)不能 Co2+和Ni2+沉淀的pH范围相差太小
(4)Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O
解析 (1)据图知pH=4~5时,Cu2+开始沉淀为Cu(OH)2,因此pH=3时,铜元素主要以Cu2+的形式存在。(2)若要除去CuCl2溶液中的Fe3+,应保证Fe3+完全沉淀,而Cu2+还未沉淀,据图知pH为4左右。(3)Co2+和Ni2+沉淀的pH范围相差太小,无法通过调节溶液pH的方法除去Ni(NO3)2溶液中的Co2+。(4)据已知条件结合原子守恒即可写出离子方程式:Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O。
题组一 浓度曲线型图像
1.在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
A.t ℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t ℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t ℃时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,Cl-先沉淀
2.一定温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A.加入一定量BaCl2固体,可使溶液由d点变到b点
B.加入一定量Na2SO4固体,可使溶液由a点变到c点
C.通过蒸发可以使d点不饱和溶液变为c点饱和溶液
D.a、c点溶液对应的Ksp不同
3.25 ℃时,MnCO3和CaCO3的沉淀溶解平衡曲线如图(M2+代表Mn2+或Ca2+)所示。下列说法不正确的是( )
A.a点可表示CaCO3的饱和溶液
B.c点可表示CaCO3的过饱和溶液,达到新平衡时可达b点
C.d点时溶液中存在c(Mn2+)·c(CO)=1.6×10-11(忽略单位)
D.用0.10 mol·L-1 CaCl2溶液浸泡足量MnCO3,会有部分MnCO3转化为CaCO3
题组二 对数型图像
4.(2022·洛阳高二检测)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
A.Ksp(CuCl)的数量级为10-7
B.除去Cl-的反应为Cu+Cu2++2Cl-===2CuCl
C.加入Cu越多,Cu+浓度越高,除去Cl-的效果越好
D.2Cu+ Cu2++Cu平衡常数很大,反应趋于完全
5.25 ℃时,PbR(R2-为SO或CO)的沉淀溶解平衡关系如图所示。已知25 ℃时,Ksp(PbCO3)
B.Y点溶液是PbCO3的过饱和溶液
C.当PbSO4和PbCO3沉淀共存时,溶液中=1×105
D.向X点对应的饱和溶液中加入少量Pb(NO3)2固体,可转化为Y点对应的溶液
6.(2022·杭州高二调研)已知:常温下,Ksp(AgBr)<Ksp(AgCl)。某温度下,饱和溶液中-lg c(Ag+)与-lg c(Br-)、-lg c(Cl-)的关系如图所示。
下列说法正确的是( )
A.曲线Ⅱ代表AgCl的沉淀溶解平衡曲线
B.常温下,AgBr的Ksp(AgBr)=1.0×10-10
C.常温下,当c(Ag+)=1.0×10-4 mol·L-1时,饱和溶液中=1.0×10-2
D.加入AgNO3固体可使溶液由c点沿直线变为b点
题组三 沉淀溶解平衡滴定曲线
7.常温下,用0.100 mol·L-1的AgNO3溶液滴定50.0 mL 0.050 0 mol·L-1 KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lg c(Cl-)、pAg=-lg c(Ag+)随加入AgNO3溶液的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5 mol·L-1,则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )
A.AgCl的沉淀溶解平衡常数Ksp的数量级为10-10
B.为防止指示剂失效,溶液应维持中性或弱碱性
C.滴定中指示剂的有效浓度应维持在2.0×10-2 mol·L-1
D.滴定完后加入1 mL 0.01 mol·L-1 H2SO4会产生新的沉淀
8.向含MgCl2和CuCl2的混合溶液中逐滴加入0.1 mol·L-1 NaOH溶液,沉淀的质量(m)与加入NaOH溶液体积(V)的关系如图所示,已知V2=3V1,下列说法正确的是( )
A.原溶液中MgCl2和CuCl2的物质的量浓度相等
B.该实验不能证明Cu(OH)2的Ksp比Mg(OH)2的Ksp小
C.水的电离程度:A>B>C
D.若向Mg(OH)2悬浊液中加入CuCl2溶液,一定会有Cu(OH)2生成
9.一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵坐标p(Mn+)表示-lg c(Mn+),横坐标p(S2-)表示-lg c(S2-),下列说法不正确的是( )
A.该温度下,Ag2S的Ksp=1.6×10-49
B.该温度下,溶解度的大小顺序为NiS>SnS
C.SnS和NiS的饱和溶液中=104
D.向含有等物质的量浓度的Ag+、Ni2+、Sn2+溶液中加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S、SnS、NiS
10.(2021·全国甲卷,12)已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3)。某温度下,饱和溶液中-lg[c(SO)]、-lg[c(CO)]与-lg[c(Ba2+)]的关系如图所示。下列说法正确的是( )
A.曲线①代表BaCO3的沉淀溶解曲线
B.该温度下BaSO4的Ksp(BaSO4)值为1.0×10-10
C.加适量BaCl2固体可使溶液由a点变到b点
D.c(Ba2+)=10-5.1时两溶液中=
11.常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O的水解,Xn-代表Cl-、C2O)。下列叙述正确的是( )
A.反应Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O(aq)的平衡常数表达式为K=
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O)的混合溶液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ksp(Ag2C2O4)的数量级等于10-7
12.常温时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。请回答下列问题:
(1)A点表示的溶液,离子积Q______(填“>”“<”或“=”)溶度积Ksp。
(2)B点对应的Ksp__________(填“>”“<”或“=”)C点对应的Ksp。
(3)通过蒸发一部分溶剂的方法能否使溶液由A点变到B点?______(填“能”或“不能”),理由是________________________________________________________________________
________________________________________________________________________。
(4)使溶液由C点变到B点的方法可以是____________________________(写一种)。
(5)常温下,Ag2SO4的溶度积Ksp=__________。
13.金属氢氧化物在酸中的溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图所示。
(1)pH=3时溶液中铜元素的主要存在形式是__________________________________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为________(填字母)。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是____________________________________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________________________________________。
第4课时 难溶电解质沉淀溶解平衡图像分析
1.A 2.B
3.B [a点在CaCO3沉淀溶解平衡曲线上,可表示CaCO3的饱和溶液,A正确;c点表示的是CaCO3的过饱和溶液,溶液中存在CaCO3(s)Ca2+(aq)+CO(aq),平衡逆向移动,c(Ca2+)、c(CO)同时减小,达到新平衡后,无法到达b点,B错误;d点在MnCO3的沉淀溶解平衡曲线上,根据图可知,c(Mn2+)·c(CO)=4×10-6×4×10-6=1.6×10-11,C正确;虽然MnCO3的溶度积常数小于CaCO3,但是仍会发生反应Ca2+(aq)+MnCO3(s)CaCO3(s)+Mn2+(aq),用0.10 mol·L-1 CaCl2溶液浸泡足量MnCO3,相当于增大反应物浓度,平衡正向移动,会有部分碳酸锰转化为碳酸钙,D正确。]
4.C [由图像可知,横坐标为1时,lg c(Cu+)大于-6,则Ksp(CuCl)的数量级为10-7,故A正确;涉及反应物为铜、硫酸铜以及氯离子,生成物为CuCl,反应的离子方程式为Cu+Cu2++2Cl-===2CuCl,故B正确;反应Cu+Cu2++2Cl-===2CuCl的效果取决于Cu2+的浓度,如Cu2+不足,则加入再多的Cu也不能改变效果,故C错误;由题图可知,交点处c(Cu+)=c(Cu2+)≈10-6 mol·L-1,则2Cu+Cu2++Cu的平衡常数K=106,该平衡常数很大,反应2Cu+Cu2++Cu趋向于完全,故D正确。]
5.D 6.C
7.D [根据图像,当pCl=pAg时,溶液中c(Ag+)=c(Cl-)=10-5 mol·L-1,则AgCl的沉淀溶解平衡常数Ksp的数量级为10-10,故A正确;指示剂使用的是K2CrO4,溶液中存在Ag+,如果溶液为酸性,则CrO易形成Cr2O,如果溶液是碱性的,则易生成Ag2O,因此溶液需维持中性或弱碱性,故B正确;溶液中Cl-沉淀完全时c(Ag+)=10-5 mol·L-1,形成Ag2CrO4时,所需c(CrO)==2.0×10-2 mol·L-1,故C正确;滴定完后,溶液中c(Ag+)=10-5 mol·L-1,产生Ag2SO4时需要c(SO)==1.4×105 mol·L-1,加入1 mL 0.01 mol·
L-1 H2SO4,显然H2SO4的量是不够的,所以不能产生新的沉淀,故D错误。]
8.C 9.C
10.B [由题可知,曲线上的点均为饱和溶液中微粒浓度关系,由题分析可知,曲线①为BaSO4的沉淀溶解曲线,选项A错误;曲线①为BaSO4溶液中-lg[c(Ba2+)]与-lg[c(SO)]的关系,由图可知,当溶液中-lg[c(Ba2+)]=3时,-lg[c(SO)]=7,则-lg[Ksp(BaSO4)]=7+3=10,因此Ksp(BaSO4)=1.0×10-10,选项B正确;向饱和BaCO3溶液中加入适量BaCl2固体后,溶液中c(Ba2+)增大,根据温度不变则Ksp(BaCO3)不变可知,溶液中c(CO)将减小,因此a点将沿曲线②向左上方移动,选项C错误;由图可知,当溶液中c(Ba2+)=10-5.1时,两溶液中=,选项D错误。]
11.A [Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O(aq)的平衡常数K=,A项正确,n点的离子积Q(AgCl)>Ksp(AgCl),所以该点为氯化银的过饱和溶液,有沉淀析出,B项错误;由图可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小,故向c(Cl-)=c(C2O)的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,C项错误;由图中数据可知,Ksp(Ag2C2O4)=c2(Ag+)·c(C2O)=(10-4)2×10-2.46=10-10.46,故数量级为10-11,D项错误。]
12.(1)< (2)= (3)不能 蒸发溶剂,c(SO)和c(Ag+)都变大,A点到B点c(SO)未发生变化,故不能 (4)加入Na2SO4固体或溶液(合理即可) (5)1.6×10-5
13.(1)Cu2+ (2)B (3)不能 Co2+和Ni2+沉淀的pH范围相差太小
(4)Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O
解析 (1)据图知pH=4~5时,Cu2+开始沉淀为Cu(OH)2,因此pH=3时,铜元素主要以Cu2+的形式存在。(2)若要除去CuCl2溶液中的Fe3+,应保证Fe3+完全沉淀,而Cu2+还未沉淀,据图知pH为4左右。(3)Co2+和Ni2+沉淀的pH范围相差太小,无法通过调节溶液pH的方法除去Ni(NO3)2溶液中的Co2+。(4)据已知条件结合原子守恒即可写出离子方程式:Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O。
