第四章 第三节 金属的腐蚀与防护 课时练(含答案)2023-2024学年化学人教(2019)
文档属性
| 名称 | 第四章 第三节 金属的腐蚀与防护 课时练(含答案)2023-2024学年化学人教(2019) |  | |
| 格式 | docx | ||
| 文件大小 | 594.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 23:17:29 | ||
图片预览



文档简介
第三节 金属的腐蚀与防护
题组一 金属的腐蚀
1.下列关于金属腐蚀的叙述正确的是( )
A.金属被腐蚀的本质:2xM+yO2===2MxOy
B.马口铁(镀锡铁)镀层破损后,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
2.铜板上铁铆钉的吸氧腐蚀原理如图所示。下列说法正确的是( )
A.正极电极反应式为2H++2e-===H2↑
B.此过程中还涉及反应4Fe(OH)2+2H2O+O2===4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe流向Cu
3.如图所示是探究铁发生腐蚀的装置图,下列说法正确的是( )
A.若B处液面上升,A溶液可能是酸性溶液
B.若A溶液为NaCl溶液,B、C液面始终保持不变
C.可能产生Fe2O3·nH2O
D.腐蚀的总反应式一定是2Fe+O2+2H2O===2Fe(OH)2
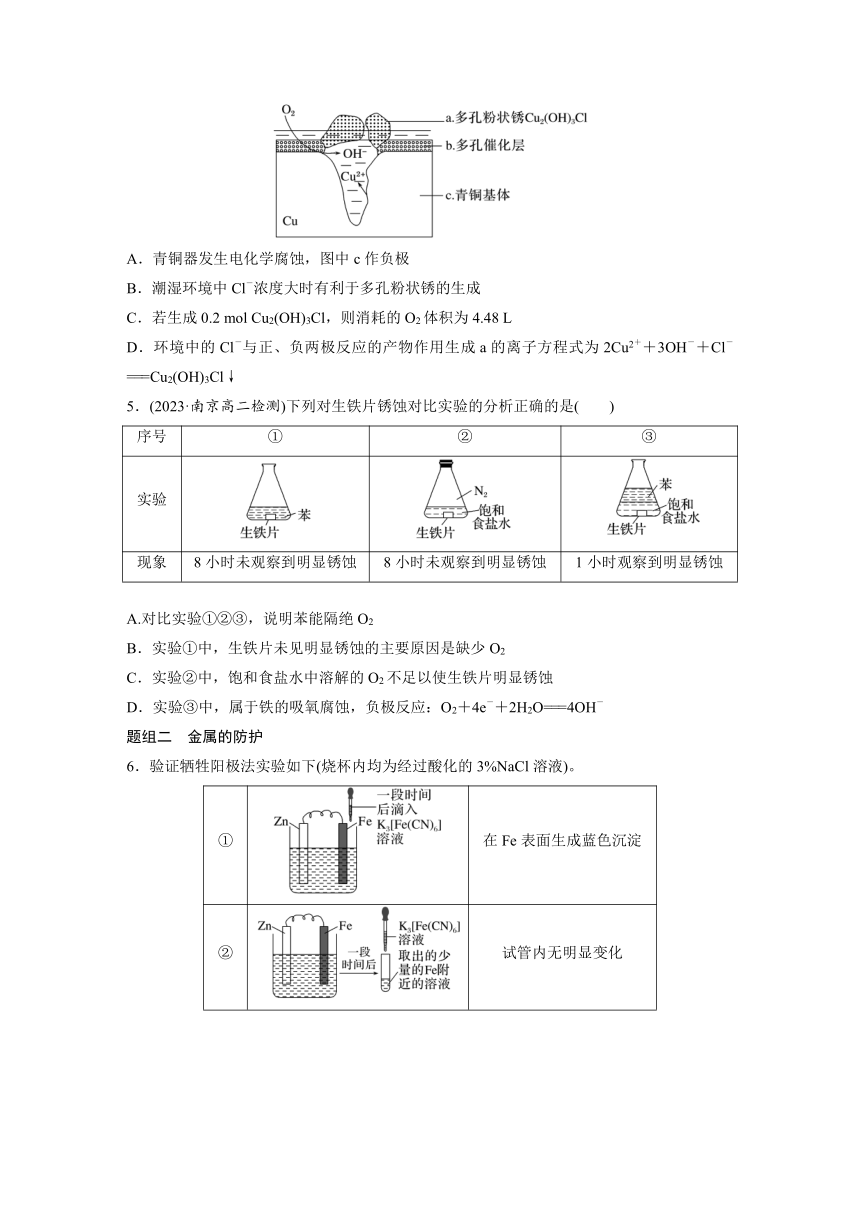
4.宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是( )
A.青铜器发生电化学腐蚀,图中c作负极
B.潮湿环境中Cl-浓度大时有利于多孔粉状锈的生成
C.若生成0.2 mol Cu2(OH)3Cl,则消耗的O2体积为4.48 L
D.环境中的Cl-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓
5.(2023·南京高二检测)下列对生铁片锈蚀对比实验的分析正确的是( )
序号 ① ② ③
实验
现象 8小时未观察到明显锈蚀 8小时未观察到明显锈蚀 1小时观察到明显锈蚀
A.对比实验①②③,说明苯能隔绝O2
B.实验①中,生铁片未见明显锈蚀的主要原因是缺少O2
C.实验②中,饱和食盐水中溶解的O2不足以使生铁片明显锈蚀
D.实验③中,属于铁的吸氧腐蚀,负极反应:O2+4e-+2H2O===4OH-
题组二 金属的防护
6.验证牺牲阳极法实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① 在Fe表面生成蓝色沉淀
② 试管内无明显变化
③ 试管内生成蓝色沉淀
下列说法不正确的是( )
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
7.2021年7月20日,郑州遭遇特大暴雨,导致贾鲁河下游水位上涨,周口市进行开闸放水,闸门由钢质材料制作,长期浸于水中,通常采用如图装置对钢闸门进行保护。下列说法不正确的是( )
A.a、b间用导线连接时,则X可以是锌
B.a、b间接入电源时,a应连在电源的负极上
C.X应定期更换
D.a、b间用导线连接时,则X发生还原反应
题组三 金属腐蚀和防护的综合考查
8.下列关于金属腐蚀与防护的说法不正确的是( )
A.图①,放置于干燥空气中的铁钉不易生锈
B.图②,若断开电源,钢闸门将发生吸氧腐蚀
C.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D.图③,若金属M比Fe活泼,可防止钢铁输水管腐蚀
9.在城市地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀,其腐蚀原理如图所示。下列有关说法不正确的是( )
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色
C.溶液中铁丝左侧电极反应式为Fe-2e-===Fe2+
D.地下管道被腐蚀后不易被发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
10.在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是( )
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,采用下列方法:用酒精灯加热左边的具支试管
B.图Ⅲ装置的总反应为4Al+3O2+6H2O===4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
C.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
D.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并在铝箔上发生电极反应:2Cl--2e-===Cl2↑
11.支撑海港码头基础的钢管桩,常用外加电流法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
12.某实验小组欲探究牺牲阳极法的原理,设计如图实验装置:
实验Ⅰ:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流表连接后,再分别插入两个玻璃筒中,电流表指针发生偏转。
(1)锌棒上发生的电极反应为________________________________________________;
铁棒上发生的电极反应为________________。
(2)从铁棒附近取少量溶液于试管中,再向试管中滴加几滴K3[Fe(CN)6]溶液,无明显现象,这说明该实验中无________产生。
实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流表连接。一段时间后,从插入铁棒的玻璃筒内取少量溶液于试管中,再向试管中滴入几滴K3[Fe(CN)6]溶液,向插入铜棒的玻璃筒内滴入几滴酚酞溶液。
(3)实验Ⅱ中电流表指针的偏转方向与实验Ⅰ________(填“相同”或“相反”)。
(4)在铁棒和铜棒附近可观察到的现象分别是__________________、____________________。
(5)上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对________(填“活泼”或“不活泼”)的金属被保护,根据此原理采取的金属防护方法称为____________。
13.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号 实验目的 碳粉/g 铁粉/g 醋酸/%
① 为以下实验作参照 0.5 2.0 90.0
② 醋酸浓度的影响 0.5 36.0
③ 0.2 2.0 90.0
(2)编号①实验测得容器中压强随时间变化曲线如图2所示。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了_________(填“氧化”或“还原”)反应,其电极反应式是__________。
(3)该小组对图2中O~t1时压强变大的原因提出了如下假设,请你完成假设二。
假设一:发生析氢腐蚀产生了气体;
假设二:________________________________________________________________________。
14.关于铁生锈的机理有人提出如下4个步骤:
①Fe-2e-===Fe2+ ②H++e-===H ③4H+O2===2H2O ④4Fe2++O2+(4+2x)H2O===2Fe2O3·xH2O+8H+
试根据以上过程回答下列问题:
(1)根据以上机理,判断下列说法正确的是______________(填字母,下同)。
A.以上锈蚀过程发生的是化学腐蚀
B.从锈蚀反应的最终结果看,水既是氧化剂,又是还原剂
C.反应的实质是氧气被还原,金属铁被氧化
D.从反应机理看,锈蚀过程发生的是析氢腐蚀
(2)某铁件需长期浸于水下,为了减缓腐蚀,采取的下列措施正确的有__________________。
A.给铁件铆上一些锌板
B.给铁件通入直流电,把铁件与电源正极连接
C.在制造铁件时,在铁中掺入一定比例的铜制成合金
D.在铁件表面涂上一层较厚的沥青
(3)质量为1 000 g的某铁件已在水下生锈,若已知整个锈蚀过程中有6 mol电子发生转移,则参加反应的O2在标准状况下的体积为____________ L,生锈后铁件的质量为______ g(已知铁锈Fe2O3·xH2O中x的值为1)。
第三节 金属的腐蚀与防护
1.C 2.B 3.C
4.C [根据题图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,腐蚀过程中c作负极,A项正确;潮湿环境中的Cl-与正极反应产物氢氧根离子和负极反应产物铜离子作用生成多孔粉状锈Cu2(OH)3Cl,离子方程式为2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓,潮湿环境中Cl-浓度大时,有利于多孔粉状锈的生成,B、D项正确;未指明是否为标准状况,无法计算消耗的O2体积,C项错误。]
5.C [对比①②③,说明生铁腐蚀,碳为正极,铁为负极,需足量O2和水,由实验③可知,生铁片明显锈蚀,说明苯不能隔绝O2,故A错误;原电池的形成条件:有两个活泼性不同的电极、电解质溶液、闭合回路,实验①中,苯不是电解质溶液,生铁难以腐蚀,故B错误;实验③中,铁是负极,发生氧化反应,生成Fe2+,电极反应为Fe-2e-===Fe2+,故D错误。]
6.D
7.D [a、b用导线连接时形成原电池,若要保护钢闸门,则X活泼性应强于铁,X可以是锌,A正确;若接入电源,则a应连电源的负极作阴极,B正确;X不断消耗,应定期更换,C正确;a、b用导线连接时形成原电池,X失去电子发生氧化反应,D错误。]
8.C [与电源正极相连作阳极,活泼金属作阳极时,金属失电子易被腐蚀,所以若将钢闸门与电源的正极相连,则会加快钢闸门的腐蚀,故C错误。]
9.C 10.B
11.C [依题意,钢管桩为阴极,电子流向阴极,阴极被保护,故钢管桩表面的腐蚀电流(指铁失去电子形成的电流)接近于0,A项正确;阳极上发生氧化反应,失去电子,电子经外电路流向阴极,阳极上主要是海水中的水被氧化生成氧气,惰性辅助阳极不被损耗,B项正确,C项错误;根据海水对钢管桩的腐蚀情况,增大或减小电流强度,D项正确。]
12.(1)2Zn-4e-===2Zn2+ 2H2O+O2+4e-===4OH- (2)Fe2+ (3)相反 (4)产生蓝色沉淀 溶液变红色 (5)不活泼 牺牲阳极法
13.(1)
编号 实验目的 碳粉/g 铁粉/g 醋酸/%
② 2.0
③ 碳粉含量的影响
(2)吸氧 (如图)
还原 2H2O+O2+4e-===4OH-
(3)反应放热,温度升高
解析 (1)对比编号①,编号②中碳粉的质量与编号①相同,醋酸的浓度与编号①不同,所以铁粉的质量应与编号①相同,即2.0 g;编号③中碳粉质量与编号①不同,铁粉质量和醋酸浓度均与编号①相同,显然编号③的目的是探究碳粉含量的影响。
(2)t2时,容器中压强明显小于起始压强,说明容器中气体减少,所以铁发生的是吸氧腐蚀。在铁发生吸氧腐蚀的过程中,铁为负极,发生氧化反应,生成Fe2+;碳为正极,发生还原反应:2H2O+O2+4e-===4OH-。
(3)O~t1时压强增大,应从两方面考虑,一是生成气体,二是温度升高,则由假设一内容可得假设二:此反应是放热反应,温度升高。
14.(1)C (2)AD (3)33.6 1 066
题组一 金属的腐蚀
1.下列关于金属腐蚀的叙述正确的是( )
A.金属被腐蚀的本质:2xM+yO2===2MxOy
B.马口铁(镀锡铁)镀层破损后,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
2.铜板上铁铆钉的吸氧腐蚀原理如图所示。下列说法正确的是( )
A.正极电极反应式为2H++2e-===H2↑
B.此过程中还涉及反应4Fe(OH)2+2H2O+O2===4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe流向Cu
3.如图所示是探究铁发生腐蚀的装置图,下列说法正确的是( )
A.若B处液面上升,A溶液可能是酸性溶液
B.若A溶液为NaCl溶液,B、C液面始终保持不变
C.可能产生Fe2O3·nH2O
D.腐蚀的总反应式一定是2Fe+O2+2H2O===2Fe(OH)2
4.宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是( )
A.青铜器发生电化学腐蚀,图中c作负极
B.潮湿环境中Cl-浓度大时有利于多孔粉状锈的生成
C.若生成0.2 mol Cu2(OH)3Cl,则消耗的O2体积为4.48 L
D.环境中的Cl-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓
5.(2023·南京高二检测)下列对生铁片锈蚀对比实验的分析正确的是( )
序号 ① ② ③
实验
现象 8小时未观察到明显锈蚀 8小时未观察到明显锈蚀 1小时观察到明显锈蚀
A.对比实验①②③,说明苯能隔绝O2
B.实验①中,生铁片未见明显锈蚀的主要原因是缺少O2
C.实验②中,饱和食盐水中溶解的O2不足以使生铁片明显锈蚀
D.实验③中,属于铁的吸氧腐蚀,负极反应:O2+4e-+2H2O===4OH-
题组二 金属的防护
6.验证牺牲阳极法实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① 在Fe表面生成蓝色沉淀
② 试管内无明显变化
③ 试管内生成蓝色沉淀
下列说法不正确的是( )
A.对比②③,可以判定Zn保护了Fe
B.对比①②,K3[Fe(CN)6]可能将Fe氧化
C.验证Zn保护Fe时不能用①的方法
D.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
7.2021年7月20日,郑州遭遇特大暴雨,导致贾鲁河下游水位上涨,周口市进行开闸放水,闸门由钢质材料制作,长期浸于水中,通常采用如图装置对钢闸门进行保护。下列说法不正确的是( )
A.a、b间用导线连接时,则X可以是锌
B.a、b间接入电源时,a应连在电源的负极上
C.X应定期更换
D.a、b间用导线连接时,则X发生还原反应
题组三 金属腐蚀和防护的综合考查
8.下列关于金属腐蚀与防护的说法不正确的是( )
A.图①,放置于干燥空气中的铁钉不易生锈
B.图②,若断开电源,钢闸门将发生吸氧腐蚀
C.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
D.图③,若金属M比Fe活泼,可防止钢铁输水管腐蚀
9.在城市地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀,其腐蚀原理如图所示。下列有关说法不正确的是( )
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色
C.溶液中铁丝左侧电极反应式为Fe-2e-===Fe2+
D.地下管道被腐蚀后不易被发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
10.在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是( )
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,采用下列方法:用酒精灯加热左边的具支试管
B.图Ⅲ装置的总反应为4Al+3O2+6H2O===4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
C.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
D.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并在铝箔上发生电极反应:2Cl--2e-===Cl2↑
11.支撑海港码头基础的钢管桩,常用外加电流法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是( )
A.通入保护电流使钢管桩表面腐蚀电流接近于零
B.通电后外电路电子被强制从高硅铸铁流向钢管桩
C.高硅铸铁的作用是作为损耗阳极材料和传递电流
D.通入的保护电流应该根据环境条件变化进行调整
12.某实验小组欲探究牺牲阳极法的原理,设计如图实验装置:
实验Ⅰ:向烧杯中加入一定量的饱和食盐水,插入两个无底玻璃筒。将一根锌棒和一根铁棒用导线与电流表连接后,再分别插入两个玻璃筒中,电流表指针发生偏转。
(1)锌棒上发生的电极反应为________________________________________________;
铁棒上发生的电极反应为________________。
(2)从铁棒附近取少量溶液于试管中,再向试管中滴加几滴K3[Fe(CN)6]溶液,无明显现象,这说明该实验中无________产生。
实验Ⅱ:该小组的同学将锌棒换为铜棒,并用导线将其与电流表连接。一段时间后,从插入铁棒的玻璃筒内取少量溶液于试管中,再向试管中滴入几滴K3[Fe(CN)6]溶液,向插入铜棒的玻璃筒内滴入几滴酚酞溶液。
(3)实验Ⅱ中电流表指针的偏转方向与实验Ⅰ________(填“相同”或“相反”)。
(4)在铁棒和铜棒附近可观察到的现象分别是__________________、____________________。
(5)上述两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对________(填“活泼”或“不活泼”)的金属被保护,根据此原理采取的金属防护方法称为____________。
13.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号 实验目的 碳粉/g 铁粉/g 醋酸/%
① 为以下实验作参照 0.5 2.0 90.0
② 醋酸浓度的影响 0.5 36.0
③ 0.2 2.0 90.0
(2)编号①实验测得容器中压强随时间变化曲线如图2所示。t2时,容器中压强明显小于起始压强,其原因是铁发生了________腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了_________(填“氧化”或“还原”)反应,其电极反应式是__________。
(3)该小组对图2中O~t1时压强变大的原因提出了如下假设,请你完成假设二。
假设一:发生析氢腐蚀产生了气体;
假设二:________________________________________________________________________。
14.关于铁生锈的机理有人提出如下4个步骤:
①Fe-2e-===Fe2+ ②H++e-===H ③4H+O2===2H2O ④4Fe2++O2+(4+2x)H2O===2Fe2O3·xH2O+8H+
试根据以上过程回答下列问题:
(1)根据以上机理,判断下列说法正确的是______________(填字母,下同)。
A.以上锈蚀过程发生的是化学腐蚀
B.从锈蚀反应的最终结果看,水既是氧化剂,又是还原剂
C.反应的实质是氧气被还原,金属铁被氧化
D.从反应机理看,锈蚀过程发生的是析氢腐蚀
(2)某铁件需长期浸于水下,为了减缓腐蚀,采取的下列措施正确的有__________________。
A.给铁件铆上一些锌板
B.给铁件通入直流电,把铁件与电源正极连接
C.在制造铁件时,在铁中掺入一定比例的铜制成合金
D.在铁件表面涂上一层较厚的沥青
(3)质量为1 000 g的某铁件已在水下生锈,若已知整个锈蚀过程中有6 mol电子发生转移,则参加反应的O2在标准状况下的体积为____________ L,生锈后铁件的质量为______ g(已知铁锈Fe2O3·xH2O中x的值为1)。
第三节 金属的腐蚀与防护
1.C 2.B 3.C
4.C [根据题图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,腐蚀过程中c作负极,A项正确;潮湿环境中的Cl-与正极反应产物氢氧根离子和负极反应产物铜离子作用生成多孔粉状锈Cu2(OH)3Cl,离子方程式为2Cu2++3OH-+Cl-===Cu2(OH)3Cl↓,潮湿环境中Cl-浓度大时,有利于多孔粉状锈的生成,B、D项正确;未指明是否为标准状况,无法计算消耗的O2体积,C项错误。]
5.C [对比①②③,说明生铁腐蚀,碳为正极,铁为负极,需足量O2和水,由实验③可知,生铁片明显锈蚀,说明苯不能隔绝O2,故A错误;原电池的形成条件:有两个活泼性不同的电极、电解质溶液、闭合回路,实验①中,苯不是电解质溶液,生铁难以腐蚀,故B错误;实验③中,铁是负极,发生氧化反应,生成Fe2+,电极反应为Fe-2e-===Fe2+,故D错误。]
6.D
7.D [a、b用导线连接时形成原电池,若要保护钢闸门,则X活泼性应强于铁,X可以是锌,A正确;若接入电源,则a应连电源的负极作阴极,B正确;X不断消耗,应定期更换,C正确;a、b用导线连接时形成原电池,X失去电子发生氧化反应,D错误。]
8.C [与电源正极相连作阳极,活泼金属作阳极时,金属失电子易被腐蚀,所以若将钢闸门与电源的正极相连,则会加快钢闸门的腐蚀,故C错误。]
9.C 10.B
11.C [依题意,钢管桩为阴极,电子流向阴极,阴极被保护,故钢管桩表面的腐蚀电流(指铁失去电子形成的电流)接近于0,A项正确;阳极上发生氧化反应,失去电子,电子经外电路流向阴极,阳极上主要是海水中的水被氧化生成氧气,惰性辅助阳极不被损耗,B项正确,C项错误;根据海水对钢管桩的腐蚀情况,增大或减小电流强度,D项正确。]
12.(1)2Zn-4e-===2Zn2+ 2H2O+O2+4e-===4OH- (2)Fe2+ (3)相反 (4)产生蓝色沉淀 溶液变红色 (5)不活泼 牺牲阳极法
13.(1)
编号 实验目的 碳粉/g 铁粉/g 醋酸/%
② 2.0
③ 碳粉含量的影响
(2)吸氧 (如图)
还原 2H2O+O2+4e-===4OH-
(3)反应放热,温度升高
解析 (1)对比编号①,编号②中碳粉的质量与编号①相同,醋酸的浓度与编号①不同,所以铁粉的质量应与编号①相同,即2.0 g;编号③中碳粉质量与编号①不同,铁粉质量和醋酸浓度均与编号①相同,显然编号③的目的是探究碳粉含量的影响。
(2)t2时,容器中压强明显小于起始压强,说明容器中气体减少,所以铁发生的是吸氧腐蚀。在铁发生吸氧腐蚀的过程中,铁为负极,发生氧化反应,生成Fe2+;碳为正极,发生还原反应:2H2O+O2+4e-===4OH-。
(3)O~t1时压强增大,应从两方面考虑,一是生成气体,二是温度升高,则由假设一内容可得假设二:此反应是放热反应,温度升高。
14.(1)C (2)AD (3)33.6 1 066
