2023-2024学年人教版高一化学必修一 1.2.1离子反应(第1课时)进阶训练 (含解析)
文档属性
| 名称 | 2023-2024学年人教版高一化学必修一 1.2.1离子反应(第1课时)进阶训练 (含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 11:45:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
第二节 离子反应
第1课时 电解质的电离
进阶训练A
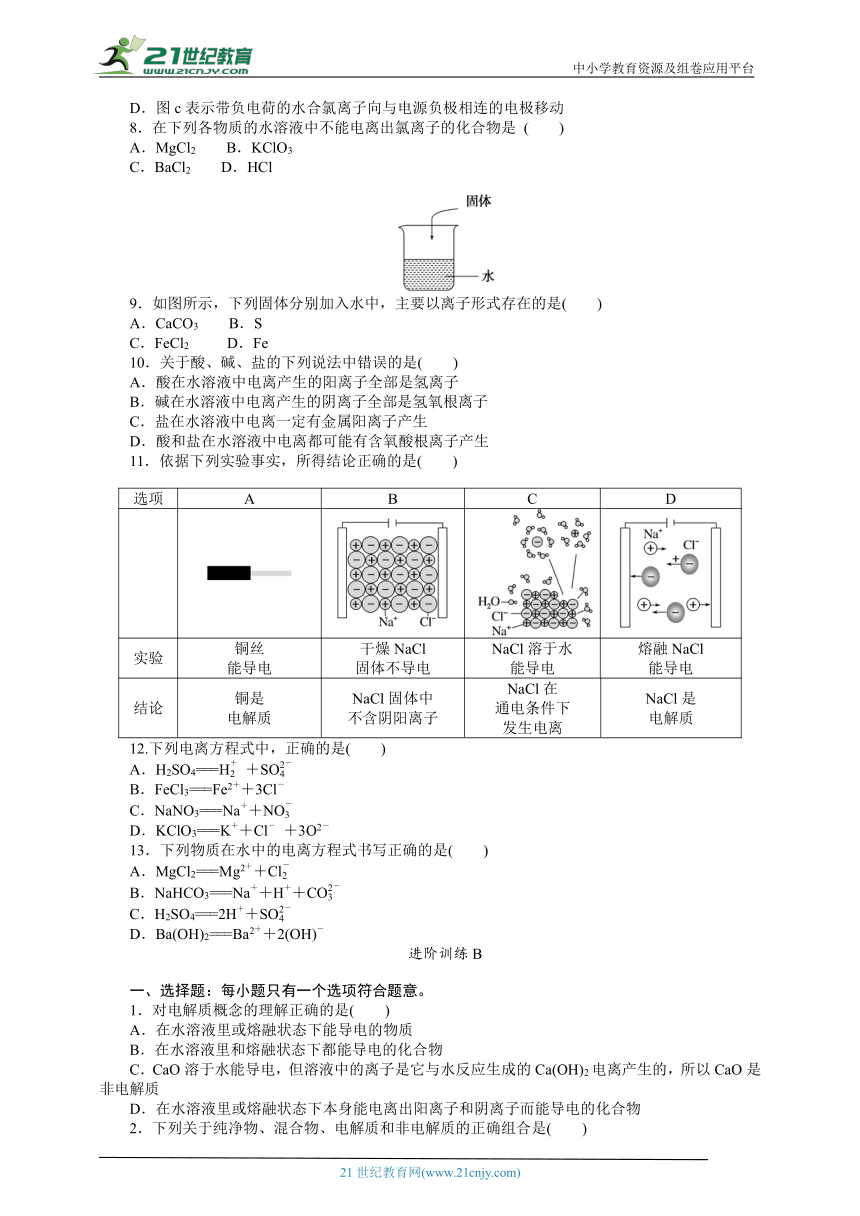
1.下列物质不能导电的是( )
A.KNO3固体 B.NaCl溶液
C.铜丝 D.熔融MgCl2
2.某小组同学进行以下导电性实验,由此得出的结论不正确的是( )
序号 ① ② ③
装置
现象 小灯泡不亮 小灯泡亮 小灯泡不亮
A.NaCl固体中不存在自由移动的Na+和Cl-
B.NaCl溶液中存在自由移动的离子,因此能导电
C.氯化钠固体溶于水后产生了自由移动的离子
D.若在②中加入适量KOH固体,小灯泡会变暗
3.下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3COOH B.K2SO4
C.SO2 D.Cl2
4.下列物质既不是电解质,又不是非电解质,但其水溶液能导电的是( )
A.乙醇 B.铁
C.碱石灰 D.二氧化碳
5.下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 混合物 电解质 非电解质
A 盐酸 冰水混合物 硫酸 干冰
B 纯净水 空气 氧化铝 二氧化硫
C 胆矾 碱石灰 铁 碳酸钙
D 臭氧 汽油 氯化铜 蔗糖
6.下列说法中正确的是( )
A.熔融的氯化氢不能导电,所以氯化氢是非电解质
B.SO2气体溶于水能导电,所以SO2是电解质
C.氯化银难溶于水,所以氯化银是非电解质
D.蔗糖溶液和熔融的蔗糖都不能导电,所以蔗糖是非电解质
7.图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极,X与电源正极相连,Y与电源负极相连)微观示意图。下列说法错误的是( )
A.图示中代表的离子是氯离子
B.图a中氯化钠固体不能导电
C.图b表示熔融的NaCl能导电
D.图c表示带负电荷的水合氯离子向与电源负极相连的电极移动
8.在下列各物质的水溶液中不能电离出氯离子的化合物是 ( )
A.MgCl2 B.KClO3
C.BaCl2 D.HCl
9.如图所示,下列固体分别加入水中,主要以离子形式存在的是( )
A.CaCO3 B.S
C.FeCl2 D.Fe
10.关于酸、碱、盐的下列说法中错误的是( )
A.酸在水溶液中电离产生的阳离子全部是氢离子
B.碱在水溶液中电离产生的阴离子全部是氢氧根离子
C.盐在水溶液中电离一定有金属阳离子产生
D.酸和盐在水溶液中电离都可能有含氧酸根离子产生
11.依据下列实验事实,所得结论正确的是( )
选项 A B C D
实验 铜丝能导电 干燥NaCl固体不导电 NaCl溶于水能导电 熔融NaCl能导电
结论 铜是电解质 NaCl固体中不含阴阳离子 NaCl在通电条件下发生电离 NaCl是电解质
12.下列电离方程式中,正确的是( )
A.H2SO4===H+SO
B.FeCl3===Fe2++3Cl-
C.NaNO3===Na++NO
D.KClO3===K++Cl- +3O2-
13.下列物质在水中的电离方程式书写正确的是( )
A.MgCl2===Mg2++Cl
B.NaHCO3===Na++H++CO
C.H2SO4===2H++SO
D.Ba(OH)2===Ba2++2(OH)-
进阶训练B
一、选择题:每小题只有一个选项符合题意。
1.对电解质概念的理解正确的是( )
A.在水溶液里或熔融状态下能导电的物质
B.在水溶液里和熔融状态下都能导电的化合物
C.CaO溶于水能导电,但溶液中的离子是它与水反应生成的Ca(OH)2电离产生的,所以CaO是非电解质
D.在水溶液里或熔融状态下本身能电离出阳离子和阴离子而能导电的化合物
2.下列关于纯净物、混合物、电解质和非电解质的正确组合是( )
纯净物 混合物 电解质 非电解质
A 浓盐酸 天然气 硫酸 干冰
B 氢氧化钡 蔗糖溶液 硫酸钡 三氧化硫
C 胆矾 石灰水 苛性钠 碳酸钙
D 硫酸 铝合金 氯化钠 氢气
3.下列说法正确的是( )
A.熔融NaCl能导电,是因为通电时NaCl发生了电离
B.NaCl固体不导电,因为NaCl固体中没有离子存在
C.NH4NO3电离时产生了NH、NO,无金属离子,所以NH4NO3不是盐
D.NaHSO4在水溶液中电离生成了Na+、H+、SO三种离子
4.下列说法中不正确的是( )
①将硫酸钡放入水中不能导电,硫酸钡是非电解质;②氨溶于水得到氨水溶液能导电,氨水是电解质;③固态氯化氢不导电,液态氯化氢可以导电;④硫酸氢钠电离出的阳离子有H+,硫酸氢钠是酸;⑤电解质放在水中一定能导电,非电解质放在水中一定不导电。
A.仅①④ B.仅①④⑤
C.仅②③ D.①②③④⑤
5.今有一种固体化合物X,X本身不导电,但熔融状态或溶于水中均能够电离,下列关于X的说法中,正确的是( )
A.X一定为电解质
B.X可能为非电解质
C.X只能是盐类
D.X只能是碱类
6.NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图所示,下列说法正确的是( )
A.该过程发生了分解反应
B.离子从固体表面脱离后不会再回到固体表面
C.水合Na+的图示不科学
D.NaCl溶于水后发生了电离,是在通电条件下进行的
7.下列关于电解质的说法正确的是( )
A.液态HCl不导电,所以HCl不是电解质
B.NH3溶于水形成的溶液能导电,所以NH3是电解质
C.SO2溶于水能导电,所以SO2是电解质
D.BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质
8.在电解质溶液中,下列叙述正确的是( )
A.阳离子和阴离子数目一定相等
B.阳离子带的正电荷总数一定和阴离子带的负电荷总数相等
C.除阴、阳离子外,溶液中不会再有其他微粒
D.电解质溶液的导电性一定很强
9.在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液或通入一种气体时,则灯泡由亮变暗至熄灭后又逐渐变亮的是( )
A.稀盐酸中逐滴加入食盐溶液
B.稀硫酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.稀硝酸中逐滴加入氢氧化钡溶液
二、非选择题
10.按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4:
________________________________________________________________________;
(NH4)2CO3:
________________________________________________________________________;
NaHCO3:
________________________________________________________________________。
(2)现有以下物质:
①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥蔗糖 ⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是________(填序号,下同);属于电解质的是________;属于非电解质的是________。
进阶训练C
1.下表是常见的几种酸、碱、盐在水溶液中电离出的离子的情况,根据表中信息分析正确的是( )
溶质 酸 盐 碱
HCl H2SO4 NaCl NaHSO4 NH4Cl NaOH NH3·H2O
电离出的离子 H+、Cl- H+、SO Na+、Cl- Na+、H+、SO NH、Cl- Na+、OH- NH、OH-
A.在水溶液中电离出H+的物质不一定是酸
B.在水溶液中电离出金属阳离子的物质一定是盐
C.盐在水溶液中电离出来的阳离子一定是金属离子
D.碱在水溶液中电离出的离子一定是金属阳离子和OH-
2.农夫山泉矿泉水标签上印有主要矿物元素含量Ca≥400、K≥35 、Mg≥50 、Na≥80等(单位:10-6 g/100 mL),则对此矿泉水的叙述正确的是( )
A.该矿泉水能导电
B.该矿泉水是非电解质
C.Ca元素在矿泉水中以Ca单质形式存在
D.该矿泉水是电解质
3.离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO的摩尔电导率分别为0.60、1.98、0.45,据此判断,向饱和的澄清石灰水中通入过量的CO2[方程式为:Ca(OH)2+CO2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2],溶液导电能力随CO2通入量的变化趋势正确的是( )
4.有以下13种物质,请回答下列问题:
①石墨 ②氧化钠 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸氢钠 ⑦氢氧化钡溶液 ⑧冰醋酸 ⑨氯化氢 ⑩硫酸铝 稀硫酸 氯化银 硫酸氢钠
(1)其中能导电的是________; 属于电解质的是________;属于非电解质的是________。
(2)写出物质⑥溶于水的电离方程式:______________________________________________。物质 属于________(填“酸”“碱”或“盐”)。
(3)写出物质⑦和 反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(4)写出物质⑥和⑨在水中发生反应的化学方程式:______________________________________________________________________________。
答案和解析
进阶训练A
1.答案:A
解析:KNO3固体为离子化合物,但固体时,阴阳离子不能自由移动,不能导电,故A符合题意;氯化钠溶液中含有自由移动氯离子和钠离子,氯化钠溶液能导电,故B不符合题意;铜丝中有自由移动的电子,能导电,故C不符合题意;熔融氯化镁中含有自由移动氯离子和镁离子,所以熔融氯化镁能导电,故D不符合题意。
2.答案:D
解析:小灯泡不亮表明在NaCl固体中不存在自由移动的Na+和Cl-,A正确;盛有NaCl溶液的小烧杯中插入电极,连接电源,小灯泡明亮,NaCl溶液中存在自由移动的离子,因此能导电,B正确;氯化钠固体不导电,溶于水后能够导电,说明NaCl固体溶于水后产生了自由移动的离子,C正确;若在②中加入适量KOH固体,KOH电离产生K+、OH-,使溶液中自由移动的离子浓度增大,因此小灯泡会变得更亮,D错误。
3.答案:C
解析:在水溶液或者熔融状态下能导电的化合物称为电解质;CH3COOH、K2SO4在水溶液中因自身电离而导电,则属于电解质;SO2能溶于水且与水反应生成亚硫酸而使溶液导电,则SO2水溶液虽然能导电但其属于非电解质;Cl2属于单质,所以既不是电解质也不是非电解质,综上所述,C符合题意。
4.答案:C
解析:电解质是在水溶液中或熔融状态下能够导电的化合物,非电解质是在水溶液中和熔融状态下都不能导电的化合物,水溶液能导电说明溶液中有能够自由移动的离子。乙醇是在水溶液中和熔融状态下都不能导电的化合物,属于非电解质,A不符合题意;Fe是单质,既不是电解质也不是非电解质,但Fe不溶于水,B不符合题意;碱石灰是CaO和NaOH的混合物,既不是电解质也不是非电解质,CaO可以和水反应生成Ca(OH)2,NaOH溶于水,能导电,C符合题意;CO2是非电解质,溶于水后生成的H2CO3是电解质,D不符合题意。
5.答案:D
解析:盐酸是氯化氢的水溶液,属于混合物,冰水混合物是H2O,是纯净物,A项错误;纯净水不是纯净物,是混合物;空气是氧气、氮气、二氧化碳等气体组成的混合物,B项错误;碱石灰是主要成分为氧化钙、氢氧化钠等组成的混合物,铁是单质,既不是电解质也不是非电解质,碳酸钙是电解质,C项错误;臭氧为O3,是纯净物,汽油是混合物,氯化铜是电解质,蔗糖是非电解质,D项正确。
6.答案:D
解析:氯化氢气体不能导电,但其水溶液中有自由移动的氯离子和氢离子能够导电,所以氯化氢为电解质,A项错误;SO2常温下为气体,只有SO2分子,没有自由移动的离子,虽SO2在水溶液中与水反应,生成亚硫酸,亚硫酸电离出自由移动的离子,溶液能够导电,但自由移动的离子不是SO2自身电离,SO2是化合物,所以SO2是非电解质,B项错误;化合物为电解质还是非电解质与化合物的溶解性没有关系,氯化银虽难溶于水,但溶解的部分在溶液中却能完全电离,故氯化银为电解质,且为强电解质,C项错误;蔗糖在溶液中以分子形式存在,不能电离,则蔗糖溶液不能导电,蔗糖在熔融状态也不导电,所以蔗糖是非电解质,D项正确。
7.答案:D
解析:X与正极相连,阴离子向此极移动,故图中 INCLUDEPICTURE "../../2022精品模板%20(课件%20教案%20试卷)/23化学人必一L21.tif" \* MERGEFORMAT INCLUDEPICTURE "D:\\23试吧人教化学必修第一册(成书)\\新建文件夹\\23化学人必一L21.tif" \* MERGEFORMATINET INCLUDEPICTURE "23化学人必一L21.tif" \* MERGEFORMAT 代表的离子是氯离子,故A正确;由图a可知干燥的NaCl固体中钠离子和氯离子不能自由移动,因此NaCl固体不能导电,故B正确;由图b可知熔融状态下钠离子和氯离子能自由移动,因此熔融的NaCl能导电,故C正确; INCLUDEPICTURE "../../2022精品模板%20(课件%20教案%20试卷)/23化学人必一L21.tif" \* MERGEFORMAT INCLUDEPICTURE "D:\\23试吧人教化学必修第一册(成书)\\新建文件夹\\23化学人必一L21.tif" \* MERGEFORMATINET INCLUDEPICTURE "23化学人必一L21.tif" \* MERGEFORMAT 表示氯离子,由图c可知带负电荷的水合氯离子向X电极移动,即向与电源正极相连的电极移动,故D错误。
8.答案:B
解析:A选项电离方程式:MgCl2===Mg2++2Cl-;B选项电离方程式:KClO3===K++ClO;C选项电离方程式:BaCl2===Ba2++2Cl-;D选项电离方程式:HCl===H++Cl-。
9.答案:C
解析:CaCO3难溶于水,主要以固体形式存在,A不符合题意;S不溶于水,主要以固体形式存在,B不符合题意;FeCl2是可溶性盐,溶于水电离产生Fe2+、Cl-,以离子形式存在,C符合题意;Fe是金属单质,不能与水反应,难溶于水,以固体存在,D不符合题意。
10.答案:C
解析:电离出的阳离子全部是氢离子的化合物为酸,故A正确;电离出的阴离子全部是氢氧根的化合物为碱,故B正确;阳离子是金属离子或铵根离子、阴离子一定有酸根离子的化合物为盐,故盐电离出的阳离子不一定是金属离子,也可能是铵根离子,故C错误;酸和盐在水溶液中电离都可能有含氧酸根离子产生,如H2SO4和Na2CO3在水溶液中均电离出含氧酸根离子,故D正确。
11.答案:D
解析:铜丝能导电,但铜为单质,不是电解质,故A错误; 干燥NaCl固体不导电,是由于钠离子和氯离子不能自由移动,故B错误;NaCl溶于水能导电,是由于NaCl在水分子作用下发生电离,故C错误;熔融NaCl能导电,且NaCl是化合物,所以NaCl是电解质,故D正确。
12.答案:C
解析:H2SO4为强电解质,电离方程式H2SO4===2H++SO,A错误;FeCl3在水溶液中完全电离,电离方程式为:FeCl3===Fe3++3Cl-,B错误;NaNO3在水溶液里完全电离,电离方程式为:NaNO3===Na++NO,C正确;KClO3的电离方程式为:KClO3===K++ClO,D错误。
13.答案:C
解析:氯化镁完全电离出镁离子和氯离子:MgCl2===Mg2++2Cl-,A错误;碳酸氢钠是弱酸的酸式盐,完全电离出钠离子和碳酸氢根离子:NaHCO3===Na++HCO,B错误;硫酸是二元强酸,H2SO4===2H++SO,C正确;氢氧化钡是二元强碱,完全电离出氢氧根离子和钡离子:Ba(OH)2===Ba2++2OH-,D错误。
进阶训练B
1.答案:D
解析:在水溶液里或熔融状态下因自身电离出离子而能导电的化合物叫做电解质,D项的理解是正确的;A项,Cl2和NH3的水溶液都能导电,但它们都不是电解质;B项,酸在熔融状态下不导电,但它们是电解质;C项,CaO在熔融状态下因电离出Ca2+和O2-能导电,属于电解质。
2.答案:B
解析:A项,浓盐酸是HCl的水溶液,属于混合物;C项,碳酸钙属于电解质;D项,氢气既不是电解质也不是非电解质。
3.答案:D
解析:熔融NaCl能电离出自由移动的Na+和Cl-,电离与电流无关,不是因为通电NaCl才发生电离的,A错误;氯化钠固体不导电是因为NaCl固体中带电的阴阳离子不能自由移动,B错误;由金属阳离子或铵根离子和酸根离子构成的纯净物是盐,硝酸铵是由铵根离子和酸根离子构成的纯净物,属于盐,C错误;硫酸氢钠在水溶液中完全电离出三种离子,其电离方程式为NaHSO4===Na++H++SO,D正确。
4.答案:D
解析:将硫酸钡放入水中不能导电,是因为溶液中离子浓度太小,溶于水的硫酸钡能完全电离出离子,硫酸钡是电解质,①错误;氨溶于水得到的氨水溶液能导电,是因为生成的一水合氨电离出离子,一水合氨是电解质,氨气是非电解质,氨水是混合物,不是电解质,也不是非电解质,②错误;固态氯化氢不导电,液态氯化氢,也不导电,氯化氢溶于水可以导电,③错误;硫酸氢钠溶于水电离出的阳离子有钠离子和H+,硫酸氢钠是酸式盐,不是酸,④错误;电解质放在水中不一定能导电,例如难溶性电解质,非电解质放在水中也可能导电,例如氨气溶于水,⑤错误。
5.答案:A
解析:说明该物质在溶于水或熔融状态下能电离出离子而导电,一定是电解质,且该物质是离子化合物,A正确、B错误;X是离子化合物,可以是碱或者是盐,C错误、D错误。
6.答案:C
解析:该过程只有化学键的断裂,并没有新化学键的形成,不属于化学变化,更不是分解反应,故A错误;该过程中存在两个过程:一方面在水分子作用下钠离子和氯离子脱离氯化钠的表面溶入水中,另一方面溶液中钠离子和氯离子受氯化钠表面阴、阳离子的吸引回到氯化钠的表面,最终会出现动态平衡NaCl(s) Na+(aq)+Cl-(aq),离子从固体表面脱离后会回到固体表面,故B错误;钠离子带正电荷,形成水合离子时应该是水中带负电的氧原子靠近钠离子,即图示错误,故C正确;NaCl溶于水后在水分子的作用下离子键断裂,形成水合离子,并不需要通电,故D错误。
7.答案:D
解析:液态HCl不导电,但氯化氢溶于水能电离出自由移动的氢离子和氯离子,能导电,所以HCl是电解质,选项A错误;NH3溶于水形成的溶液能导电,但氨气自身不能电离,故NH3是非电解质,选项B错误;二氧化硫的水溶液能导电,电离出自由移动阴阳离子的物质是亚硫酸而不是二氧化硫,二氧化硫是非电解质,选项C错误;BaSO4 难溶于水,导电性差,但由于它的溶解度太小,测不出(或难测)其水溶液的导电性,但它溶解的部分是完全电离的,所以是电解质,选项D正确。
8.答案:B
解析:电解质溶液是呈电中性的,阴、阳离子所带电荷总数一定相等,但它们个数不一定相等,A错误,B正确;除阴、阳离子外,溶液中还有水分子等,C错误;溶液的导电性是由自由移动的离子和离子所带电荷数决定的,若电解质溶液的浓度很小,溶液的导电性也可能很弱,D错误。
9.答案:C
解析:稀盐酸和NaCl溶液不反应,溶液中离子浓度不可能为0,灯泡不可能熄灭,选项A错误;稀硫酸中加入氢氧化钠溶液,二者反应生成硫酸钠和水,溶液中离子浓度不可能为0,灯泡不可能熄灭,选项B错误;饱和石灰水中通入二氧化碳,先生成碳酸钙沉淀和水,当二者恰好完全反应生成碳酸钙时,此时离子浓度几乎为0,灯泡熄灭,继续通入二氧化碳后,二氧化碳和碳酸钙、水反应生成可溶性的碳酸氢钙,溶液中离子浓度增大,灯泡变亮,选项C正确;稀硝酸中加入氢氧化钡,二者反应生成硝酸钡和水,溶液中离子浓度不可能为0,灯泡不可能熄灭,选项D错误。
10.答案:(1)NaHSO4===Na++H++SO
(NH4)2CO3===2NH+CO
NaHCO3===Na++HCO
(2)①④⑨ ③⑤⑦⑧ ②⑥⑩
解析:(1) 硫酸为强酸,NaHSO4电离方程式为:
NaHSO4===Na++H++SO;
(NH4)2CO3为盐,电离方程式为:
(NH4)2CO3===2NH+CO;
碳酸为弱酸, NaHCO3电离方程式为:
NaHCO3===Na++HCO;
(2)①NaCl溶液,存在自由移动的离子,能导电,但是是混合物,所以既不是电解质也不是非电解质;②干冰,无自由移动的离子或电子,不能导电,是非电解质;③液态HCl,无自由移动的离子或电子,不能导电,但在水溶液中能导电,是电解质;④铜有自由移动的电子,能导电,属于单质,既不是电解质也不是非电解质;⑤BaSO4固体,有离子,但是离子不能自由移动,不能导电,是电解质;⑥蔗糖,无自由移动的离子或电子,不能导电,是非电解质;⑦Na2O,有离子,但是离子不能自由移动,不能导电,是电解质;⑧NaOH固体,有离子,但是离子不能自由移动,不能导电,是电解质;⑨盐酸,存在自由移动的离子,能导电,但是是混合物,所以既不是电解质也不是非电解质;⑩NH3,无自由移动的离子或电子,不能导电,是非电解质;其中能够导电的是①④⑨;属于电解质的是③⑤⑦⑧;属于非电解质的是②⑥⑩。
进阶训练C
1.答案:A
解析:由表中NaHSO4的物质类别属于盐,在水溶液中解离出来的离子有H+,但不属于酸,故A正确;在水溶液中电离出金属阳离子的物质不一定是盐,可能是碱,故B错误;在NH4Cl的盐溶液中解离出来的阳离子为NH,而不是金属离子,故C错误;由表中信息可知在一水合氨中解离成的离子为NH和OH-,则碱溶液解离出的离子一定有金属阳离子的说法错误,故D错误。
2.答案:A
解析:根据信息,矿泉水中含有电解质,即该矿泉水能够导电,故A正确;矿泉水属于混合物,非电解质属于化合物,故B错误;因为Ca元素以离子的形式存在,故C错误;矿泉水属于混合物,电解质属于化合物,故D错误。
3.答案:D
解析:向澄清石灰水中通入过量的CO2,先生成碳酸钙沉淀,钙离子、氢氧根离子浓度在减少,溶液导电能力减弱,后沉淀溶解生成碳酸氢钙溶液,钙离子、碳酸氢根离子的浓度在增大,钙离子的浓度与原来相等,碳酸氢根离子的浓度与原来氢氧根离子浓度相等,但OH-的摩尔导电率大于HCO的摩尔电导率,所以最后溶液的导电性小于原来,最后不变;D符合题意。
4.答案:(1)①④⑦ ②⑥⑧⑨⑩ ③⑤
(2)NaHCO3===Na++HCO 盐
(3)Ba(OH)2+H2SO4===BaSO4↓+2H2O
(4)NaHCO3+ HCl===NaCl+H2O+CO2↑
解析:(1)①石墨存在自由移动的电子,可以导电;石墨是单质,既不是电解质也不是非电解质;②氧化钠固体没有自由移动的带电微粒,不可以导电;在熔融状态下可以导电,属于电解质;③酒精中没有自由移动的带电微粒,不能导电;在水溶液和熔融状态不能导电属于非电解质;④氨水中含有自由移动的铵根离子和氢氧根离子,可以导电,但氨水是混合物,既不是电解质也不是非电解质;⑤二氧化碳中没有自由移动的带电微粒,不能导电;在水溶液中导电是因为生成了碳酸,在熔融状态不能导电属于非电解质;⑥碳酸氢钠固体没有自由移动的带电微粒,不可以导电,在水溶液中可以电离出钠离子和碳酸氢根离子,可以导电,属于电解质;⑦氢氧化钡溶液中含有自由移动的钡离子和氢氧根离子,可以导电,氢氧化钡溶液属于混合物,既不是电解质,也不是非电解质;⑧冰醋酸中没有自由移动的带电微粒,不能导电,冰醋酸的水溶液中含有自由移动的氢离子和醋酸根离子,可以导电,故冰醋酸属于电解质;⑨氯化氢中没有自由移动的带电微粒,不能导电,氯化氢的水溶液盐酸中含有自由移动的氢离子和氯离子,可以导电,故氯化氢为电解质;⑩硫酸铝固体中没有自由移动的带电微粒,不能导电;硫酸铝在水溶液和熔融状态下有自由移动的铝离子和硫酸根离子,可以导电,故硫酸铝属于电解质; 稀硫酸中含有自由移动的氢离子和硫酸根离子,可以导电;稀硫酸属于混合物,既不是电解质也不是非电解质; 氯化银中没有自由移动的带电微粒,不能导电,氯化银在水溶液和熔融状态下可以提供自由移动的离子,属于电解质; 硫酸氢钠中没有自由移动的带电微粒,不能导电,在水溶液中可以完全电离出Na+、H+、SO和熔融状态下可以完全电离出Na+和HSO,可以导电,故硫酸氢钠属于电解质;其中能导电的是 ①④⑦ ;属于电解质的是②⑥⑧⑨⑩ ;属于非电解质的是③⑤;
(2)碳酸氢钠属于弱酸的酸式盐,溶于水电离出钠离子和碳酸氢根离子,电离方程式为:NaHCO3===Na++HCO;属于盐;
(3)氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,反应的化学方程式:Ba (OH )2+H2SO4===BaSO4↓+2H2O;
(4)碳酸氢钠和盐酸反应生成氯化钠、水、二氧化碳,化学方程式为:NaHCO3+HCl===NaCl+H2O+CO2↑。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
第二节 离子反应
第1课时 电解质的电离
进阶训练A
1.下列物质不能导电的是( )
A.KNO3固体 B.NaCl溶液
C.铜丝 D.熔融MgCl2
2.某小组同学进行以下导电性实验,由此得出的结论不正确的是( )
序号 ① ② ③
装置
现象 小灯泡不亮 小灯泡亮 小灯泡不亮
A.NaCl固体中不存在自由移动的Na+和Cl-
B.NaCl溶液中存在自由移动的离子,因此能导电
C.氯化钠固体溶于水后产生了自由移动的离子
D.若在②中加入适量KOH固体,小灯泡会变暗
3.下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3COOH B.K2SO4
C.SO2 D.Cl2
4.下列物质既不是电解质,又不是非电解质,但其水溶液能导电的是( )
A.乙醇 B.铁
C.碱石灰 D.二氧化碳
5.下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 混合物 电解质 非电解质
A 盐酸 冰水混合物 硫酸 干冰
B 纯净水 空气 氧化铝 二氧化硫
C 胆矾 碱石灰 铁 碳酸钙
D 臭氧 汽油 氯化铜 蔗糖
6.下列说法中正确的是( )
A.熔融的氯化氢不能导电,所以氯化氢是非电解质
B.SO2气体溶于水能导电,所以SO2是电解质
C.氯化银难溶于水,所以氯化银是非电解质
D.蔗糖溶液和熔融的蔗糖都不能导电,所以蔗糖是非电解质
7.图a~c分别为氯化钠在不同状态下的导电实验(X、Y均表示石墨电极,X与电源正极相连,Y与电源负极相连)微观示意图。下列说法错误的是( )
A.图示中代表的离子是氯离子
B.图a中氯化钠固体不能导电
C.图b表示熔融的NaCl能导电
D.图c表示带负电荷的水合氯离子向与电源负极相连的电极移动
8.在下列各物质的水溶液中不能电离出氯离子的化合物是 ( )
A.MgCl2 B.KClO3
C.BaCl2 D.HCl
9.如图所示,下列固体分别加入水中,主要以离子形式存在的是( )
A.CaCO3 B.S
C.FeCl2 D.Fe
10.关于酸、碱、盐的下列说法中错误的是( )
A.酸在水溶液中电离产生的阳离子全部是氢离子
B.碱在水溶液中电离产生的阴离子全部是氢氧根离子
C.盐在水溶液中电离一定有金属阳离子产生
D.酸和盐在水溶液中电离都可能有含氧酸根离子产生
11.依据下列实验事实,所得结论正确的是( )
选项 A B C D
实验 铜丝能导电 干燥NaCl固体不导电 NaCl溶于水能导电 熔融NaCl能导电
结论 铜是电解质 NaCl固体中不含阴阳离子 NaCl在通电条件下发生电离 NaCl是电解质
12.下列电离方程式中,正确的是( )
A.H2SO4===H+SO
B.FeCl3===Fe2++3Cl-
C.NaNO3===Na++NO
D.KClO3===K++Cl- +3O2-
13.下列物质在水中的电离方程式书写正确的是( )
A.MgCl2===Mg2++Cl
B.NaHCO3===Na++H++CO
C.H2SO4===2H++SO
D.Ba(OH)2===Ba2++2(OH)-
进阶训练B
一、选择题:每小题只有一个选项符合题意。
1.对电解质概念的理解正确的是( )
A.在水溶液里或熔融状态下能导电的物质
B.在水溶液里和熔融状态下都能导电的化合物
C.CaO溶于水能导电,但溶液中的离子是它与水反应生成的Ca(OH)2电离产生的,所以CaO是非电解质
D.在水溶液里或熔融状态下本身能电离出阳离子和阴离子而能导电的化合物
2.下列关于纯净物、混合物、电解质和非电解质的正确组合是( )
纯净物 混合物 电解质 非电解质
A 浓盐酸 天然气 硫酸 干冰
B 氢氧化钡 蔗糖溶液 硫酸钡 三氧化硫
C 胆矾 石灰水 苛性钠 碳酸钙
D 硫酸 铝合金 氯化钠 氢气
3.下列说法正确的是( )
A.熔融NaCl能导电,是因为通电时NaCl发生了电离
B.NaCl固体不导电,因为NaCl固体中没有离子存在
C.NH4NO3电离时产生了NH、NO,无金属离子,所以NH4NO3不是盐
D.NaHSO4在水溶液中电离生成了Na+、H+、SO三种离子
4.下列说法中不正确的是( )
①将硫酸钡放入水中不能导电,硫酸钡是非电解质;②氨溶于水得到氨水溶液能导电,氨水是电解质;③固态氯化氢不导电,液态氯化氢可以导电;④硫酸氢钠电离出的阳离子有H+,硫酸氢钠是酸;⑤电解质放在水中一定能导电,非电解质放在水中一定不导电。
A.仅①④ B.仅①④⑤
C.仅②③ D.①②③④⑤
5.今有一种固体化合物X,X本身不导电,但熔融状态或溶于水中均能够电离,下列关于X的说法中,正确的是( )
A.X一定为电解质
B.X可能为非电解质
C.X只能是盐类
D.X只能是碱类
6.NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图所示,下列说法正确的是( )
A.该过程发生了分解反应
B.离子从固体表面脱离后不会再回到固体表面
C.水合Na+的图示不科学
D.NaCl溶于水后发生了电离,是在通电条件下进行的
7.下列关于电解质的说法正确的是( )
A.液态HCl不导电,所以HCl不是电解质
B.NH3溶于水形成的溶液能导电,所以NH3是电解质
C.SO2溶于水能导电,所以SO2是电解质
D.BaSO4在水溶液中难导电,但熔融状态下能导电,所以BaSO4是电解质
8.在电解质溶液中,下列叙述正确的是( )
A.阳离子和阴离子数目一定相等
B.阳离子带的正电荷总数一定和阴离子带的负电荷总数相等
C.除阴、阳离子外,溶液中不会再有其他微粒
D.电解质溶液的导电性一定很强
9.在如图所示电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液或通入一种气体时,则灯泡由亮变暗至熄灭后又逐渐变亮的是( )
A.稀盐酸中逐滴加入食盐溶液
B.稀硫酸中逐滴加入氢氧化钠溶液
C.饱和石灰水中不断通入CO2
D.稀硝酸中逐滴加入氢氧化钡溶液
二、非选择题
10.按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4:
________________________________________________________________________;
(NH4)2CO3:
________________________________________________________________________;
NaHCO3:
________________________________________________________________________。
(2)现有以下物质:
①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥蔗糖 ⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是________(填序号,下同);属于电解质的是________;属于非电解质的是________。
进阶训练C
1.下表是常见的几种酸、碱、盐在水溶液中电离出的离子的情况,根据表中信息分析正确的是( )
溶质 酸 盐 碱
HCl H2SO4 NaCl NaHSO4 NH4Cl NaOH NH3·H2O
电离出的离子 H+、Cl- H+、SO Na+、Cl- Na+、H+、SO NH、Cl- Na+、OH- NH、OH-
A.在水溶液中电离出H+的物质不一定是酸
B.在水溶液中电离出金属阳离子的物质一定是盐
C.盐在水溶液中电离出来的阳离子一定是金属离子
D.碱在水溶液中电离出的离子一定是金属阳离子和OH-
2.农夫山泉矿泉水标签上印有主要矿物元素含量Ca≥400、K≥35 、Mg≥50 、Na≥80等(单位:10-6 g/100 mL),则对此矿泉水的叙述正确的是( )
A.该矿泉水能导电
B.该矿泉水是非电解质
C.Ca元素在矿泉水中以Ca单质形式存在
D.该矿泉水是电解质
3.离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO的摩尔电导率分别为0.60、1.98、0.45,据此判断,向饱和的澄清石灰水中通入过量的CO2[方程式为:Ca(OH)2+CO2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2],溶液导电能力随CO2通入量的变化趋势正确的是( )
4.有以下13种物质,请回答下列问题:
①石墨 ②氧化钠 ③酒精 ④氨水 ⑤二氧化碳 ⑥碳酸氢钠 ⑦氢氧化钡溶液 ⑧冰醋酸 ⑨氯化氢 ⑩硫酸铝 稀硫酸 氯化银 硫酸氢钠
(1)其中能导电的是________; 属于电解质的是________;属于非电解质的是________。
(2)写出物质⑥溶于水的电离方程式:______________________________________________。物质 属于________(填“酸”“碱”或“盐”)。
(3)写出物质⑦和 反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
(4)写出物质⑥和⑨在水中发生反应的化学方程式:______________________________________________________________________________。
答案和解析
进阶训练A
1.答案:A
解析:KNO3固体为离子化合物,但固体时,阴阳离子不能自由移动,不能导电,故A符合题意;氯化钠溶液中含有自由移动氯离子和钠离子,氯化钠溶液能导电,故B不符合题意;铜丝中有自由移动的电子,能导电,故C不符合题意;熔融氯化镁中含有自由移动氯离子和镁离子,所以熔融氯化镁能导电,故D不符合题意。
2.答案:D
解析:小灯泡不亮表明在NaCl固体中不存在自由移动的Na+和Cl-,A正确;盛有NaCl溶液的小烧杯中插入电极,连接电源,小灯泡明亮,NaCl溶液中存在自由移动的离子,因此能导电,B正确;氯化钠固体不导电,溶于水后能够导电,说明NaCl固体溶于水后产生了自由移动的离子,C正确;若在②中加入适量KOH固体,KOH电离产生K+、OH-,使溶液中自由移动的离子浓度增大,因此小灯泡会变得更亮,D错误。
3.答案:C
解析:在水溶液或者熔融状态下能导电的化合物称为电解质;CH3COOH、K2SO4在水溶液中因自身电离而导电,则属于电解质;SO2能溶于水且与水反应生成亚硫酸而使溶液导电,则SO2水溶液虽然能导电但其属于非电解质;Cl2属于单质,所以既不是电解质也不是非电解质,综上所述,C符合题意。
4.答案:C
解析:电解质是在水溶液中或熔融状态下能够导电的化合物,非电解质是在水溶液中和熔融状态下都不能导电的化合物,水溶液能导电说明溶液中有能够自由移动的离子。乙醇是在水溶液中和熔融状态下都不能导电的化合物,属于非电解质,A不符合题意;Fe是单质,既不是电解质也不是非电解质,但Fe不溶于水,B不符合题意;碱石灰是CaO和NaOH的混合物,既不是电解质也不是非电解质,CaO可以和水反应生成Ca(OH)2,NaOH溶于水,能导电,C符合题意;CO2是非电解质,溶于水后生成的H2CO3是电解质,D不符合题意。
5.答案:D
解析:盐酸是氯化氢的水溶液,属于混合物,冰水混合物是H2O,是纯净物,A项错误;纯净水不是纯净物,是混合物;空气是氧气、氮气、二氧化碳等气体组成的混合物,B项错误;碱石灰是主要成分为氧化钙、氢氧化钠等组成的混合物,铁是单质,既不是电解质也不是非电解质,碳酸钙是电解质,C项错误;臭氧为O3,是纯净物,汽油是混合物,氯化铜是电解质,蔗糖是非电解质,D项正确。
6.答案:D
解析:氯化氢气体不能导电,但其水溶液中有自由移动的氯离子和氢离子能够导电,所以氯化氢为电解质,A项错误;SO2常温下为气体,只有SO2分子,没有自由移动的离子,虽SO2在水溶液中与水反应,生成亚硫酸,亚硫酸电离出自由移动的离子,溶液能够导电,但自由移动的离子不是SO2自身电离,SO2是化合物,所以SO2是非电解质,B项错误;化合物为电解质还是非电解质与化合物的溶解性没有关系,氯化银虽难溶于水,但溶解的部分在溶液中却能完全电离,故氯化银为电解质,且为强电解质,C项错误;蔗糖在溶液中以分子形式存在,不能电离,则蔗糖溶液不能导电,蔗糖在熔融状态也不导电,所以蔗糖是非电解质,D项正确。
7.答案:D
解析:X与正极相连,阴离子向此极移动,故图中 INCLUDEPICTURE "../../2022精品模板%20(课件%20教案%20试卷)/23化学人必一L21.tif" \* MERGEFORMAT INCLUDEPICTURE "D:\\23试吧人教化学必修第一册(成书)\\新建文件夹\\23化学人必一L21.tif" \* MERGEFORMATINET INCLUDEPICTURE "23化学人必一L21.tif" \* MERGEFORMAT 代表的离子是氯离子,故A正确;由图a可知干燥的NaCl固体中钠离子和氯离子不能自由移动,因此NaCl固体不能导电,故B正确;由图b可知熔融状态下钠离子和氯离子能自由移动,因此熔融的NaCl能导电,故C正确; INCLUDEPICTURE "../../2022精品模板%20(课件%20教案%20试卷)/23化学人必一L21.tif" \* MERGEFORMAT INCLUDEPICTURE "D:\\23试吧人教化学必修第一册(成书)\\新建文件夹\\23化学人必一L21.tif" \* MERGEFORMATINET INCLUDEPICTURE "23化学人必一L21.tif" \* MERGEFORMAT 表示氯离子,由图c可知带负电荷的水合氯离子向X电极移动,即向与电源正极相连的电极移动,故D错误。
8.答案:B
解析:A选项电离方程式:MgCl2===Mg2++2Cl-;B选项电离方程式:KClO3===K++ClO;C选项电离方程式:BaCl2===Ba2++2Cl-;D选项电离方程式:HCl===H++Cl-。
9.答案:C
解析:CaCO3难溶于水,主要以固体形式存在,A不符合题意;S不溶于水,主要以固体形式存在,B不符合题意;FeCl2是可溶性盐,溶于水电离产生Fe2+、Cl-,以离子形式存在,C符合题意;Fe是金属单质,不能与水反应,难溶于水,以固体存在,D不符合题意。
10.答案:C
解析:电离出的阳离子全部是氢离子的化合物为酸,故A正确;电离出的阴离子全部是氢氧根的化合物为碱,故B正确;阳离子是金属离子或铵根离子、阴离子一定有酸根离子的化合物为盐,故盐电离出的阳离子不一定是金属离子,也可能是铵根离子,故C错误;酸和盐在水溶液中电离都可能有含氧酸根离子产生,如H2SO4和Na2CO3在水溶液中均电离出含氧酸根离子,故D正确。
11.答案:D
解析:铜丝能导电,但铜为单质,不是电解质,故A错误; 干燥NaCl固体不导电,是由于钠离子和氯离子不能自由移动,故B错误;NaCl溶于水能导电,是由于NaCl在水分子作用下发生电离,故C错误;熔融NaCl能导电,且NaCl是化合物,所以NaCl是电解质,故D正确。
12.答案:C
解析:H2SO4为强电解质,电离方程式H2SO4===2H++SO,A错误;FeCl3在水溶液中完全电离,电离方程式为:FeCl3===Fe3++3Cl-,B错误;NaNO3在水溶液里完全电离,电离方程式为:NaNO3===Na++NO,C正确;KClO3的电离方程式为:KClO3===K++ClO,D错误。
13.答案:C
解析:氯化镁完全电离出镁离子和氯离子:MgCl2===Mg2++2Cl-,A错误;碳酸氢钠是弱酸的酸式盐,完全电离出钠离子和碳酸氢根离子:NaHCO3===Na++HCO,B错误;硫酸是二元强酸,H2SO4===2H++SO,C正确;氢氧化钡是二元强碱,完全电离出氢氧根离子和钡离子:Ba(OH)2===Ba2++2OH-,D错误。
进阶训练B
1.答案:D
解析:在水溶液里或熔融状态下因自身电离出离子而能导电的化合物叫做电解质,D项的理解是正确的;A项,Cl2和NH3的水溶液都能导电,但它们都不是电解质;B项,酸在熔融状态下不导电,但它们是电解质;C项,CaO在熔融状态下因电离出Ca2+和O2-能导电,属于电解质。
2.答案:B
解析:A项,浓盐酸是HCl的水溶液,属于混合物;C项,碳酸钙属于电解质;D项,氢气既不是电解质也不是非电解质。
3.答案:D
解析:熔融NaCl能电离出自由移动的Na+和Cl-,电离与电流无关,不是因为通电NaCl才发生电离的,A错误;氯化钠固体不导电是因为NaCl固体中带电的阴阳离子不能自由移动,B错误;由金属阳离子或铵根离子和酸根离子构成的纯净物是盐,硝酸铵是由铵根离子和酸根离子构成的纯净物,属于盐,C错误;硫酸氢钠在水溶液中完全电离出三种离子,其电离方程式为NaHSO4===Na++H++SO,D正确。
4.答案:D
解析:将硫酸钡放入水中不能导电,是因为溶液中离子浓度太小,溶于水的硫酸钡能完全电离出离子,硫酸钡是电解质,①错误;氨溶于水得到的氨水溶液能导电,是因为生成的一水合氨电离出离子,一水合氨是电解质,氨气是非电解质,氨水是混合物,不是电解质,也不是非电解质,②错误;固态氯化氢不导电,液态氯化氢,也不导电,氯化氢溶于水可以导电,③错误;硫酸氢钠溶于水电离出的阳离子有钠离子和H+,硫酸氢钠是酸式盐,不是酸,④错误;电解质放在水中不一定能导电,例如难溶性电解质,非电解质放在水中也可能导电,例如氨气溶于水,⑤错误。
5.答案:A
解析:说明该物质在溶于水或熔融状态下能电离出离子而导电,一定是电解质,且该物质是离子化合物,A正确、B错误;X是离子化合物,可以是碱或者是盐,C错误、D错误。
6.答案:C
解析:该过程只有化学键的断裂,并没有新化学键的形成,不属于化学变化,更不是分解反应,故A错误;该过程中存在两个过程:一方面在水分子作用下钠离子和氯离子脱离氯化钠的表面溶入水中,另一方面溶液中钠离子和氯离子受氯化钠表面阴、阳离子的吸引回到氯化钠的表面,最终会出现动态平衡NaCl(s) Na+(aq)+Cl-(aq),离子从固体表面脱离后会回到固体表面,故B错误;钠离子带正电荷,形成水合离子时应该是水中带负电的氧原子靠近钠离子,即图示错误,故C正确;NaCl溶于水后在水分子的作用下离子键断裂,形成水合离子,并不需要通电,故D错误。
7.答案:D
解析:液态HCl不导电,但氯化氢溶于水能电离出自由移动的氢离子和氯离子,能导电,所以HCl是电解质,选项A错误;NH3溶于水形成的溶液能导电,但氨气自身不能电离,故NH3是非电解质,选项B错误;二氧化硫的水溶液能导电,电离出自由移动阴阳离子的物质是亚硫酸而不是二氧化硫,二氧化硫是非电解质,选项C错误;BaSO4 难溶于水,导电性差,但由于它的溶解度太小,测不出(或难测)其水溶液的导电性,但它溶解的部分是完全电离的,所以是电解质,选项D正确。
8.答案:B
解析:电解质溶液是呈电中性的,阴、阳离子所带电荷总数一定相等,但它们个数不一定相等,A错误,B正确;除阴、阳离子外,溶液中还有水分子等,C错误;溶液的导电性是由自由移动的离子和离子所带电荷数决定的,若电解质溶液的浓度很小,溶液的导电性也可能很弱,D错误。
9.答案:C
解析:稀盐酸和NaCl溶液不反应,溶液中离子浓度不可能为0,灯泡不可能熄灭,选项A错误;稀硫酸中加入氢氧化钠溶液,二者反应生成硫酸钠和水,溶液中离子浓度不可能为0,灯泡不可能熄灭,选项B错误;饱和石灰水中通入二氧化碳,先生成碳酸钙沉淀和水,当二者恰好完全反应生成碳酸钙时,此时离子浓度几乎为0,灯泡熄灭,继续通入二氧化碳后,二氧化碳和碳酸钙、水反应生成可溶性的碳酸氢钙,溶液中离子浓度增大,灯泡变亮,选项C正确;稀硝酸中加入氢氧化钡,二者反应生成硝酸钡和水,溶液中离子浓度不可能为0,灯泡不可能熄灭,选项D错误。
10.答案:(1)NaHSO4===Na++H++SO
(NH4)2CO3===2NH+CO
NaHCO3===Na++HCO
(2)①④⑨ ③⑤⑦⑧ ②⑥⑩
解析:(1) 硫酸为强酸,NaHSO4电离方程式为:
NaHSO4===Na++H++SO;
(NH4)2CO3为盐,电离方程式为:
(NH4)2CO3===2NH+CO;
碳酸为弱酸, NaHCO3电离方程式为:
NaHCO3===Na++HCO;
(2)①NaCl溶液,存在自由移动的离子,能导电,但是是混合物,所以既不是电解质也不是非电解质;②干冰,无自由移动的离子或电子,不能导电,是非电解质;③液态HCl,无自由移动的离子或电子,不能导电,但在水溶液中能导电,是电解质;④铜有自由移动的电子,能导电,属于单质,既不是电解质也不是非电解质;⑤BaSO4固体,有离子,但是离子不能自由移动,不能导电,是电解质;⑥蔗糖,无自由移动的离子或电子,不能导电,是非电解质;⑦Na2O,有离子,但是离子不能自由移动,不能导电,是电解质;⑧NaOH固体,有离子,但是离子不能自由移动,不能导电,是电解质;⑨盐酸,存在自由移动的离子,能导电,但是是混合物,所以既不是电解质也不是非电解质;⑩NH3,无自由移动的离子或电子,不能导电,是非电解质;其中能够导电的是①④⑨;属于电解质的是③⑤⑦⑧;属于非电解质的是②⑥⑩。
进阶训练C
1.答案:A
解析:由表中NaHSO4的物质类别属于盐,在水溶液中解离出来的离子有H+,但不属于酸,故A正确;在水溶液中电离出金属阳离子的物质不一定是盐,可能是碱,故B错误;在NH4Cl的盐溶液中解离出来的阳离子为NH,而不是金属离子,故C错误;由表中信息可知在一水合氨中解离成的离子为NH和OH-,则碱溶液解离出的离子一定有金属阳离子的说法错误,故D错误。
2.答案:A
解析:根据信息,矿泉水中含有电解质,即该矿泉水能够导电,故A正确;矿泉水属于混合物,非电解质属于化合物,故B错误;因为Ca元素以离子的形式存在,故C错误;矿泉水属于混合物,电解质属于化合物,故D错误。
3.答案:D
解析:向澄清石灰水中通入过量的CO2,先生成碳酸钙沉淀,钙离子、氢氧根离子浓度在减少,溶液导电能力减弱,后沉淀溶解生成碳酸氢钙溶液,钙离子、碳酸氢根离子的浓度在增大,钙离子的浓度与原来相等,碳酸氢根离子的浓度与原来氢氧根离子浓度相等,但OH-的摩尔导电率大于HCO的摩尔电导率,所以最后溶液的导电性小于原来,最后不变;D符合题意。
4.答案:(1)①④⑦ ②⑥⑧⑨⑩ ③⑤
(2)NaHCO3===Na++HCO 盐
(3)Ba(OH)2+H2SO4===BaSO4↓+2H2O
(4)NaHCO3+ HCl===NaCl+H2O+CO2↑
解析:(1)①石墨存在自由移动的电子,可以导电;石墨是单质,既不是电解质也不是非电解质;②氧化钠固体没有自由移动的带电微粒,不可以导电;在熔融状态下可以导电,属于电解质;③酒精中没有自由移动的带电微粒,不能导电;在水溶液和熔融状态不能导电属于非电解质;④氨水中含有自由移动的铵根离子和氢氧根离子,可以导电,但氨水是混合物,既不是电解质也不是非电解质;⑤二氧化碳中没有自由移动的带电微粒,不能导电;在水溶液中导电是因为生成了碳酸,在熔融状态不能导电属于非电解质;⑥碳酸氢钠固体没有自由移动的带电微粒,不可以导电,在水溶液中可以电离出钠离子和碳酸氢根离子,可以导电,属于电解质;⑦氢氧化钡溶液中含有自由移动的钡离子和氢氧根离子,可以导电,氢氧化钡溶液属于混合物,既不是电解质,也不是非电解质;⑧冰醋酸中没有自由移动的带电微粒,不能导电,冰醋酸的水溶液中含有自由移动的氢离子和醋酸根离子,可以导电,故冰醋酸属于电解质;⑨氯化氢中没有自由移动的带电微粒,不能导电,氯化氢的水溶液盐酸中含有自由移动的氢离子和氯离子,可以导电,故氯化氢为电解质;⑩硫酸铝固体中没有自由移动的带电微粒,不能导电;硫酸铝在水溶液和熔融状态下有自由移动的铝离子和硫酸根离子,可以导电,故硫酸铝属于电解质; 稀硫酸中含有自由移动的氢离子和硫酸根离子,可以导电;稀硫酸属于混合物,既不是电解质也不是非电解质; 氯化银中没有自由移动的带电微粒,不能导电,氯化银在水溶液和熔融状态下可以提供自由移动的离子,属于电解质; 硫酸氢钠中没有自由移动的带电微粒,不能导电,在水溶液中可以完全电离出Na+、H+、SO和熔融状态下可以完全电离出Na+和HSO,可以导电,故硫酸氢钠属于电解质;其中能导电的是 ①④⑦ ;属于电解质的是②⑥⑧⑨⑩ ;属于非电解质的是③⑤;
(2)碳酸氢钠属于弱酸的酸式盐,溶于水电离出钠离子和碳酸氢根离子,电离方程式为:NaHCO3===Na++HCO;属于盐;
(3)氢氧化钡和稀硫酸反应生成硫酸钡沉淀和水,反应的化学方程式:Ba (OH )2+H2SO4===BaSO4↓+2H2O;
(4)碳酸氢钠和盐酸反应生成氯化钠、水、二氧化碳,化学方程式为:NaHCO3+HCl===NaCl+H2O+CO2↑。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
