必修一 2.3 物质的量 课时训练(含答案)
文档属性
| 名称 | 必修一 2.3 物质的量 课时训练(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 990.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-30 08:45:53 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
必修一 2.3 物质的量 课时训练(含答案)
一、选择题
1.下列对于“摩尔”的理解正确的是( )
A.摩尔是物质的质量单位
B.摩尔是表示物质的数量单位,且只适用于分子、原子和离子
C.摩尔是表示物质的量的单位,符号为mol
D.摩尔是国际科学界建议采用的七个基本物理量之一
2.下列化学用语错误的是( )
A.1mol NaCl B. C.2mol 氧 D.3mol H
3.下列对于“摩尔”的理解正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.22.4LO2 中所含氧气分子数为 1NA 个
C.1mol 氧含 6.02×1023 个 O2
D.摩尔是物质的量的单位,简称摩,符号为 mol
4.雨后空气中的自由电子附着在分子或原子上形成空气负离子。就是一种空气负离子,其摩尔质量为
A.76g B.76g·mol-1 C.77g·mol-1 D.77g
5.化合物的摩尔质量为( )
A.76 B.80 C. D.
6.由氨气和氢气组成的混合气体的平均相对分子质量为12,则氨气和氢气的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
7.同温同压下,决定气体体积大小的主要因素是( )
A.微粒大小 B.微粒间距 C.微粒种类 D.微粒数目
8.下列说法中正确的是( )
A.1mol任何气体的体积都是22.4L/mol
B.1mol的质量是1g,它所占的体积是22.4L/mol
C.在标准状况下,1mol任何气体所占的体积都约为22.4
D.在标准状况下,1mol任何气体所占的体积都约为22.4L
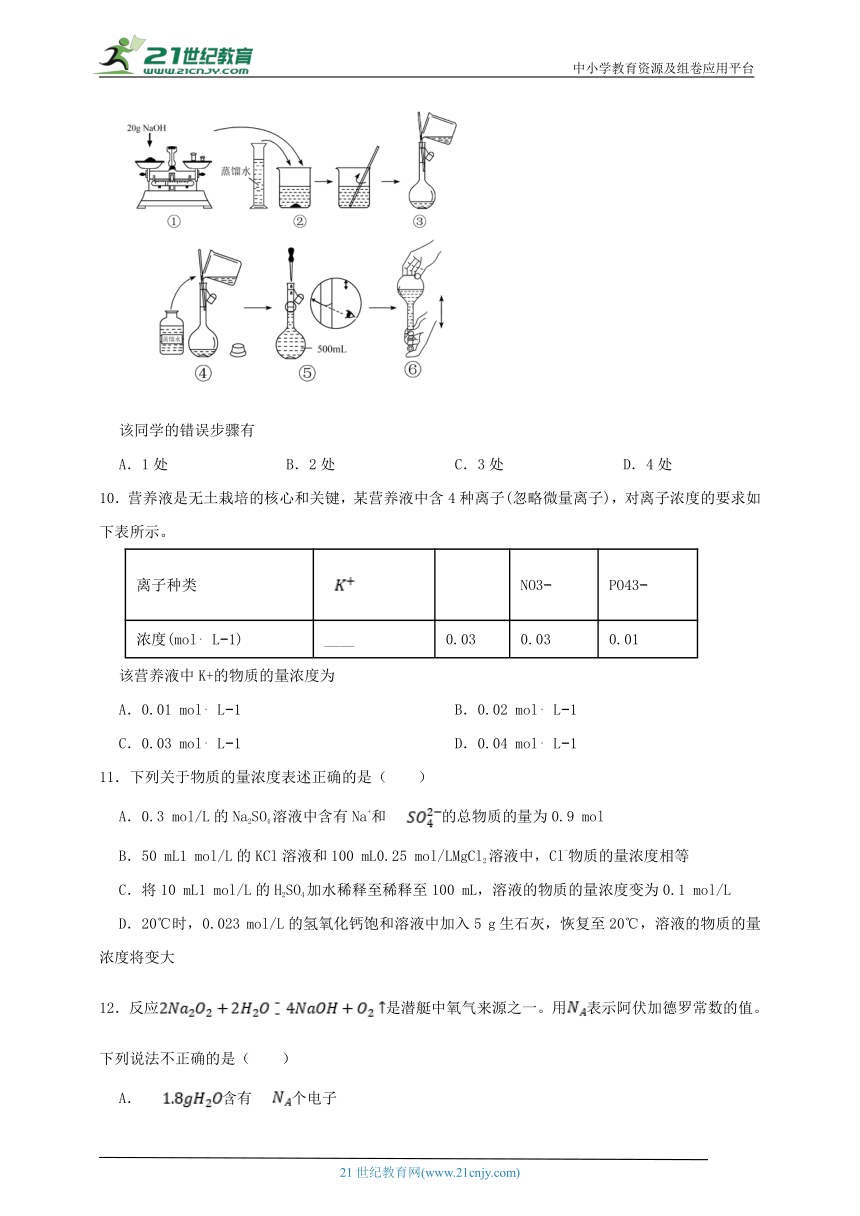
9.如图是某同学用500mL容量瓶配制0.10mol·L-1NaOH溶液的过程:
该同学的错误步骤有
A.1处 B.2处 C.3处 D.4处
10.营养液是无土栽培的核心和关键,某营养液中含4种离子(忽略微量离子),对离子浓度的要求如下表所示。
离子种类 NO3 PO43
浓度(mol L 1) ____ 0.03 0.03 0.01
该营养液中K+的物质的量浓度为
A.0.01 mol L 1 B.0.02 mol L 1
C.0.03 mol L 1 D.0.04 mol L 1
11.下列关于物质的量浓度表述正确的是( )
A.0.3 mol/L的Na2SO4溶液中含有Na+和的总物质的量为0.9 mol
B.50 mL1 mol/L的KCl溶液和100 mL0.25 mol/LMgCl2溶液中,Cl-物质的量浓度相等
C.将10 mL1 mol/L的H2SO4加水稀释至稀释至100 mL,溶液的物质的量浓度变为0.1 mol/L
D.20℃时,0.023 mol/L的氢氧化钙饱和溶液中加入5 g生石灰,恢复至20℃,溶液的物质的量浓度将变大
12.反应是潜艇中氧气来源之一。用表示阿伏加德罗常数的值。下列说法不正确的是( )
A.含有个电子
B.反应中每生成转移电子
C.标准状况下,含有个氧原子
D.将溶于水配成溶液,则
13.NA 为阿伏加德罗常数的值。下列叙述正确的是( )
A.46g 分子式为 C2H6O 的有机物含有的 C-H 键数目一定为 5 NA
B.标准状况下, 11.2L 一氯甲烷所含分子数为 0.5 NA
C.常温常压下, 124gP4 中所含 P-P 键的数目为 4NA
D.某气态团簇分子结构如右图所示, 该气态团簇分子的分子式为 TiC
14.表示阿伏加德罗常数的值,下列叙述正确的是
A.一定条件下,5.6 g Fe与足量S反应,转移个电子
B.常温下,溶液中阴离子总数等于
C.电解精炼铜时每转移个电子,阳极质量一定减少32 g
D.常温常压下,6 g 晶体中所含硅氧键数目为
15.室温下,甲同学配制5%的溶液100g,乙同学配制的溶液100mL(的溶解度为水),下列说法正确的是
A.所需溶质的质量相同 B.所需仪器均包括100mL容量瓶
C.所配溶液均为不饱和溶液 D.所配溶液质量相同
二、非选择题
16.
(1)绿色植物是空气天然的“净化器”,在家里科学选种一些绿色植物,可以达到净化空气、吸收有害物质的作用。科学研究发现,1公顷柳杉每月可以吸收160
kg SO2,则1公顷柳杉每月吸收的SO2的物质的量为 。
(2)铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混合、压制,就可以制成不同型号的铅笔芯。如果某铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1
mg。那么一个铅笔字含有的碳原子数约为 。
(3)吸食“摇头丸”会严重破坏人体的中枢神经,“摇头丸”的化学式为C9H13N,请计算:
①“摇头丸”的摩尔质量为 ;
②某毒枭被查获带有270 g“摇头丸”,该毒枭所带的“摇头丸”的物质的量为 。
(4)将14.3 g Na2CO3·10H2O固体溶于水配成250
mL溶液,则所得溶液物质的量浓度是 。
17.工业制取盐酸时,将标准状况下氢气与适量氯气恰好完全反应,再将反应生成的全部气体用水吸收,得到盐酸。请计算该工业制得盐酸的物质的量浓度 。
18.用10mol/L的浓盐酸配制成1mol/L的稀盐酸220mL。试回答下列问题:
(1)配制稀盐酸时,可供选择的仪器有①托盘天平②玻璃棒③药匙④烧杯⑤胶头滴管,其中还缺少的仪器有: 。
(2)经计算需要 mL浓盐酸(保留一位小数)。用量筒量取浓盐酸时,假若仰视读数,则浓盐酸的实际体积 (选填“大于”、“小于”、“等于”)计算值。
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是 (填序号)。
(4)若实验过程遇到下列情况,使盐酸的物质的量浓度偏高的是__________。
A.用来稀释浓盐酸的烧杯未洗涤;
B.未经冷却将溶液注入容量瓶中;
C.摇匀后发现液面下降再加水;
D.定容时俯视观察液面。
答案解析部分
1.【答案】C
【解析】【解答】A.摩尔是物质的量的单位,故A不符合题意;
B.摩尔是物质的量的单位,故B不符合题意;
C.摩尔是表示物质的量的单位,符号为mol,故C符合题意;
D.摩尔是物质的量的单位,物质的量是国际科学界建议采用的一种基本物理量,故D不符合题意;
故答案为:C。
【分析】A、摩尔是物质的量的单位;
B、摩尔是物质的量的单位;
C、摩尔是物质的量的单位,用mol表示;
D、物质的量是七个基本物理量之一,摩尔是七个基本单位之一。
2.【答案】C
【解析】【解答】A.1mol NaCl表述符合题意,故A不选;
B.表述符合题意,故B不选;
C.2mol 氧中的“氧”指代不明,表述不符合题意,故C选;
D.3mol H表示3mol氢原子,表述符合题意,故D不选;
故答案为:C。
【分析】物质的量必须注明物质的名称。
3.【答案】D
【解析】【解答】A. 摩尔是物质的量的单位,物质的量是国际科学界建议采用的一种物理量,故不符合题意;
B. 22.4LO2 因为没有说明温度和压强,不能计算其物质的量,故不符合题意;
C. 1mol 氧的说法中没有说明微粒的名称,故不符合题意;
D. 摩尔是物质的量的单位,简称摩,符号为 mol,故符合题意。
故答案为:D。
【分析】A.摩尔是物质的量的单位;
B.没有气体的温度和压强无法计算其物质的量;
C.1mol氧没有指明物质的微粒名称。
4.【答案】B
【解析】【解答】的摩尔质量以 g·mol-1 为单位时,数值上等于其化学式式量,因此其摩尔质量为76 g·mol-1 ,故B正确;
故答案为:B。
【分析】依据摩尔质量数值上等于其化学式式量计算。
5.【答案】D
【解析】【解答】的相对分子质量为80,则化合物的摩尔质量为,故D符合题意;
故答案为:D。
【分析】物质的摩尔质量与相对分子质量在数值上相等,单位为“g/mol”。
6.【答案】C
【解析】【解答】设氨气与氢气的物质的量分别为xmol、ymol,由氨气和氢气组成的混合气体的平均相对分子质量为12可知(17x+2y)/(x+y)=12,整理得x:y=2:1,
故答案为:C。
【分析】根据摩尔质量等于质量与物质的量之比计算两种气体的物质的量之比。
7.【答案】D
【解析】【解答】当温度和压强相同时,气体摩尔体积相等,气体分子间平均距离近似相同,根据V=nVm知,气体体积取决于气体的物质的量,与气体的种类、气体分子本身的大小、气体分子之间的平均距离无关,
故答案为:D。
【分析】在一定温度和压强下,气体分子间的距离相等,因分子间距离远大于气体分子大小,则影响其所占体积大小的主要因素是气体分子数目的多少,据此分析。
8.【答案】D
【解析】【解答】A.在标准状况下,1mol任何气体所占的体积都约为22.4L,题中没有指明标准状况,A不符合题意;
B.1mol H2的质量是2g,在标准状况下它所占的体积是22.4L,B不符合题意;
C.在标准状况下,1mol任何气体所占的体积都约为22.4L,体积的单位是:“L”,而不是“L·mol-1”,C不符合题意;
D.在标准状况下,气体摩尔体积约为22.4L/mol,则1mol任何气体所占的体积都约为22.4L,D符合题意;
故答案为:D。
【分析】概念辨析:在标准状况下,气体摩尔体积约为22.4L/mol,1mol任何气体,无论是单一气体还是混合气体,所占体积都是22.4L。
9.【答案】C
【解析】【解答】第①步不能把NaOH放在称量纸上称量;
第④步玻璃棒不能太深入,应接触容量瓶内壁刻度线以下的部分;
第⑤步定容时应平视刻度线;
故答案为:C
【分析】第①步不能把NaOH放在称量纸上称量,应放在小烧杯中称量;
第④步玻璃棒应接触容量瓶内壁刻度线以下的部分;
第⑤步定容时应平视刻度线。
10.【答案】C
【解析】【解答】溶液呈电中性,即阴阳离子的总数相等,有c(K+)+0.03mol/L=0.03mol/L+0.01mol/L×3,解得c(K+)=0.03mol/L,
故答案为:C。
【分析】结合阴阳离子电荷总数相等进行判断。
11.【答案】C
【解析】【解答】A.只有溶液浓度,缺少溶液体积,不能计算微粒数目,A不符合题意;
B.50 mL1 mol/L的KCl溶液中Cl-的浓度c(Cl-)=1 mol/L;100 mL0.25 mol/LMgCl2溶液中,Cl-物质的量浓度c(Cl-)=0.25 mol/L×2=0.5 mol/L,可见两种溶液中,Cl-物质的量浓度不相等,B不符合题意;
C.溶液在稀释前后溶质的物质的量不变,则根据稀释公式,可得稀释后溶液的物质的量浓度c=,C符合题意;
D.20℃时,0.023 mol/L的氢氧化钙饱和溶液中加入5 g生石灰,再恢复至20℃,溶液的物质的量浓度将不变,D不符合题意;
故答案为:C。
【分析】A.溶液体积未知;
B.分别计算两溶液中的c(Cl-),然后进行比较;
D.在同一温度下,同一物质的溶解度不变,则其形成的饱和溶液浓度不变。
12.【答案】B
【解析】【解答】A、一个水分子中含有10个电子, 的物质的量为1mol,含有个电子,故A正确;
B、该反应中Na2O2中-1价的O歧化为0价和-2价,则每生成1molO2转移2mol电子,故B错误;
C、标况下,的物质的量为1mol, 含有个氧原子,故C正确;
D、的物质的量为0.1mol,溶于水配成溶液, ,故D正确;
故答案为:B。
【分析】A、一个水分子中含有10个电子;
B、Na2O2中-1价的O歧化为0价和-2价;
C、氧气是双原子分子;
D、根据计算。
13.【答案】B
【解析】【解答】A、C2H6O的结构简式可能是CH3CH2OH,也可能是CH3OCH3,前者1mol分子有5NA C-H键,后者1mol分子有6NA C-H键,A错误;
B、标准状况下,一氯甲烷为气体,结合公式,则分子数为0.5NA,B正确;
C、P4的结构如图,1个P4分子中有6个P-P键,124g P4的物质的量为1mol,含有6mol NA,C错误;
D、分子为气态团簇分子,其Ti原子个数为14,C为13,则分子式为Ti14C13,D错误;
故答案为:B
【分析】A、同一个分子式,可能存在不同结构,根据其结构判断共价键数目;
B、标准状况下为气体的卤代烃,常见的有一氯甲烷和一氯乙烷;
C、根据分子结构可以判断共价键数目;
D、气态团簇分子的计算不能用均摊法判断,根据其原子个数判断分子式。
14.【答案】A
【解析】【解答】A.硫单质氧化性较弱,铁和硫反应时只能生成+2价的铁,5.6 g Fe与足量S反应,转移个电子,A符合题意;
B.溶液中,发生水解,,所以阴离子的总数增加,大于,B不符合题意;
C.电解精炼铜时,阳极为粗铜,含有其他的杂质,每转移个电子,阳极质量不一定减少32 g,C不符合题意;
D.为正四面体网状结构,每个硅原子含有4个硅氧键,所以6 g 晶体为0.1mol,所含硅氧键数目为,D不符合题意;
故答案为:A。
【分析】A.铁和硫反应时只能生成+2价的铁;
B.会水解;
C.阳极为粗铜,含有其他的杂质;
D.为正四面体网状结构,每个硅原子含有4个硅氧键。
15.【答案】C
【解析】【解答】A.由分析可知,5%氯化钠溶液和0.5mol/L氯化钠溶液中氯化钠的质量不同,故A不符合题意;
B.配制100g5%氯化钠溶液不需要用到100mL容量瓶,故B不符合题意;
C.由分析可知,5%氯化钠溶液和0.5mol/L氯化钠溶液均为不饱和溶液,故C符合题意;
D.氯化钠溶液的密度大于1g/mL,则100mL氯化钠溶液的质量大于100g,故D不符合题意;
故答案为:C。
【分析】A.配制100g 5%的NaCl溶液需要氯化钠质量为100g×5%=5g,配制100mL0.5mol/L的 NaCl溶液需要氯化钠质量为0.1L×0.5mol/L×58.5g/mol≈2.9g; B.配制5%的溶液100g不需要用到100mL容量瓶; C.20℃时,氯化钠的溶液的溶解度为36g; D.氯化钠溶液的密度大于1g/mL,100mL氯化钠溶液的质量大于100g。
16.【答案】(1)2500 mol
(2)2.5×1019
(3)135 g·mol-1;2 mol
(4)0.2mol.L-1
【解析】【解答】(1)160kgSO2的物质的量;
(2)一个字中所含碳元素的质量为1×10-3g×0.5=5×10-4g,其物质的量,其所含的碳原子数;
(3)①C9H13N的相对分子质量为:12×9+1×13+14=135,摩尔质量以g/mol为单位时,数值上等于化学式的式量,因此“摇头丸”的摩尔质量为135g/mol;②270g“摇头丸”的物质的量;
(4)14.3gNa2CO3·10H2O的物质的量,因此n(Na2CO3)=0.05mol,因此所得溶液的物质的量浓度;
【分析】(1)根据公式计算n(SO2);
(2)根据公式计算n(C),再根据公式N=n×NA计算所含碳原子数;
(3)①摩尔质量以g/mol为单位时,数值上等于其化学式式量;②根据公式计算270g“摇头丸”的物质的量;
(4)根据公式计算n(Na2CO3),再根据公式计算所得溶液的物质的量浓度;
17.【答案】12mol/L。
【解析】【解答】根据可知,标准状况下氢气(1.5×103mol)与适量氯气恰好完全反应生成HCl3.0×103mol,再将反应生成的全部气体用水吸收,得到盐酸,盐酸的物质的量浓度3.0×103mol÷250L=12mol/L。
【分析】依据c=n/V计算。
18.【答案】(1)250 mL容量瓶、量筒
(2)25.0;大于
(3)③①④②
(4)B;D
【解析】【解答】(1)由浓溶液配制稀溶液时,需用量筒量取所需浓溶液的体积;配制220mL溶液,需用250mL容量瓶。因此还缺少的仪器有量筒、250mL容量瓶。 (2)配制220mL溶液,需250mL容量瓶,由浓溶液配制稀溶液的过程为稀释,溶质的量保持不变,因此可得10mol·L-1×V(浓)=1mol·L-1×250mL,解得 V(浓)=25.0mL。用量筒量取浓盐酸的体积时仰视读数,则所量取的浓盐酸的体积偏大。 (3)量取所需的浓盐酸后,需对溶液进行稀释操作;恢复至室温后,将溶液转移到250mL容量瓶中;并用蒸馏水洗涤烧杯和玻璃棒,洗涤液注入250mL容量瓶内;最后对容量瓶内的溶液进行定容操作。因此正确的操作顺序为③①④②。 (4)A、用来稀释浓盐酸的烧杯未洗涤,对所得稀盐酸的浓度无影响,A不符合题意; B、未经冷却,则温度较高,液体热胀冷缩,使得最终溶液的体积偏小,由公式可知,最终所得稀盐酸的物质的量浓度偏高,B符合题意; C、摇匀后再加水,溶液的体积偏大,由公式可知,最终所得稀盐酸的物质的量浓度偏小,C不符合题意; D、定容时俯视液面,则所得溶液的体积偏小,由公式可知,最终所得稀盐酸的物质的量浓度偏高,D符合题意; 故答案为:BD
【分析】(1)根据溶液配制过程确定所需的仪器。
(2)根据公式c1V1=c2V2计算所需浓盐酸的体积。若仰视读数,则实际体积偏大。
(3)根据溶液配制过程确定正确的顺序。
(4)分析错误操作对n、V的影响,结合公式确定实验误差。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
必修一 2.3 物质的量 课时训练(含答案)
一、选择题
1.下列对于“摩尔”的理解正确的是( )
A.摩尔是物质的质量单位
B.摩尔是表示物质的数量单位,且只适用于分子、原子和离子
C.摩尔是表示物质的量的单位,符号为mol
D.摩尔是国际科学界建议采用的七个基本物理量之一
2.下列化学用语错误的是( )
A.1mol NaCl B. C.2mol 氧 D.3mol H
3.下列对于“摩尔”的理解正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.22.4LO2 中所含氧气分子数为 1NA 个
C.1mol 氧含 6.02×1023 个 O2
D.摩尔是物质的量的单位,简称摩,符号为 mol
4.雨后空气中的自由电子附着在分子或原子上形成空气负离子。就是一种空气负离子,其摩尔质量为
A.76g B.76g·mol-1 C.77g·mol-1 D.77g
5.化合物的摩尔质量为( )
A.76 B.80 C. D.
6.由氨气和氢气组成的混合气体的平均相对分子质量为12,则氨气和氢气的物质的量之比为( )
A.1∶1 B.1∶2 C.2∶1 D.3∶1
7.同温同压下,决定气体体积大小的主要因素是( )
A.微粒大小 B.微粒间距 C.微粒种类 D.微粒数目
8.下列说法中正确的是( )
A.1mol任何气体的体积都是22.4L/mol
B.1mol的质量是1g,它所占的体积是22.4L/mol
C.在标准状况下,1mol任何气体所占的体积都约为22.4
D.在标准状况下,1mol任何气体所占的体积都约为22.4L
9.如图是某同学用500mL容量瓶配制0.10mol·L-1NaOH溶液的过程:
该同学的错误步骤有
A.1处 B.2处 C.3处 D.4处
10.营养液是无土栽培的核心和关键,某营养液中含4种离子(忽略微量离子),对离子浓度的要求如下表所示。
离子种类 NO3 PO43
浓度(mol L 1) ____ 0.03 0.03 0.01
该营养液中K+的物质的量浓度为
A.0.01 mol L 1 B.0.02 mol L 1
C.0.03 mol L 1 D.0.04 mol L 1
11.下列关于物质的量浓度表述正确的是( )
A.0.3 mol/L的Na2SO4溶液中含有Na+和的总物质的量为0.9 mol
B.50 mL1 mol/L的KCl溶液和100 mL0.25 mol/LMgCl2溶液中,Cl-物质的量浓度相等
C.将10 mL1 mol/L的H2SO4加水稀释至稀释至100 mL,溶液的物质的量浓度变为0.1 mol/L
D.20℃时,0.023 mol/L的氢氧化钙饱和溶液中加入5 g生石灰,恢复至20℃,溶液的物质的量浓度将变大
12.反应是潜艇中氧气来源之一。用表示阿伏加德罗常数的值。下列说法不正确的是( )
A.含有个电子
B.反应中每生成转移电子
C.标准状况下,含有个氧原子
D.将溶于水配成溶液,则
13.NA 为阿伏加德罗常数的值。下列叙述正确的是( )
A.46g 分子式为 C2H6O 的有机物含有的 C-H 键数目一定为 5 NA
B.标准状况下, 11.2L 一氯甲烷所含分子数为 0.5 NA
C.常温常压下, 124gP4 中所含 P-P 键的数目为 4NA
D.某气态团簇分子结构如右图所示, 该气态团簇分子的分子式为 TiC
14.表示阿伏加德罗常数的值,下列叙述正确的是
A.一定条件下,5.6 g Fe与足量S反应,转移个电子
B.常温下,溶液中阴离子总数等于
C.电解精炼铜时每转移个电子,阳极质量一定减少32 g
D.常温常压下,6 g 晶体中所含硅氧键数目为
15.室温下,甲同学配制5%的溶液100g,乙同学配制的溶液100mL(的溶解度为水),下列说法正确的是
A.所需溶质的质量相同 B.所需仪器均包括100mL容量瓶
C.所配溶液均为不饱和溶液 D.所配溶液质量相同
二、非选择题
16.
(1)绿色植物是空气天然的“净化器”,在家里科学选种一些绿色植物,可以达到净化空气、吸收有害物质的作用。科学研究发现,1公顷柳杉每月可以吸收160
kg SO2,则1公顷柳杉每月吸收的SO2的物质的量为 。
(2)铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混合、压制,就可以制成不同型号的铅笔芯。如果某铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1
mg。那么一个铅笔字含有的碳原子数约为 。
(3)吸食“摇头丸”会严重破坏人体的中枢神经,“摇头丸”的化学式为C9H13N,请计算:
①“摇头丸”的摩尔质量为 ;
②某毒枭被查获带有270 g“摇头丸”,该毒枭所带的“摇头丸”的物质的量为 。
(4)将14.3 g Na2CO3·10H2O固体溶于水配成250
mL溶液,则所得溶液物质的量浓度是 。
17.工业制取盐酸时,将标准状况下氢气与适量氯气恰好完全反应,再将反应生成的全部气体用水吸收,得到盐酸。请计算该工业制得盐酸的物质的量浓度 。
18.用10mol/L的浓盐酸配制成1mol/L的稀盐酸220mL。试回答下列问题:
(1)配制稀盐酸时,可供选择的仪器有①托盘天平②玻璃棒③药匙④烧杯⑤胶头滴管,其中还缺少的仪器有: 。
(2)经计算需要 mL浓盐酸(保留一位小数)。用量筒量取浓盐酸时,假若仰视读数,则浓盐酸的实际体积 (选填“大于”、“小于”、“等于”)计算值。
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是 (填序号)。
(4)若实验过程遇到下列情况,使盐酸的物质的量浓度偏高的是__________。
A.用来稀释浓盐酸的烧杯未洗涤;
B.未经冷却将溶液注入容量瓶中;
C.摇匀后发现液面下降再加水;
D.定容时俯视观察液面。
答案解析部分
1.【答案】C
【解析】【解答】A.摩尔是物质的量的单位,故A不符合题意;
B.摩尔是物质的量的单位,故B不符合题意;
C.摩尔是表示物质的量的单位,符号为mol,故C符合题意;
D.摩尔是物质的量的单位,物质的量是国际科学界建议采用的一种基本物理量,故D不符合题意;
故答案为:C。
【分析】A、摩尔是物质的量的单位;
B、摩尔是物质的量的单位;
C、摩尔是物质的量的单位,用mol表示;
D、物质的量是七个基本物理量之一,摩尔是七个基本单位之一。
2.【答案】C
【解析】【解答】A.1mol NaCl表述符合题意,故A不选;
B.表述符合题意,故B不选;
C.2mol 氧中的“氧”指代不明,表述不符合题意,故C选;
D.3mol H表示3mol氢原子,表述符合题意,故D不选;
故答案为:C。
【分析】物质的量必须注明物质的名称。
3.【答案】D
【解析】【解答】A. 摩尔是物质的量的单位,物质的量是国际科学界建议采用的一种物理量,故不符合题意;
B. 22.4LO2 因为没有说明温度和压强,不能计算其物质的量,故不符合题意;
C. 1mol 氧的说法中没有说明微粒的名称,故不符合题意;
D. 摩尔是物质的量的单位,简称摩,符号为 mol,故符合题意。
故答案为:D。
【分析】A.摩尔是物质的量的单位;
B.没有气体的温度和压强无法计算其物质的量;
C.1mol氧没有指明物质的微粒名称。
4.【答案】B
【解析】【解答】的摩尔质量以 g·mol-1 为单位时,数值上等于其化学式式量,因此其摩尔质量为76 g·mol-1 ,故B正确;
故答案为:B。
【分析】依据摩尔质量数值上等于其化学式式量计算。
5.【答案】D
【解析】【解答】的相对分子质量为80,则化合物的摩尔质量为,故D符合题意;
故答案为:D。
【分析】物质的摩尔质量与相对分子质量在数值上相等,单位为“g/mol”。
6.【答案】C
【解析】【解答】设氨气与氢气的物质的量分别为xmol、ymol,由氨气和氢气组成的混合气体的平均相对分子质量为12可知(17x+2y)/(x+y)=12,整理得x:y=2:1,
故答案为:C。
【分析】根据摩尔质量等于质量与物质的量之比计算两种气体的物质的量之比。
7.【答案】D
【解析】【解答】当温度和压强相同时,气体摩尔体积相等,气体分子间平均距离近似相同,根据V=nVm知,气体体积取决于气体的物质的量,与气体的种类、气体分子本身的大小、气体分子之间的平均距离无关,
故答案为:D。
【分析】在一定温度和压强下,气体分子间的距离相等,因分子间距离远大于气体分子大小,则影响其所占体积大小的主要因素是气体分子数目的多少,据此分析。
8.【答案】D
【解析】【解答】A.在标准状况下,1mol任何气体所占的体积都约为22.4L,题中没有指明标准状况,A不符合题意;
B.1mol H2的质量是2g,在标准状况下它所占的体积是22.4L,B不符合题意;
C.在标准状况下,1mol任何气体所占的体积都约为22.4L,体积的单位是:“L”,而不是“L·mol-1”,C不符合题意;
D.在标准状况下,气体摩尔体积约为22.4L/mol,则1mol任何气体所占的体积都约为22.4L,D符合题意;
故答案为:D。
【分析】概念辨析:在标准状况下,气体摩尔体积约为22.4L/mol,1mol任何气体,无论是单一气体还是混合气体,所占体积都是22.4L。
9.【答案】C
【解析】【解答】第①步不能把NaOH放在称量纸上称量;
第④步玻璃棒不能太深入,应接触容量瓶内壁刻度线以下的部分;
第⑤步定容时应平视刻度线;
故答案为:C
【分析】第①步不能把NaOH放在称量纸上称量,应放在小烧杯中称量;
第④步玻璃棒应接触容量瓶内壁刻度线以下的部分;
第⑤步定容时应平视刻度线。
10.【答案】C
【解析】【解答】溶液呈电中性,即阴阳离子的总数相等,有c(K+)+0.03mol/L=0.03mol/L+0.01mol/L×3,解得c(K+)=0.03mol/L,
故答案为:C。
【分析】结合阴阳离子电荷总数相等进行判断。
11.【答案】C
【解析】【解答】A.只有溶液浓度,缺少溶液体积,不能计算微粒数目,A不符合题意;
B.50 mL1 mol/L的KCl溶液中Cl-的浓度c(Cl-)=1 mol/L;100 mL0.25 mol/LMgCl2溶液中,Cl-物质的量浓度c(Cl-)=0.25 mol/L×2=0.5 mol/L,可见两种溶液中,Cl-物质的量浓度不相等,B不符合题意;
C.溶液在稀释前后溶质的物质的量不变,则根据稀释公式,可得稀释后溶液的物质的量浓度c=,C符合题意;
D.20℃时,0.023 mol/L的氢氧化钙饱和溶液中加入5 g生石灰,再恢复至20℃,溶液的物质的量浓度将不变,D不符合题意;
故答案为:C。
【分析】A.溶液体积未知;
B.分别计算两溶液中的c(Cl-),然后进行比较;
D.在同一温度下,同一物质的溶解度不变,则其形成的饱和溶液浓度不变。
12.【答案】B
【解析】【解答】A、一个水分子中含有10个电子, 的物质的量为1mol,含有个电子,故A正确;
B、该反应中Na2O2中-1价的O歧化为0价和-2价,则每生成1molO2转移2mol电子,故B错误;
C、标况下,的物质的量为1mol, 含有个氧原子,故C正确;
D、的物质的量为0.1mol,溶于水配成溶液, ,故D正确;
故答案为:B。
【分析】A、一个水分子中含有10个电子;
B、Na2O2中-1价的O歧化为0价和-2价;
C、氧气是双原子分子;
D、根据计算。
13.【答案】B
【解析】【解答】A、C2H6O的结构简式可能是CH3CH2OH,也可能是CH3OCH3,前者1mol分子有5NA C-H键,后者1mol分子有6NA C-H键,A错误;
B、标准状况下,一氯甲烷为气体,结合公式,则分子数为0.5NA,B正确;
C、P4的结构如图,1个P4分子中有6个P-P键,124g P4的物质的量为1mol,含有6mol NA,C错误;
D、分子为气态团簇分子,其Ti原子个数为14,C为13,则分子式为Ti14C13,D错误;
故答案为:B
【分析】A、同一个分子式,可能存在不同结构,根据其结构判断共价键数目;
B、标准状况下为气体的卤代烃,常见的有一氯甲烷和一氯乙烷;
C、根据分子结构可以判断共价键数目;
D、气态团簇分子的计算不能用均摊法判断,根据其原子个数判断分子式。
14.【答案】A
【解析】【解答】A.硫单质氧化性较弱,铁和硫反应时只能生成+2价的铁,5.6 g Fe与足量S反应,转移个电子,A符合题意;
B.溶液中,发生水解,,所以阴离子的总数增加,大于,B不符合题意;
C.电解精炼铜时,阳极为粗铜,含有其他的杂质,每转移个电子,阳极质量不一定减少32 g,C不符合题意;
D.为正四面体网状结构,每个硅原子含有4个硅氧键,所以6 g 晶体为0.1mol,所含硅氧键数目为,D不符合题意;
故答案为:A。
【分析】A.铁和硫反应时只能生成+2价的铁;
B.会水解;
C.阳极为粗铜,含有其他的杂质;
D.为正四面体网状结构,每个硅原子含有4个硅氧键。
15.【答案】C
【解析】【解答】A.由分析可知,5%氯化钠溶液和0.5mol/L氯化钠溶液中氯化钠的质量不同,故A不符合题意;
B.配制100g5%氯化钠溶液不需要用到100mL容量瓶,故B不符合题意;
C.由分析可知,5%氯化钠溶液和0.5mol/L氯化钠溶液均为不饱和溶液,故C符合题意;
D.氯化钠溶液的密度大于1g/mL,则100mL氯化钠溶液的质量大于100g,故D不符合题意;
故答案为:C。
【分析】A.配制100g 5%的NaCl溶液需要氯化钠质量为100g×5%=5g,配制100mL0.5mol/L的 NaCl溶液需要氯化钠质量为0.1L×0.5mol/L×58.5g/mol≈2.9g; B.配制5%的溶液100g不需要用到100mL容量瓶; C.20℃时,氯化钠的溶液的溶解度为36g; D.氯化钠溶液的密度大于1g/mL,100mL氯化钠溶液的质量大于100g。
16.【答案】(1)2500 mol
(2)2.5×1019
(3)135 g·mol-1;2 mol
(4)0.2mol.L-1
【解析】【解答】(1)160kgSO2的物质的量;
(2)一个字中所含碳元素的质量为1×10-3g×0.5=5×10-4g,其物质的量,其所含的碳原子数;
(3)①C9H13N的相对分子质量为:12×9+1×13+14=135,摩尔质量以g/mol为单位时,数值上等于化学式的式量,因此“摇头丸”的摩尔质量为135g/mol;②270g“摇头丸”的物质的量;
(4)14.3gNa2CO3·10H2O的物质的量,因此n(Na2CO3)=0.05mol,因此所得溶液的物质的量浓度;
【分析】(1)根据公式计算n(SO2);
(2)根据公式计算n(C),再根据公式N=n×NA计算所含碳原子数;
(3)①摩尔质量以g/mol为单位时,数值上等于其化学式式量;②根据公式计算270g“摇头丸”的物质的量;
(4)根据公式计算n(Na2CO3),再根据公式计算所得溶液的物质的量浓度;
17.【答案】12mol/L。
【解析】【解答】根据可知,标准状况下氢气(1.5×103mol)与适量氯气恰好完全反应生成HCl3.0×103mol,再将反应生成的全部气体用水吸收,得到盐酸,盐酸的物质的量浓度3.0×103mol÷250L=12mol/L。
【分析】依据c=n/V计算。
18.【答案】(1)250 mL容量瓶、量筒
(2)25.0;大于
(3)③①④②
(4)B;D
【解析】【解答】(1)由浓溶液配制稀溶液时,需用量筒量取所需浓溶液的体积;配制220mL溶液,需用250mL容量瓶。因此还缺少的仪器有量筒、250mL容量瓶。 (2)配制220mL溶液,需250mL容量瓶,由浓溶液配制稀溶液的过程为稀释,溶质的量保持不变,因此可得10mol·L-1×V(浓)=1mol·L-1×250mL,解得 V(浓)=25.0mL。用量筒量取浓盐酸的体积时仰视读数,则所量取的浓盐酸的体积偏大。 (3)量取所需的浓盐酸后,需对溶液进行稀释操作;恢复至室温后,将溶液转移到250mL容量瓶中;并用蒸馏水洗涤烧杯和玻璃棒,洗涤液注入250mL容量瓶内;最后对容量瓶内的溶液进行定容操作。因此正确的操作顺序为③①④②。 (4)A、用来稀释浓盐酸的烧杯未洗涤,对所得稀盐酸的浓度无影响,A不符合题意; B、未经冷却,则温度较高,液体热胀冷缩,使得最终溶液的体积偏小,由公式可知,最终所得稀盐酸的物质的量浓度偏高,B符合题意; C、摇匀后再加水,溶液的体积偏大,由公式可知,最终所得稀盐酸的物质的量浓度偏小,C不符合题意; D、定容时俯视液面,则所得溶液的体积偏小,由公式可知,最终所得稀盐酸的物质的量浓度偏高,D符合题意; 故答案为:BD
【分析】(1)根据溶液配制过程确定所需的仪器。
(2)根据公式c1V1=c2V2计算所需浓盐酸的体积。若仰视读数,则实际体积偏大。
(3)根据溶液配制过程确定正确的顺序。
(4)分析错误操作对n、V的影响,结合公式确定实验误差。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
