3.4.2 羧酸衍生物 课件(共24张PPT)人教版(2019)选择性必修第三册
文档属性
| 名称 | 3.4.2 羧酸衍生物 课件(共24张PPT)人教版(2019)选择性必修第三册 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 18:29:21 | ||
图片预览





文档简介
(共24张PPT)
走进奇妙的化学世界
2022-2023
选择性必修3
第三章 烃的衍生物
第四节 羧酸衍生物
回顾:乙酸与乙醇在浓硫酸加热条件下可以发生酯化反应,分析乙酸乙酯与乙酸结构上的变化。
酯:羧酸中羧基的-OH被-OR取代后的产物,官能团为:-COOR
羧酸衍生物:羧酸分子中羧基上的羟基被其他原子或原子团取代得到的产物。
酰基
酯
酰卤
R-C-
O
=
R-C-OR
O
=
R-C-X
O
=
R-C-NH2
O
=
酰胺
饱和一元酯的分子式的通式:CnH2nO2
一、酯
作溶剂
作制备饮料和糖果和糕点的酯类香料
物理性质
存在
用途
密度一般比水小
难溶于水,易溶于有机溶剂
许多酯也是常用的 有机溶剂
酯类广泛存在于自然界
低级酯是有芳香气味的液体,存在于各种水果和花草中
CH3(CH2)2C-O-CH2CH3
=
O
CH3(CH2)3C-O-(CH2)4CH3
=
O
CH3C-O-CH2CH2CHCH3
=
O
CH3
戊酸戊酯
丁酸乙酯
乙酸异戊酯
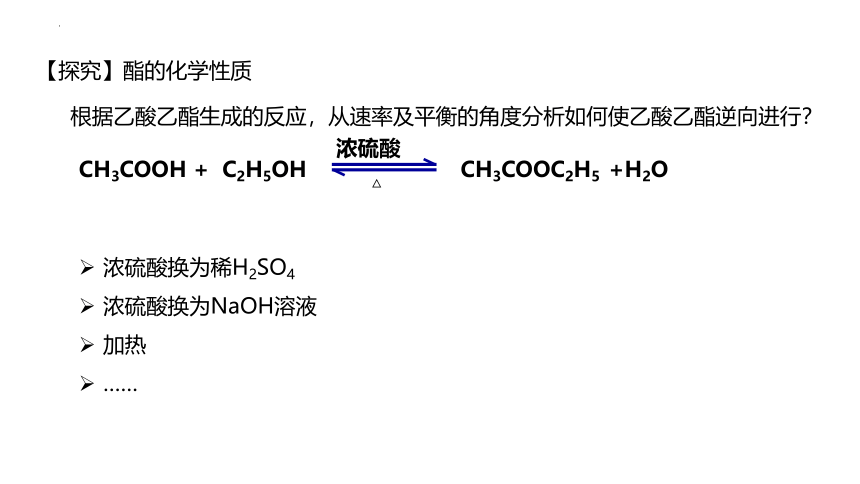
【探究】酯的化学性质
根据乙酸乙酯生成的反应,从速率及平衡的角度分析如何使乙酸乙酯逆向进行?
浓硫酸
△
CH3COOH + C2H5OH CH3COOC2H5 +H2O
浓硫酸换为稀H2SO4
浓硫酸换为NaOH溶液
加热
……
试管1 5 mL 蒸馏水 2 ml 乙酸乙酯 70℃ 试管4 5 mL 蒸馏水 2 ml 乙酸乙酯 常温
试管2 5 mL 1.5 mol/L H2SO4 2 ml 乙酸乙酯 70℃ 试管5 5 mL 1.5 mol/L H2SO4 2 ml 乙酸乙酯 常温
试管3 5 mL 3 mol/L NaOH 2 ml 乙酸乙酯 70℃ 试管6 5 mL 3 mol/L NaOH 2 ml 乙酸乙酯 常温
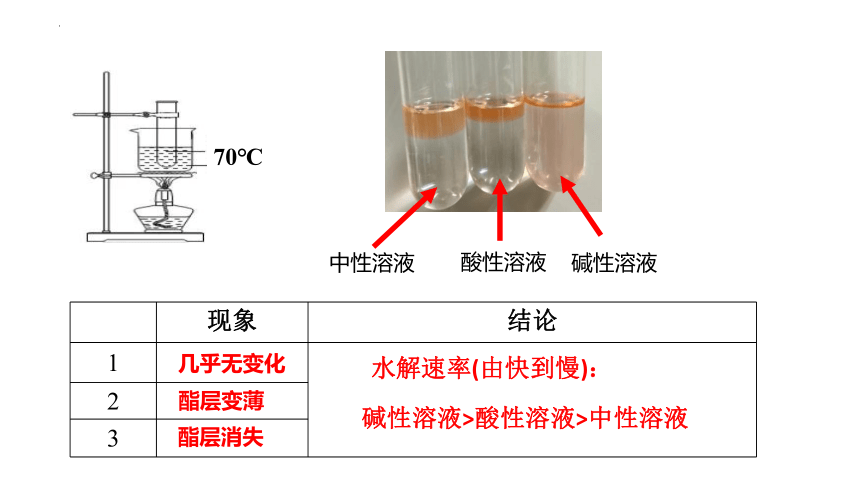
方案设计——探究酸碱性、温度对酯水解的影响
方法:可以通过观察酯层消失的时间差异,来判断乙酸乙酯在不同条件下的水解速率的差别。
为便于观察,乙酸乙酯经染色处理,染料不影响乙酸乙酯的水解反应
70℃
中性溶液
碱性溶液
酸性溶液
现象 结论
1
2 3 几乎无变化
酯层变薄
酯层消失
水解速率(由快到慢):
碱性溶液>酸性溶液>中性溶液
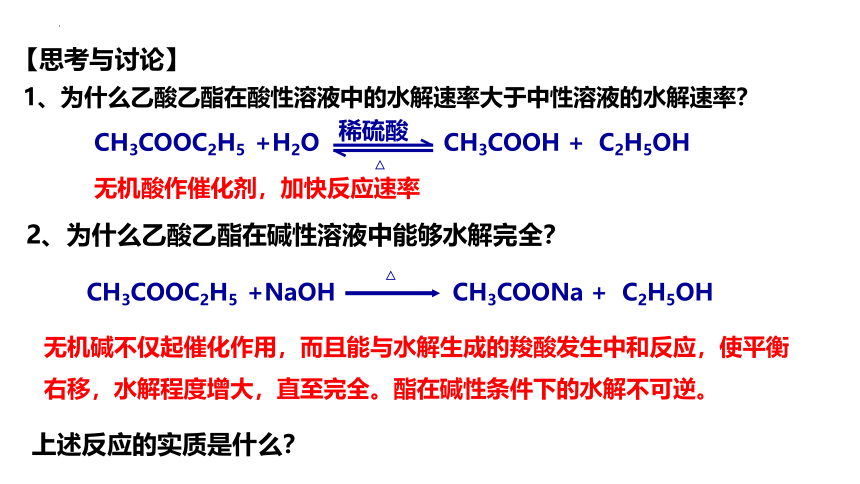
【思考与讨论】
1、为什么乙酸乙酯在酸性溶液中的水解速率大于中性溶液的水解速率?
CH3COOC2H5 +H2O
稀硫酸
△
CH3COOH + C2H5OH
无机酸作催化剂,加快反应速率
2、为什么乙酸乙酯在碱性溶液中能够水解完全?
△
CH3COOC2H5 +NaOH
CH3COONa + C2H5OH
无机碱不仅起催化作用,而且能与水解生成的羧酸发生中和反应,使平衡右移,水解程度增大,直至完全。酯在碱性条件下的水解不可逆。
上述反应的实质是什么?
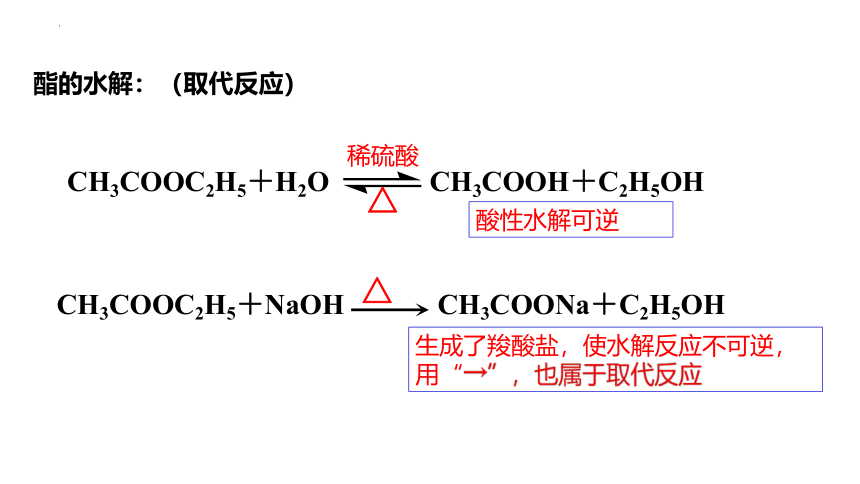
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
酸性水解可逆
生成了羧酸盐,使水解反应不可逆,用“→”,也属于取代反应
酯的水解:(取代反应)
稀硫酸
△
CH3C—O—C2H5+H2O CH3COOH+C2H5OH
=
O
酯水解时怎样断键?
酯水解时断酰氧键!
酸上羟基,醇上氢
总结:
深度思考
√
√
×
×
×
B
【例3】1mol下列有机物在 NaOH 溶液中完全水解,所需 NaOH 的量是多少?
水解后生成乙酸和甲醇,只有乙酸和 NaOH 反应,所以需要 1mol NaOH
水解后生成苯酚和丙酸,所以需要 2mol NaOH
水解得到2mol酚的羟基,1mol羧基,所以需要 3mol NaOH
【练习1】1mol有机物 与足量NaOH 溶
液充分反应,消耗NaOH 的物质的量为( )
A.5mol B.4mol C.3mol D.2mol
B
【练习2】写出下列酯对应的反应方程式。
酸性条件下的水解反应
与足量NaOH溶液反应的方程式
【练习3】现有分子式为C3H6O2的四种有机物A、B、C、D,且分子内均含有甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
NaOH溶液 银氨溶液 新制Cu(OH)2 金属钠
A 中和反应 —— 溶解 产生氢气
B —— 有银镜 产生红色沉淀 产生氢气
C 水解反应 有银镜 产生红色沉淀 ——
D 水解反应 —— —— ——
则A、B、C、D的结构简式分别为:
A:_____________B: _____
C:_____________D: _____________
CH3CH2COOH
CH3CH(OH)CHO
HCOOCH2CH3
CH3COOCH3
二、油脂
来源:高级脂肪酸
来源:甘油
油脂:高级脂肪酸与甘油形成的酯
R1、R2、R3不饱和程度高时,油脂常温下为液态,称为油;
R1、R2、R3饱和程度高时,油脂常温下为固态,称为脂肪;
天然油脂是多种高级脂肪酸与甘油形成的酯,属于混合物
2、油脂的化学性质
(1)油脂含有酯基,油脂能发生水解反应
酸性条件产物:
高级脂肪酸(难溶于水)和甘油
碱性条件产物:
高级脂肪酸盐(钠盐易溶于水)和甘油
碱性条件下油脂的水解又称为皂化反应
【思考】如何判断皂化反应已经完全?
2、油脂的化学性质
(2)当烃基含有碳碳双键时,油脂有烯烃的性质
如:油能使溴水、酸性高锰酸钾褪色
油,含有碳碳双键,易氧化而变质,不易保存
人造脂肪,便于储存和运输
与H2加成→油脂氢化(油脂的硬化)
√
√
√
×
×
1
肥皂
3、油脂的用途
(1)食用
提供能量
提供各种类型的高级脂肪酸
食用不饱和程度高的油脂更健康
(2)化工原料
肥皂、甘油、人造脂肪、脂肪酸、
乳化剂、润滑剂、炸药等
三、胺、酰胺
1、胺
R-NH2
CH3-NH2
甲胺
苯胺
三、胺、酰胺
2、酰胺
乙酰胺
苯甲酰胺
酰胺在酸或碱性存在并加热条件下可以发生水解反应(类似酯的水解)
有机合成中的应用:形成酰胺,可保护-NH2,防止其被氧化
酯化反应与酯水解反应的比较
酯 化 水 解
反应关系 催 化 剂
催化剂的 其他作用
加热方式
反应类型
NaOH中和酯水解生成的CH3COOH,提高酯的水解率
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓 硫 酸
稀H2SO4或NaOH
吸水,提高CH3COOH与C2H5OH的转化率
酒精灯火焰加热
热水浴加热
酯化反应
取代反应
水解反应
取代反应
氨、胺、酰胺和铵盐的比较。
氨 胺 酰胺 铵盐
组成元素
结构特点
化学性质
用途
N、H
C、N、H
C、O、N、H
N、H等
NH3
三角锥形
含有氨基
R-NH2
含有NH4+
含有酰胺基
具有碱性,与酸反应生成铵盐
具有碱性,与酸反应生成盐
在酸或碱存在并加热下可发生水解反应
受热易分解,
与碱共热
产生氨气
制冷剂,
生产硝酸和尿素
合成医药、
农药和染料
溶剂和化工原料
生产化肥、和炸药
归纳小结
走进奇妙的化学世界
2022-2023
选择性必修3
第三章 烃的衍生物
第四节 羧酸衍生物
回顾:乙酸与乙醇在浓硫酸加热条件下可以发生酯化反应,分析乙酸乙酯与乙酸结构上的变化。
酯:羧酸中羧基的-OH被-OR取代后的产物,官能团为:-COOR
羧酸衍生物:羧酸分子中羧基上的羟基被其他原子或原子团取代得到的产物。
酰基
酯
酰卤
R-C-
O
=
R-C-OR
O
=
R-C-X
O
=
R-C-NH2
O
=
酰胺
饱和一元酯的分子式的通式:CnH2nO2
一、酯
作溶剂
作制备饮料和糖果和糕点的酯类香料
物理性质
存在
用途
密度一般比水小
难溶于水,易溶于有机溶剂
许多酯也是常用的 有机溶剂
酯类广泛存在于自然界
低级酯是有芳香气味的液体,存在于各种水果和花草中
CH3(CH2)2C-O-CH2CH3
=
O
CH3(CH2)3C-O-(CH2)4CH3
=
O
CH3C-O-CH2CH2CHCH3
=
O
CH3
戊酸戊酯
丁酸乙酯
乙酸异戊酯
【探究】酯的化学性质
根据乙酸乙酯生成的反应,从速率及平衡的角度分析如何使乙酸乙酯逆向进行?
浓硫酸
△
CH3COOH + C2H5OH CH3COOC2H5 +H2O
浓硫酸换为稀H2SO4
浓硫酸换为NaOH溶液
加热
……
试管1 5 mL 蒸馏水 2 ml 乙酸乙酯 70℃ 试管4 5 mL 蒸馏水 2 ml 乙酸乙酯 常温
试管2 5 mL 1.5 mol/L H2SO4 2 ml 乙酸乙酯 70℃ 试管5 5 mL 1.5 mol/L H2SO4 2 ml 乙酸乙酯 常温
试管3 5 mL 3 mol/L NaOH 2 ml 乙酸乙酯 70℃ 试管6 5 mL 3 mol/L NaOH 2 ml 乙酸乙酯 常温
方案设计——探究酸碱性、温度对酯水解的影响
方法:可以通过观察酯层消失的时间差异,来判断乙酸乙酯在不同条件下的水解速率的差别。
为便于观察,乙酸乙酯经染色处理,染料不影响乙酸乙酯的水解反应
70℃
中性溶液
碱性溶液
酸性溶液
现象 结论
1
2 3 几乎无变化
酯层变薄
酯层消失
水解速率(由快到慢):
碱性溶液>酸性溶液>中性溶液
【思考与讨论】
1、为什么乙酸乙酯在酸性溶液中的水解速率大于中性溶液的水解速率?
CH3COOC2H5 +H2O
稀硫酸
△
CH3COOH + C2H5OH
无机酸作催化剂,加快反应速率
2、为什么乙酸乙酯在碱性溶液中能够水解完全?
△
CH3COOC2H5 +NaOH
CH3COONa + C2H5OH
无机碱不仅起催化作用,而且能与水解生成的羧酸发生中和反应,使平衡右移,水解程度增大,直至完全。酯在碱性条件下的水解不可逆。
上述反应的实质是什么?
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
酸性水解可逆
生成了羧酸盐,使水解反应不可逆,用“→”,也属于取代反应
酯的水解:(取代反应)
稀硫酸
△
CH3C—O—C2H5+H2O CH3COOH+C2H5OH
=
O
酯水解时怎样断键?
酯水解时断酰氧键!
酸上羟基,醇上氢
总结:
深度思考
√
√
×
×
×
B
【例3】1mol下列有机物在 NaOH 溶液中完全水解,所需 NaOH 的量是多少?
水解后生成乙酸和甲醇,只有乙酸和 NaOH 反应,所以需要 1mol NaOH
水解后生成苯酚和丙酸,所以需要 2mol NaOH
水解得到2mol酚的羟基,1mol羧基,所以需要 3mol NaOH
【练习1】1mol有机物 与足量NaOH 溶
液充分反应,消耗NaOH 的物质的量为( )
A.5mol B.4mol C.3mol D.2mol
B
【练习2】写出下列酯对应的反应方程式。
酸性条件下的水解反应
与足量NaOH溶液反应的方程式
【练习3】现有分子式为C3H6O2的四种有机物A、B、C、D,且分子内均含有甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
NaOH溶液 银氨溶液 新制Cu(OH)2 金属钠
A 中和反应 —— 溶解 产生氢气
B —— 有银镜 产生红色沉淀 产生氢气
C 水解反应 有银镜 产生红色沉淀 ——
D 水解反应 —— —— ——
则A、B、C、D的结构简式分别为:
A:_____________B: _____
C:_____________D: _____________
CH3CH2COOH
CH3CH(OH)CHO
HCOOCH2CH3
CH3COOCH3
二、油脂
来源:高级脂肪酸
来源:甘油
油脂:高级脂肪酸与甘油形成的酯
R1、R2、R3不饱和程度高时,油脂常温下为液态,称为油;
R1、R2、R3饱和程度高时,油脂常温下为固态,称为脂肪;
天然油脂是多种高级脂肪酸与甘油形成的酯,属于混合物
2、油脂的化学性质
(1)油脂含有酯基,油脂能发生水解反应
酸性条件产物:
高级脂肪酸(难溶于水)和甘油
碱性条件产物:
高级脂肪酸盐(钠盐易溶于水)和甘油
碱性条件下油脂的水解又称为皂化反应
【思考】如何判断皂化反应已经完全?
2、油脂的化学性质
(2)当烃基含有碳碳双键时,油脂有烯烃的性质
如:油能使溴水、酸性高锰酸钾褪色
油,含有碳碳双键,易氧化而变质,不易保存
人造脂肪,便于储存和运输
与H2加成→油脂氢化(油脂的硬化)
√
√
√
×
×
1
肥皂
3、油脂的用途
(1)食用
提供能量
提供各种类型的高级脂肪酸
食用不饱和程度高的油脂更健康
(2)化工原料
肥皂、甘油、人造脂肪、脂肪酸、
乳化剂、润滑剂、炸药等
三、胺、酰胺
1、胺
R-NH2
CH3-NH2
甲胺
苯胺
三、胺、酰胺
2、酰胺
乙酰胺
苯甲酰胺
酰胺在酸或碱性存在并加热条件下可以发生水解反应(类似酯的水解)
有机合成中的应用:形成酰胺,可保护-NH2,防止其被氧化
酯化反应与酯水解反应的比较
酯 化 水 解
反应关系 催 化 剂
催化剂的 其他作用
加热方式
反应类型
NaOH中和酯水解生成的CH3COOH,提高酯的水解率
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓 硫 酸
稀H2SO4或NaOH
吸水,提高CH3COOH与C2H5OH的转化率
酒精灯火焰加热
热水浴加热
酯化反应
取代反应
水解反应
取代反应
氨、胺、酰胺和铵盐的比较。
氨 胺 酰胺 铵盐
组成元素
结构特点
化学性质
用途
N、H
C、N、H
C、O、N、H
N、H等
NH3
三角锥形
含有氨基
R-NH2
含有NH4+
含有酰胺基
具有碱性,与酸反应生成铵盐
具有碱性,与酸反应生成盐
在酸或碱存在并加热下可发生水解反应
受热易分解,
与碱共热
产生氨气
制冷剂,
生产硝酸和尿素
合成医药、
农药和染料
溶剂和化工原料
生产化肥、和炸药
归纳小结
