人教版(2019)选择性必修第一册 1.1.1 反应热 焓变 课件(共30张ppt)
文档属性
| 名称 | 人教版(2019)选择性必修第一册 1.1.1 反应热 焓变 课件(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 21:29:24 | ||
图片预览









文档简介
(共30张PPT)
第一课时 反应热 焓变
第一章 化学反应的热效应
第一节 反应热
液氢-液氧
煤油-液氧
全球首款应用煤基航天煤油飞行的运载火箭。火箭发动机一般选用化学推进剂,它是由燃料和氧化剂组成的,反应后产生高温气体用于火箭推进。
如何定量计算充多少液氢才能助推火箭升空?
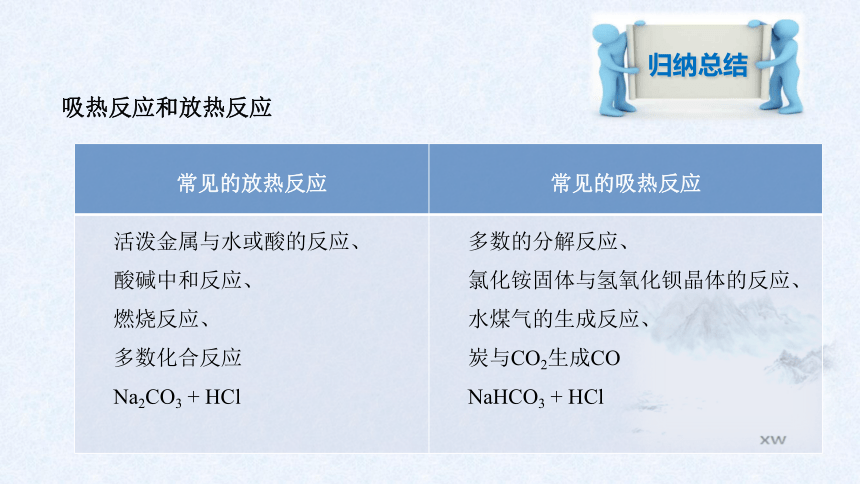
吸热反应和放热反应
问题导学
有下列常见的化学反应:①Ba(OH)2·8H2O与NH4Cl的反应
②大多数的分解反应 ③大多数的化合反应 ④铝热反应
⑤C和H2O(g)、C和CO2的反应 ⑥中和反应 ⑦可燃物的燃烧
⑧金属与酸的置换反应
其中属于放热反应的是______________(填序号,下同),
属于吸热反应的是__________。
③④⑥⑦⑧
①②⑤
复习与巩固:反应热及相关概念
吸热反应和放热反应
归纳总结
常见的放热反应 常见的吸热反应
活泼金属与水或酸的反应、 酸碱中和反应、 燃烧反应、 多数化合反应 Na2CO3 + HCl 多数的分解反应、
氯化铵固体与氢氧化钡晶体的反应、
水煤气的生成反应、
炭与CO2生成CO
NaHCO3 + HCl
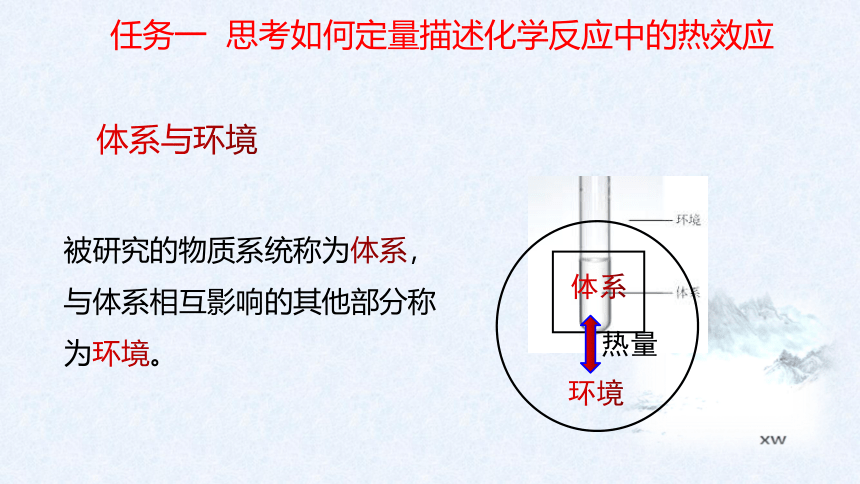
体系
环境
热量
被研究的物质系统称为体系,与体系相互影响的其他部分称为环境。
任务一 思考如何定量描述化学反应中的热效应
体系与环境
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,
称为化学反应的热效应,简称反应热。
反应前后体系的温度相等
如何准确测量一个化学反应释放或吸收的热量
方法:通过量热计直接测定
实例:中和热的测定
问题讨论
一、反应热的定义
中和热:在25℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生
中和反应生成1 mol H2O时,放出的热量.
热容和比热
在不发生化学反应和物质聚集状态不变的条件下,物质吸收热量,温度每升高1 ℃时所吸收的热量称为该物质的热容,其单位为J·℃-1。
纯物质的热容与其质量成正比。单位质量的物质的热容称为该物质的比热容,简称比热,符号为c。比热的单位为J·℃-1·g-1。常温下,液态水的比热为4.18 J·℃-1·g-1 。
资料卡片
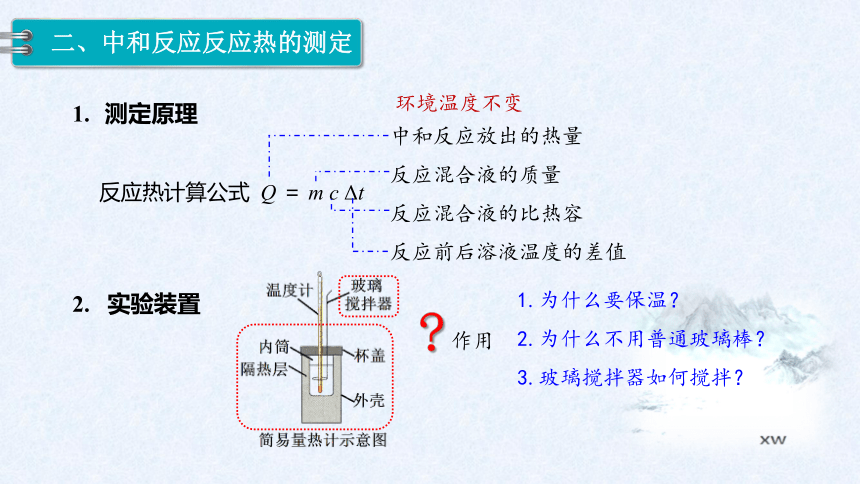
二、中和反应反应热的测定
测定原理
反应热计算公式 Q = m c Δt
中和反应放出的热量
反应混合液的质量
反应混合液的比热容
反应前后溶液温度的差值
2. 实验装置
环境温度不变
作用
1.为什么要保温?
2.为什么不用普通玻璃棒?
3.玻璃搅拌器如何搅拌?
3. 实验操作步骤
(1)反应前体系的温度:
分别测量盐酸与NaOH溶液的温度。
(2)反应后体系的温度:
迅速混合并搅拌,记录最高温度。
(3)重复操作两次
取温度差的平均值作为计算依据。
二、中和反应反应热的测定
1.为什么采用碱稍过量的方法?
2.能不能用金属搅拌器代替玻璃搅拌器?
3. 量取盐酸后的量筒能否直接量取NaOH溶液?
4.一支温度计能否测完酸后直接测量碱的温度?如何操作?
5.为什么将溶液迅速倒入内筒后,立即盖上杯盖?
6.能否将NaOH溶液分多次倒入量热计中?
思考交流
因碱会吸收空气中的CO2,为保证0.025mol盐酸完全被中和
不能。金属易导热,会造成热损
不能,反应放热,使起始温度偏高,而反应后温度偏低
不能,残留的酸会与碱反应,造成热损。
必须用水冲洗干净并用滤纸擦干后再测
减少热损
不能,迅速操作,减少热损
二、中和反应反应热的测定
n酸=0.025mol
n碱=0.0275mol
0.00418x(50+50)x(t2-t1)=0.418(t2-t1)kJ
0.418(t2-t1)/0.025 kJ·mol-1
二、中和反应反应热的测定
4. 数据处理
大量实验测得,在25℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生
中和反应生成1 mol H2O时,放出57.3 kJ的热量。
特别提醒
(1)本次实验测得数据小于57.3 kJ·mol-1,试分析产生误差可能的原因。
①量取溶液时,操作或读数不当,量取体积小于50 mL;
②量热计保温效果不好;
③溶液混合时速度不够快,或没有及时盖上杯盖;
④读取反应后温度时,过早或过晚,不是读取的最高温度。
思考交流
中和反应反应热的测定
思考交流
(2)若改用100 mL 0.50 mol·L-1的盐酸与100 mL 0.55 mol·L-1 NaOH溶液混合,所测中和反应反应热的数值是否为本实验结果的2倍?
否;中和反应反应热是指在稀溶液中强酸与强碱发生中和反应生成1 mol H2O时的反应热,其数值与反应物的量的多少无关,故所测结果应与本次实验结果基本相同。
(3)用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?
浓硫酸溶于水时放热,使所测反应热的数值偏大;弱酸、弱碱电离时吸热,使所测反应热的数值偏小。
中和反应反应热的测定
常见的量热计
保温杯式量热计
三、反应热与焓变
化学反应中为什么会有反应热?
产生
反应热
体系内能改变
焓(H)
与之有关的物理量
焓变(ΔH)
等压条件下
U
问题导入
任务二 探究化学反应热效应产生的本质原因
1. 焓和焓变
内能:体系内物质的各种能量的总和, 符号U。
焓(H):与内能有关的物理量, 用符号H表示。
焓变: ΔH=H生成物-H反应物 单位:kJ/mol或kJ·mol-1。
反应热:中学阶段认为,等压条件下化学反应的反应热等于反应的焓变
三、反应热与焓变
焓、焓变与放热反应、吸热反应的关系
放热反应
ΔH <0
焓(H)
反应物
生成物
吸热反应
ΔH >0
焓(H)
生成物
反应物
ΔH=H生成物-H反应物
2. 反应热产生的原因分析
(1)从反应体系始末状态的能量视角分析
三、反应热与焓变
436 kJ/mol
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
键能:在25 ℃和101 kPa下,断开1 mol 气态分子AB(g)中的共价键,使其生成气态原子 A(g)和 B(g)所吸收的能量。
微观分析
任务二 探究化学反应热效应产生的本质原因
能量
H2= 436 kJ/mol
H2(g)
2H(g)
H1=+436 kJ/mol
微观分析
任务二 探究化学反应热效应产生的本质原因
H2(g) + Cl2(g) 2HCl(g) H=?
吸收436 kJ + 243 kJ=679 kJ
释放431 kJ/mol×2 mol=862 kJ
H= 183 kJ/mol
任务二 探究化学反应热效应产生的本质原因
通常:ΔH=H生成物-H反应物=E反应物总键能-E生成物总键能
化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
H= 183 kJ/mol
键能估算
实验测得
H= 184.6 kJ/mol
H2(g) + Cl2(g) 2HCl(g) H= ?
任务二 探究化学反应热效应产生的本质原因
思考交流
已知:H2(g)+O2(g)===H2O(g),反应过程中的能量变化如图所示,
回答下列问题。
(1)a、b、c分别代表什么意义?
a:___________________;
b:____________________;
c:_______。
旧键断裂吸收的能量
新键形成放出的能量
反应热
(2)该反应是_____(填“放热”或“吸热”)反应,ΔH____(填“>”或“<”)0。
放热
<
三、反应热与焓变
已知:25℃,101KPa下键能:H-H:436KJ·mol-1 氧氧键:496KJ·mol-1
H-O:463KJ·mol-1 求2H2(g)+02(g)=2H2O(g) △H=_______
助推某火箭升空,其中一段路程需要氢气提供4.84×1010 KJ的能量,请问大约需要多少摩尔氢气?
-484kJ/mol
任务三 研究反应热的意义
1.0×108 mol
小 结
定量计算燃料使用量
1.下列变化为放热的化学反应的是( )
A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
D
达标检测
2.已知白磷和P4O6的分子结构如图所示,已知以下键能(kJ/mol):P-P:198,P-O:360,O=O:498则反应P4(白磷)+3O2=P4O6的反应热△H为( )A.-1638kJ/mol白磷P4O6B.+1638kJ/molC.-126kJ/molD.+126kJ/molA达标检测3.在中和反应反应热测定的实验中,下列说法正确的是
A.使用玻璃搅拌器是为了加快反应速率,减小实验误差
B.为准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.稀硫酸和稀Ba(OH)2溶液混合测得ΔH=-57.3 kJ·mol-1
D.该实验中需要使用的仪器有量筒、烧杯、酒精灯、温度计等
√
不需要酒精灯
温度计水银球测烧杯内溶液的温度,不能接触烧杯底部
还生成BaSO4沉淀,使所测反应热的数值偏大
4.正误判断
(1)ΔH的单位采用kJ·mol-1时,表示1 mol反应的焓变
(2)NaOH溶液与稀H2SO4反应的ΔH>0
(3)一个化学反应,当反应物的总能量大于生成物的总能量时,反应放热,
ΔH<0
(4)石墨转化为金刚石需要吸收能量,所以石墨更稳定
√
×
√
√
5.已知在25 ℃、101 kPa下,1 mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法正确的是
A.H2O(g)分解为H2(g)与O2(g)时放出热量
B.甲、乙、丙中物质所具有的总能量:乙>甲>丙
C.H2(g)具有的能量高于H2O(g)具有的能量
D.乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
√
分解吸热
甲→乙吸收685 kJ能量,乙>甲
乙→丙释放930 kJ能量,乙>丙
无法比较
等量的H2O(g)具有的能量高于H2O(l),乙→丙若生成液态水,放出的能量大于930 kJ
6.已知拆开 1 mol H H键、1 mol N H键、1 mol N N键所需能量分别是436 kJ、391 kJ、946 kJ,则1 mol N2(g)转化为NH3(g)时的反应热是多少?
= 946 kJ/mol + 3×436 kJ/mol 6×391 kJ/mol
= 92 kJ/mol
H(估算) =∑E (反应物键能)-∑E (生成物键能)
N2(g) + 3H2(g) 2NH3 (g) H=
第一课时 反应热 焓变
第一章 化学反应的热效应
第一节 反应热
液氢-液氧
煤油-液氧
全球首款应用煤基航天煤油飞行的运载火箭。火箭发动机一般选用化学推进剂,它是由燃料和氧化剂组成的,反应后产生高温气体用于火箭推进。
如何定量计算充多少液氢才能助推火箭升空?
吸热反应和放热反应
问题导学
有下列常见的化学反应:①Ba(OH)2·8H2O与NH4Cl的反应
②大多数的分解反应 ③大多数的化合反应 ④铝热反应
⑤C和H2O(g)、C和CO2的反应 ⑥中和反应 ⑦可燃物的燃烧
⑧金属与酸的置换反应
其中属于放热反应的是______________(填序号,下同),
属于吸热反应的是__________。
③④⑥⑦⑧
①②⑤
复习与巩固:反应热及相关概念
吸热反应和放热反应
归纳总结
常见的放热反应 常见的吸热反应
活泼金属与水或酸的反应、 酸碱中和反应、 燃烧反应、 多数化合反应 Na2CO3 + HCl 多数的分解反应、
氯化铵固体与氢氧化钡晶体的反应、
水煤气的生成反应、
炭与CO2生成CO
NaHCO3 + HCl
体系
环境
热量
被研究的物质系统称为体系,与体系相互影响的其他部分称为环境。
任务一 思考如何定量描述化学反应中的热效应
体系与环境
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,
称为化学反应的热效应,简称反应热。
反应前后体系的温度相等
如何准确测量一个化学反应释放或吸收的热量
方法:通过量热计直接测定
实例:中和热的测定
问题讨论
一、反应热的定义
中和热:在25℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生
中和反应生成1 mol H2O时,放出的热量.
热容和比热
在不发生化学反应和物质聚集状态不变的条件下,物质吸收热量,温度每升高1 ℃时所吸收的热量称为该物质的热容,其单位为J·℃-1。
纯物质的热容与其质量成正比。单位质量的物质的热容称为该物质的比热容,简称比热,符号为c。比热的单位为J·℃-1·g-1。常温下,液态水的比热为4.18 J·℃-1·g-1 。
资料卡片
二、中和反应反应热的测定
测定原理
反应热计算公式 Q = m c Δt
中和反应放出的热量
反应混合液的质量
反应混合液的比热容
反应前后溶液温度的差值
2. 实验装置
环境温度不变
作用
1.为什么要保温?
2.为什么不用普通玻璃棒?
3.玻璃搅拌器如何搅拌?
3. 实验操作步骤
(1)反应前体系的温度:
分别测量盐酸与NaOH溶液的温度。
(2)反应后体系的温度:
迅速混合并搅拌,记录最高温度。
(3)重复操作两次
取温度差的平均值作为计算依据。
二、中和反应反应热的测定
1.为什么采用碱稍过量的方法?
2.能不能用金属搅拌器代替玻璃搅拌器?
3. 量取盐酸后的量筒能否直接量取NaOH溶液?
4.一支温度计能否测完酸后直接测量碱的温度?如何操作?
5.为什么将溶液迅速倒入内筒后,立即盖上杯盖?
6.能否将NaOH溶液分多次倒入量热计中?
思考交流
因碱会吸收空气中的CO2,为保证0.025mol盐酸完全被中和
不能。金属易导热,会造成热损
不能,反应放热,使起始温度偏高,而反应后温度偏低
不能,残留的酸会与碱反应,造成热损。
必须用水冲洗干净并用滤纸擦干后再测
减少热损
不能,迅速操作,减少热损
二、中和反应反应热的测定
n酸=0.025mol
n碱=0.0275mol
0.00418x(50+50)x(t2-t1)=0.418(t2-t1)kJ
0.418(t2-t1)/0.025 kJ·mol-1
二、中和反应反应热的测定
4. 数据处理
大量实验测得,在25℃和101 kPa下,强酸的稀溶液与强碱的稀溶液发生
中和反应生成1 mol H2O时,放出57.3 kJ的热量。
特别提醒
(1)本次实验测得数据小于57.3 kJ·mol-1,试分析产生误差可能的原因。
①量取溶液时,操作或读数不当,量取体积小于50 mL;
②量热计保温效果不好;
③溶液混合时速度不够快,或没有及时盖上杯盖;
④读取反应后温度时,过早或过晚,不是读取的最高温度。
思考交流
中和反应反应热的测定
思考交流
(2)若改用100 mL 0.50 mol·L-1的盐酸与100 mL 0.55 mol·L-1 NaOH溶液混合,所测中和反应反应热的数值是否为本实验结果的2倍?
否;中和反应反应热是指在稀溶液中强酸与强碱发生中和反应生成1 mol H2O时的反应热,其数值与反应物的量的多少无关,故所测结果应与本次实验结果基本相同。
(3)用浓硫酸代替盐酸对结果会产生什么影响?用醋酸代替盐酸对结果会产生什么影响?
浓硫酸溶于水时放热,使所测反应热的数值偏大;弱酸、弱碱电离时吸热,使所测反应热的数值偏小。
中和反应反应热的测定
常见的量热计
保温杯式量热计
三、反应热与焓变
化学反应中为什么会有反应热?
产生
反应热
体系内能改变
焓(H)
与之有关的物理量
焓变(ΔH)
等压条件下
U
问题导入
任务二 探究化学反应热效应产生的本质原因
1. 焓和焓变
内能:体系内物质的各种能量的总和, 符号U。
焓(H):与内能有关的物理量, 用符号H表示。
焓变: ΔH=H生成物-H反应物 单位:kJ/mol或kJ·mol-1。
反应热:中学阶段认为,等压条件下化学反应的反应热等于反应的焓变
三、反应热与焓变
焓、焓变与放热反应、吸热反应的关系
放热反应
ΔH <0
焓(H)
反应物
生成物
吸热反应
ΔH >0
焓(H)
生成物
反应物
ΔH=H生成物-H反应物
2. 反应热产生的原因分析
(1)从反应体系始末状态的能量视角分析
三、反应热与焓变
436 kJ/mol
H
H
H
H
键断裂,吸收能量
键形成,释放能量
436 kJ/mol
键能:在25 ℃和101 kPa下,断开1 mol 气态分子AB(g)中的共价键,使其生成气态原子 A(g)和 B(g)所吸收的能量。
微观分析
任务二 探究化学反应热效应产生的本质原因
能量
H2= 436 kJ/mol
H2(g)
2H(g)
H1=+436 kJ/mol
微观分析
任务二 探究化学反应热效应产生的本质原因
H2(g) + Cl2(g) 2HCl(g) H=?
吸收436 kJ + 243 kJ=679 kJ
释放431 kJ/mol×2 mol=862 kJ
H= 183 kJ/mol
任务二 探究化学反应热效应产生的本质原因
通常:ΔH=H生成物-H反应物=E反应物总键能-E生成物总键能
化学键断裂和形成时的能量变化是化学反应中能量变化的主要原因。
H= 183 kJ/mol
键能估算
实验测得
H= 184.6 kJ/mol
H2(g) + Cl2(g) 2HCl(g) H= ?
任务二 探究化学反应热效应产生的本质原因
思考交流
已知:H2(g)+O2(g)===H2O(g),反应过程中的能量变化如图所示,
回答下列问题。
(1)a、b、c分别代表什么意义?
a:___________________;
b:____________________;
c:_______。
旧键断裂吸收的能量
新键形成放出的能量
反应热
(2)该反应是_____(填“放热”或“吸热”)反应,ΔH____(填“>”或“<”)0。
放热
<
三、反应热与焓变
已知:25℃,101KPa下键能:H-H:436KJ·mol-1 氧氧键:496KJ·mol-1
H-O:463KJ·mol-1 求2H2(g)+02(g)=2H2O(g) △H=_______
助推某火箭升空,其中一段路程需要氢气提供4.84×1010 KJ的能量,请问大约需要多少摩尔氢气?
-484kJ/mol
任务三 研究反应热的意义
1.0×108 mol
小 结
定量计算燃料使用量
1.下列变化为放热的化学反应的是( )
A.H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
B.2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如图所示的化学反应
D
达标检测
2.已知白磷和P4O6的分子结构如图所示,已知以下键能(kJ/mol):P-P:198,P-O:360,O=O:498则反应P4(白磷)+3O2=P4O6的反应热△H为( )A.-1638kJ/mol白磷P4O6B.+1638kJ/molC.-126kJ/molD.+126kJ/molA达标检测3.在中和反应反应热测定的实验中,下列说法正确的是
A.使用玻璃搅拌器是为了加快反应速率,减小实验误差
B.为准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.稀硫酸和稀Ba(OH)2溶液混合测得ΔH=-57.3 kJ·mol-1
D.该实验中需要使用的仪器有量筒、烧杯、酒精灯、温度计等
√
不需要酒精灯
温度计水银球测烧杯内溶液的温度,不能接触烧杯底部
还生成BaSO4沉淀,使所测反应热的数值偏大
4.正误判断
(1)ΔH的单位采用kJ·mol-1时,表示1 mol反应的焓变
(2)NaOH溶液与稀H2SO4反应的ΔH>0
(3)一个化学反应,当反应物的总能量大于生成物的总能量时,反应放热,
ΔH<0
(4)石墨转化为金刚石需要吸收能量,所以石墨更稳定
√
×
√
√
5.已知在25 ℃、101 kPa下,1 mol氢气在氧气中燃烧生成气态水的能量变化如图所示,下列有关说法正确的是
A.H2O(g)分解为H2(g)与O2(g)时放出热量
B.甲、乙、丙中物质所具有的总能量:乙>甲>丙
C.H2(g)具有的能量高于H2O(g)具有的能量
D.乙→丙的过程中若生成液态水,释放的能量将小于930 kJ
√
分解吸热
甲→乙吸收685 kJ能量,乙>甲
乙→丙释放930 kJ能量,乙>丙
无法比较
等量的H2O(g)具有的能量高于H2O(l),乙→丙若生成液态水,放出的能量大于930 kJ
6.已知拆开 1 mol H H键、1 mol N H键、1 mol N N键所需能量分别是436 kJ、391 kJ、946 kJ,则1 mol N2(g)转化为NH3(g)时的反应热是多少?
= 946 kJ/mol + 3×436 kJ/mol 6×391 kJ/mol
= 92 kJ/mol
H(估算) =∑E (反应物键能)-∑E (生成物键能)
N2(g) + 3H2(g) 2NH3 (g) H=
