1.1.1 反应热 课件(共27张PPT)人教版(2019)选择性必修第一册
文档属性
| 名称 | 1.1.1 反应热 课件(共27张PPT)人教版(2019)选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 18:37:44 | ||
图片预览







文档简介
(共27张PPT)
课时1
反应热及其测定
第一节 反应热
01
学习目标
CONTENT
反应热的概念
02
反应热的测定
03
反应热测定的注意事项
是什么力量让火箭足以将自身和搭载的探测器一并托起呢?
新课导入
液氢-液氧
煤油-液氧
火箭发动机一般选用化学推进剂,它是由燃料和氧化剂组成的,反应后产生高温气体用于火箭推进。
长征五号布局结构
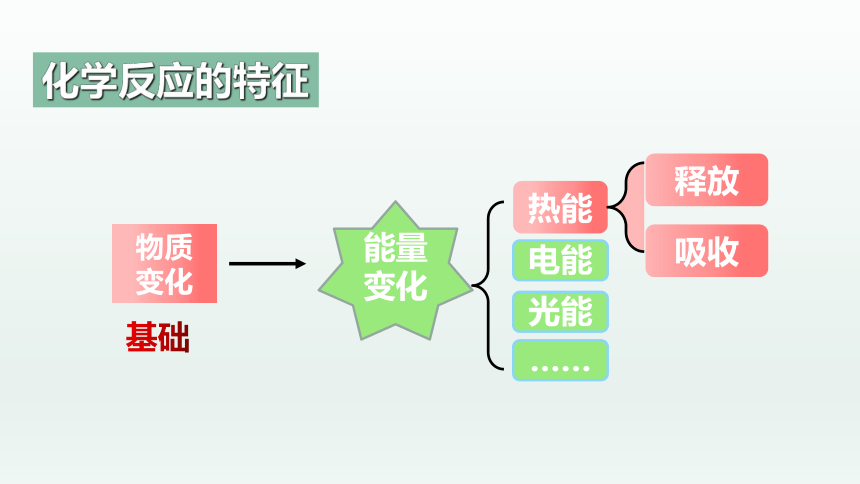
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
化学反应的特征
自热食品利用化学反应
放出的热量加热食物
目前市面上的“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物(发热包主要成分)。使用时打开隔离层,即发生以下反应:Mg+2H2O═Mg(OH)2+H2↑ 。
化学能
热能
如何定量描述
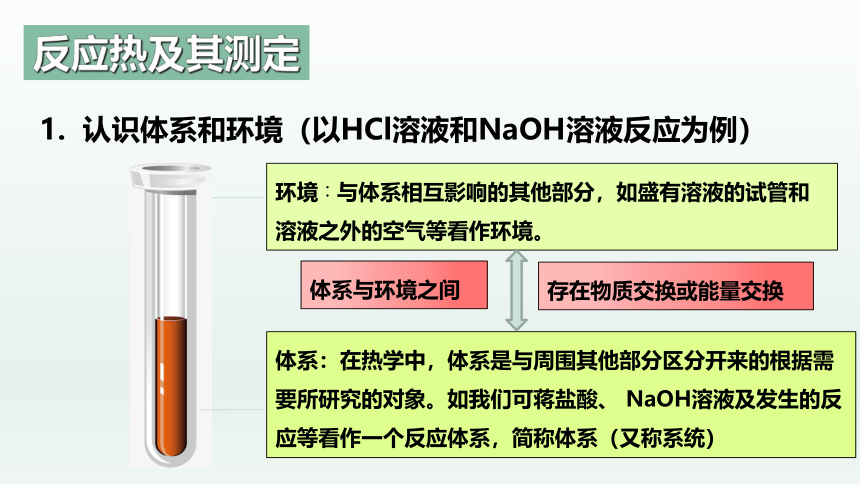
环境∶与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等看作环境。
体系:在热学中,体系是与周围其他部分区分开来的根据需要所研究的对象。如我们可蒋盐酸、 NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)
体系与环境之间
存在物质交换或能量交换
1. 认识体系和环境(以HCl溶液和NaOH溶液反应为例)
反应热及其测定
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
等温:指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。
反应热
许多反应热可以通过量热计直接测定。在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热。
Q = mCΔt
Q:放出的热量。m:反应混合液的质量。
C:反应混合液的比热容。Δt:反应前后溶液温度的差值
反应热的测定
使反应物迅速混合,使反应充分进行,保持体系的温度均匀。
测量反应前后体系的温度
反应容器
减少热量散失,
降低实验误差。
减少热量散失,降低实验误差。
量热计
【提出问题】
在测定中和反应的反应热时,应该测量哪些数据?如何根据测得的数据计算反应热?为了提高测定的准确度,应该采取哪些措施?
实验探究 —— 中和反应反应热的测定
(1)反应物温度的测量。
①用量筒量取50mL 0.50mol/L盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取50mL 0.55mol/L NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
实验探究 —— 中和反应反应热的测定
(2)反应后体系温度的测量。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖, 插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将______温度记为反应后体系的温度(t2)。
(3)重复上述步骤(1)至步骤(2)两次。
最高
图1-3 简易量热计示意图
实验探究 —— 中和反应反应热的测定
【数据处理】
(1)取盐酸温度和NaOH溶液温度的______记为反应前体系的温度(t1)。计算温度差(t2 - t1),将数据填入下表。
平均值
实验次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1 / ℃ t2/ ℃ (t2 - t1)/ ℃
1 26.2 26.0
2 25.9 25.9
3 26.4 26.2
26.1
25.9
26.3
29.5
29.4
29.6
3.4
3.5
3.3
实验探究 —— 中和反应反应热的测定
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
【分析】为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:Q=(m1+m2)·c·(t2-t1)*10-3kj
①50 mL0.50 mol/L盐酸的质量m1= g, 50 mL0.55mol/L NaOH溶液的质量m2= g。
②反应后生成的溶液的比热容c = 4.18 J/(g ·℃),50 mL 0.50 mol/L盐酸与 50 mL0.55 mol/L NaOH溶液发生中和反应时放出的热量为:1.4212kj
实验探究 —— 中和反应反应热的测定
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
③生成1mol H2O时放出的热量为
【注意】大量实验测得,在250C和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1molH2O时,放出57.3kJ的热量。
中和热
kJ
实验探究 —— 中和反应反应热的测定
为了准确测出升高的温度,实验过程中已采取了哪些措施?
1.使用碎泡沫塑料、盖板等做隔热材料,减少热量损失;
2.使用玻璃搅拌棒匀速搅拌,保证反应完全;
3.混合两种反应物时动作迅速、操作规范;
4.重复三次实验,减少误差。
【思考与讨论】
导致中和反应反应热测定存在误差的原因有哪些?
①量取溶液的体积不准确。
②温度计读数有误(如未读取到混合溶液的最高温度,就记为终止温度)。
③实验过程中有液体溅出。
④混合酸、碱溶液时,动作缓慢。
【思考与讨论】
导致中和反应反应热测定存在误差的原因有哪些?
⑤隔热层隔热效果不好,实验过程中有热量损失。
⑥测过酸溶液的温度计未用水清洗便立即去测碱溶液的温度。
⑦溶液浓度不准确。
⑧没有进行重复实验。
【思考与讨论】
1.能否用浓硫酸代替盐酸?对结果会产生什么影响?
不能。浓硫酸溶解于水时放热,所测数值会偏大。
2.能否测完酸后直接测量碱的温度?那如何操作?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失。测定一种溶液后必须用水冲洗干净并用滤纸擦干再测别的溶液。
3.能否将NaOH分多次倒入热量计中?
不能,操作时动作要快,尽量减少热量的散失
【思考与讨论】
为了保证盐酸完全被中和
4.为什么NaOH的浓度稍稍比酸大?
5.玻璃搅拌棒能否用金属搅拌棒代替?
不能。原因是金属质搅拌器易导热,造成实验过程中热量损失。
6.如果某一次实验的数据与另外两次实验的数据差异明显,怎么办?
将差异明显的数据舍去。
【思考与讨论】
大量实验测得,在25℃和101kpa下强酸稀溶液与强碱稀溶液发生中和反应生成1mol水时,放出57.3kJ的热量
弱酸弱碱稀溶液,因为电离吸热,故生成1molH2O放热 < 57.3 kJ
强酸强碱浓溶液,因为稀释放热,故生成1molH2O放热 >57.3 kJ
拓展提升
课堂小结
1.某同学通过实验测出稀盐酸与稀NaOH溶液(碱稍微过量)反应的中和热ΔH=-52.3 kJ·mol ,造成这一结果的原因不可能是 ( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
B
【课堂练习】
2.将V1 mL 1.0 mol·L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是 ( )
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
B
【课堂练习】
3.用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列关于实验和中和反应的说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.中和反应的逆反应是吸热反应
D.在25 ℃和101 kPa下,强酸和强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ·mol-1的热量
C
【课堂练习】
4、50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1
NaOH溶液在如图所示的装置中进行中和反应。通过
测定反应过程中所放出的热量可计算中和反应反应热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器
是_________________。
(2)如果不盖杯盖,所求得的中和反应反应热的绝对值
将会__________(填“偏大”“偏小”或“无影响” )。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验________(填“相等”或“不相等”,下同);所求生成1molH2O放出的热与原实验________,简述理由:_________________________________________________。
环形玻璃搅拌器
偏小
不相等
相等
生成1 mol水时的放出的热,与酸碱的用量无关
【课堂练习】
课时1
反应热及其测定
第一节 反应热
01
学习目标
CONTENT
反应热的概念
02
反应热的测定
03
反应热测定的注意事项
是什么力量让火箭足以将自身和搭载的探测器一并托起呢?
新课导入
液氢-液氧
煤油-液氧
火箭发动机一般选用化学推进剂,它是由燃料和氧化剂组成的,反应后产生高温气体用于火箭推进。
长征五号布局结构
能量变化
物质
变化
基础
热能
电能
光能
……
吸收
释放
化学反应的特征
自热食品利用化学反应
放出的热量加热食物
目前市面上的“即热饭盒”,其原理是在饭盒底部有两层,一层存放水,另一层存放镁和铁的混合物(发热包主要成分)。使用时打开隔离层,即发生以下反应:Mg+2H2O═Mg(OH)2+H2↑ 。
化学能
热能
如何定量描述
环境∶与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等看作环境。
体系:在热学中,体系是与周围其他部分区分开来的根据需要所研究的对象。如我们可蒋盐酸、 NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)
体系与环境之间
存在物质交换或能量交换
1. 认识体系和环境(以HCl溶液和NaOH溶液反应为例)
反应热及其测定
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
等温:指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。
反应热
许多反应热可以通过量热计直接测定。在反应前后,如果环境的温度没有变化,则反应放出的热量就会使体系的温度升高,这时可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热。
Q = mCΔt
Q:放出的热量。m:反应混合液的质量。
C:反应混合液的比热容。Δt:反应前后溶液温度的差值
反应热的测定
使反应物迅速混合,使反应充分进行,保持体系的温度均匀。
测量反应前后体系的温度
反应容器
减少热量散失,
降低实验误差。
减少热量散失,降低实验误差。
量热计
【提出问题】
在测定中和反应的反应热时,应该测量哪些数据?如何根据测得的数据计算反应热?为了提高测定的准确度,应该采取哪些措施?
实验探究 —— 中和反应反应热的测定
(1)反应物温度的测量。
①用量筒量取50mL 0.50mol/L盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取50mL 0.55mol/L NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
实验探究 —— 中和反应反应热的测定
(2)反应后体系温度的测量。
打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖, 插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将______温度记为反应后体系的温度(t2)。
(3)重复上述步骤(1)至步骤(2)两次。
最高
图1-3 简易量热计示意图
实验探究 —— 中和反应反应热的测定
【数据处理】
(1)取盐酸温度和NaOH溶液温度的______记为反应前体系的温度(t1)。计算温度差(t2 - t1),将数据填入下表。
平均值
实验次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1 / ℃ t2/ ℃ (t2 - t1)/ ℃
1 26.2 26.0
2 25.9 25.9
3 26.4 26.2
26.1
25.9
26.3
29.5
29.4
29.6
3.4
3.5
3.3
实验探究 —— 中和反应反应热的测定
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
【分析】为了计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:Q=(m1+m2)·c·(t2-t1)*10-3kj
①50 mL0.50 mol/L盐酸的质量m1= g, 50 mL0.55mol/L NaOH溶液的质量m2= g。
②反应后生成的溶液的比热容c = 4.18 J/(g ·℃),50 mL 0.50 mol/L盐酸与 50 mL0.55 mol/L NaOH溶液发生中和反应时放出的热量为:1.4212kj
实验探究 —— 中和反应反应热的测定
(2)取三次测量所得温度差的平均值作为计算依据。
(3)根据温度差和比热容等计算反应热。
③生成1mol H2O时放出的热量为
【注意】大量实验测得,在250C和101kPa下,强酸的稀溶液与强碱的稀溶液发生中和反应生成1molH2O时,放出57.3kJ的热量。
中和热
kJ
实验探究 —— 中和反应反应热的测定
为了准确测出升高的温度,实验过程中已采取了哪些措施?
1.使用碎泡沫塑料、盖板等做隔热材料,减少热量损失;
2.使用玻璃搅拌棒匀速搅拌,保证反应完全;
3.混合两种反应物时动作迅速、操作规范;
4.重复三次实验,减少误差。
【思考与讨论】
导致中和反应反应热测定存在误差的原因有哪些?
①量取溶液的体积不准确。
②温度计读数有误(如未读取到混合溶液的最高温度,就记为终止温度)。
③实验过程中有液体溅出。
④混合酸、碱溶液时,动作缓慢。
【思考与讨论】
导致中和反应反应热测定存在误差的原因有哪些?
⑤隔热层隔热效果不好,实验过程中有热量损失。
⑥测过酸溶液的温度计未用水清洗便立即去测碱溶液的温度。
⑦溶液浓度不准确。
⑧没有进行重复实验。
【思考与讨论】
1.能否用浓硫酸代替盐酸?对结果会产生什么影响?
不能。浓硫酸溶解于水时放热,所测数值会偏大。
2.能否测完酸后直接测量碱的温度?那如何操作?
不能,残留的酸与碱反应,造成酸碱消耗,热量损失。测定一种溶液后必须用水冲洗干净并用滤纸擦干再测别的溶液。
3.能否将NaOH分多次倒入热量计中?
不能,操作时动作要快,尽量减少热量的散失
【思考与讨论】
为了保证盐酸完全被中和
4.为什么NaOH的浓度稍稍比酸大?
5.玻璃搅拌棒能否用金属搅拌棒代替?
不能。原因是金属质搅拌器易导热,造成实验过程中热量损失。
6.如果某一次实验的数据与另外两次实验的数据差异明显,怎么办?
将差异明显的数据舍去。
【思考与讨论】
大量实验测得,在25℃和101kpa下强酸稀溶液与强碱稀溶液发生中和反应生成1mol水时,放出57.3kJ的热量
弱酸弱碱稀溶液,因为电离吸热,故生成1molH2O放热 < 57.3 kJ
强酸强碱浓溶液,因为稀释放热,故生成1molH2O放热 >57.3 kJ
拓展提升
课堂小结
1.某同学通过实验测出稀盐酸与稀NaOH溶液(碱稍微过量)反应的中和热ΔH=-52.3 kJ·mol ,造成这一结果的原因不可能是 ( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
B
【课堂练习】
2.将V1 mL 1.0 mol·L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是 ( )
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
B
【课堂练习】
3.用50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列关于实验和中和反应的说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.中和反应的逆反应是吸热反应
D.在25 ℃和101 kPa下,强酸和强碱的稀溶液发生中和反应生成1 mol H2O时,放出57.3 kJ·mol-1的热量
C
【课堂练习】
4、50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1
NaOH溶液在如图所示的装置中进行中和反应。通过
测定反应过程中所放出的热量可计算中和反应反应热。
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器
是_________________。
(2)如果不盖杯盖,所求得的中和反应反应热的绝对值
将会__________(填“偏大”“偏小”或“无影响” )。
(3)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,调整反应物用量后所放出的热量与原实验________(填“相等”或“不相等”,下同);所求生成1molH2O放出的热与原实验________,简述理由:_________________________________________________。
环形玻璃搅拌器
偏小
不相等
相等
生成1 mol水时的放出的热,与酸碱的用量无关
【课堂练习】
