2.1.2 化学反应的速率限度 课件(共20张PPT)人教版(2019)选择性必修第一册
文档属性
| 名称 | 2.1.2 化学反应的速率限度 课件(共20张PPT)人教版(2019)选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 20.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 18:40:49 | ||
图片预览






文档简介
(共20张PPT)
化学反应的速率与限度(第二课时)
混合
取少量稀释
加淀粉
加KSCN
某同学根据Fe3+具有氧化性,I 具有还原性,推测发生了反应:2Fe3+ + 2I = 2Fe2+ + I2,并设计实验进行验证,实验操作如下:
环节一:发现化学反应的限度
【思考】溶液中为何会有Fe3+?
【追问】如何避免Fe3+对检验Fe2+的干扰?
①Fe3+过量
②反应时间太短
①I-大大过量
②延长反应时间
③ Fe2+被O2氧化
③加苯隔绝空气
资料卡:苯是一种密度比水小、不溶于水的有机溶剂。
滴加几滴
FeCl3
加入苯
静置24h
用长滴管向下层溶液挤入KSCN
实验试剂:0.1 mol/L KI、 0.1 mol/L FeCl3、KSCN溶液、苯
2Fe3+ + 2I 2Fe2+ + I2
结论: 该反应为可逆反应,具有一定的限度。
5mL KI溶液
环节二:再认识可逆反应
1.定义:在相同条件下既能向正反应方向进行,
又能向逆反应方向进行的反应。
双同性——同一条件、同时进行
双向性——“ ”
共存性——反应物、生存物共存
2.特征:
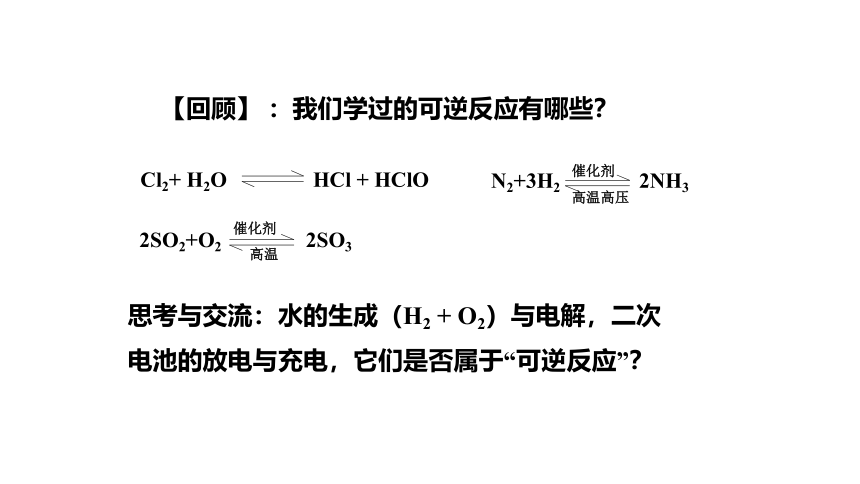
【回顾】 :我们学过的可逆反应有哪些?
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
Cl2+ H2O HCl + HClO
思考与交流:水的生成(H2 + O2)与电解,二次电池的放电与充电,它们是否属于“可逆反应”?
【问题解决】在一密闭容器中通入SO2和只由18O组成的氧气(18O2), 发生反应 ,一段时间后, 18O存在于( )
2SO2+O2 2SO3
D
A. 只存在于O2中
B. 只存在于O2和SO2中
C. 只存在于SO2和SO3中
D. 存在于SO2、O2、SO3中
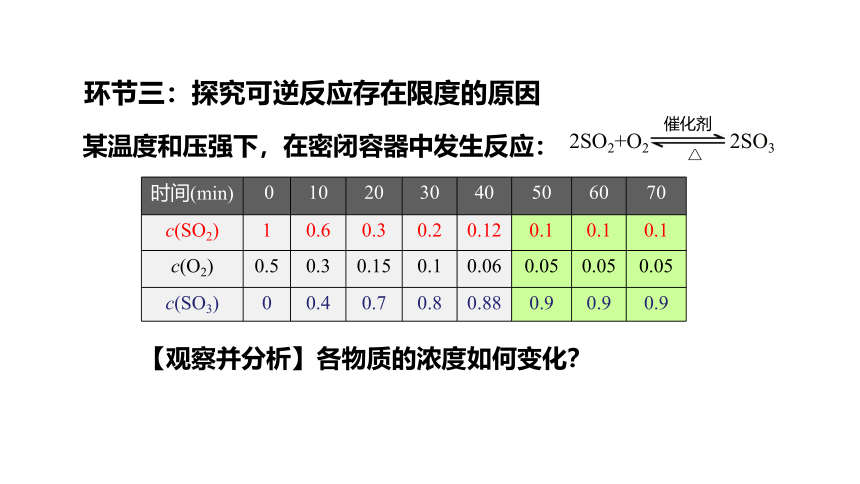
环节三:探究可逆反应存在限度的原因
某温度和压强下,在密闭容器中发生反应:
2SO2+O2 2SO3
催化剂
△
时间(min) 0 10 20 30 40 50 60 70
c(SO2) 1 0.6 0.3 0.2 0.12 0.1 0.1 0.1
c(O2) 0.5 0.3 0.15 0.1 0.06 0.05 0.05 0.05
c(SO3) 0 0.4 0.7 0.8 0.88 0.9 0.9 0.9
【观察并分析】各物质的浓度如何变化?
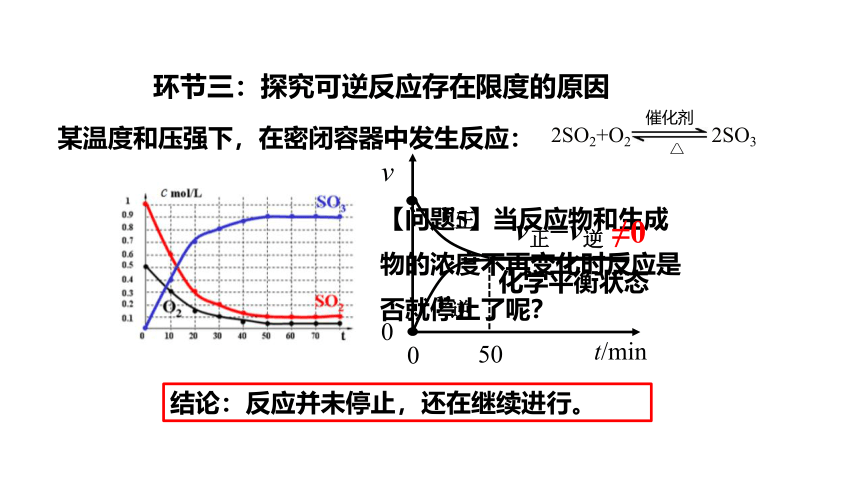
【问题5】当反应物和生成物的浓度不再变化时反应是否就停止了呢?
某温度和压强下,在密闭容器中发生反应:
2SO2+O2 2SO3
催化剂
△
环节三:探究可逆反应存在限度的原因
50
v正
v逆
v正=v逆
≠0
0
t/min
v
0
结论:反应并未停止,还在继续进行。
化学平衡状态
环节四:认识并判断化学平衡状态
对象:可逆反应
本质:v正=v逆≠0
标志:浓度不变
逆
等
动
定
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变,到达一种表面静止的状态,称为“化学平衡状态”,简称化学平衡。
化学平衡状态
特征
【方法归纳】判断化学平衡状态
(1)内在本质——正、逆反应速率相等
如aA+bB cC + dD,
v正(A)=v逆(A)
v正(A)∶v逆(B)= a ∶ b
(2)外在标志——根据各组分的浓度保持不变
【问题解决】在恒容密闭容器中投入SO2和O2,可说明反应 达到化学平衡状态的是( )
A. v正(SO2) = v逆(O2)
B. 单位时间内生成n mol SO3同时消耗n mol SO2
C. SO2浓度不再改变
D. SO2、 O2、 SO3的物质的量浓度之比为2∶1 ∶2
2SO2 +O2 2SO3
C
【追问】在恒容密闭容器中按物质的量2:1投入SO2和O2,一段时间后,SO2、 O2、 SO3的物质的量浓度之比为2∶1 ∶2,能否说明反应 达到化学平衡状态的是?
2SO2 +O2 2SO3
哈伯:锇作催化剂, 500~600℃, 17.5MPa~20.0MPa ,得到超过6%的氨。
【交流与思考】
博施:找到了合适的催化剂、完善了高压反应器,建成了第一座合成氨工厂。
【化学史话】合成氨的发展
现代工业合成氨:铁为主体的催化剂,400~500℃,10MPa~30MPa。
哈伯与能斯特的实验条件有何相似之处?
哈伯为什么能获得更多氨气?
现在工业合成氨为什么不选择更低的
温度和更高的压强来提高氨的产率?
能斯特:铂粉、锰作催化剂, 685℃,5MPa,得到 0.96%的氨。
化学平衡状态的特征
化学平衡状态
对象:可逆反应
本质:v正=v逆≠0
标志:含量不变
是可以改变的
逆
等
动
定
变
环节五:控制“化学反应条件”
1、目的:①促进有利的化学反应
②抑制有害的化学反应
2、方法:改变速率、限度
【交流与讨论】
为提高燃料的燃烧效率,应如何调控燃烧反应的条件?
(提示:可以从以下几方面考虑,如燃料的状态、空气用量、炉膛材料、烟道废气中热能的利用等等。)
燃煤状态 空气用量 炉膛材料 烟道废气中热能的利用
措施 煤粉代替煤块 空气充足 保温、隔热、耐热 预热通入
的空气
原因 燃烧充分,加快反应 充分燃烧放热多 减少热量的损失 对废气热能
再利用
讨论结果:
【科学史话】炼铁高炉尾气之谜
炼铁工程师发现在工业炼铁过程中,炼铁炉排出的尾气中含有一定量的 CO,并认为是CO 与原料接触时间不够导致,为此耗巨资增加高炉的高度来解决问题,然而,令人惊讶的是并未减少高炉中 CO 的含量。
Fe2O3+3CO 2Fe+3CO
C + CO2 2CO
课堂小结
化学反应速率
化学反应限度
(化学平衡)
v正=v逆
反应条件控制
温度
浓度
催化剂
……
温度
浓度
压强
……
调控
影响
调控
影响
逆、等、动、定、变
特征
化学反应的速率与限度(第二课时)
混合
取少量稀释
加淀粉
加KSCN
某同学根据Fe3+具有氧化性,I 具有还原性,推测发生了反应:2Fe3+ + 2I = 2Fe2+ + I2,并设计实验进行验证,实验操作如下:
环节一:发现化学反应的限度
【思考】溶液中为何会有Fe3+?
【追问】如何避免Fe3+对检验Fe2+的干扰?
①Fe3+过量
②反应时间太短
①I-大大过量
②延长反应时间
③ Fe2+被O2氧化
③加苯隔绝空气
资料卡:苯是一种密度比水小、不溶于水的有机溶剂。
滴加几滴
FeCl3
加入苯
静置24h
用长滴管向下层溶液挤入KSCN
实验试剂:0.1 mol/L KI、 0.1 mol/L FeCl3、KSCN溶液、苯
2Fe3+ + 2I 2Fe2+ + I2
结论: 该反应为可逆反应,具有一定的限度。
5mL KI溶液
环节二:再认识可逆反应
1.定义:在相同条件下既能向正反应方向进行,
又能向逆反应方向进行的反应。
双同性——同一条件、同时进行
双向性——“ ”
共存性——反应物、生存物共存
2.特征:
【回顾】 :我们学过的可逆反应有哪些?
N2+3H2 2NH3
催化剂
高温高压
2SO2+O2 2SO3
催化剂
高温
Cl2+ H2O HCl + HClO
思考与交流:水的生成(H2 + O2)与电解,二次电池的放电与充电,它们是否属于“可逆反应”?
【问题解决】在一密闭容器中通入SO2和只由18O组成的氧气(18O2), 发生反应 ,一段时间后, 18O存在于( )
2SO2+O2 2SO3
D
A. 只存在于O2中
B. 只存在于O2和SO2中
C. 只存在于SO2和SO3中
D. 存在于SO2、O2、SO3中
环节三:探究可逆反应存在限度的原因
某温度和压强下,在密闭容器中发生反应:
2SO2+O2 2SO3
催化剂
△
时间(min) 0 10 20 30 40 50 60 70
c(SO2) 1 0.6 0.3 0.2 0.12 0.1 0.1 0.1
c(O2) 0.5 0.3 0.15 0.1 0.06 0.05 0.05 0.05
c(SO3) 0 0.4 0.7 0.8 0.88 0.9 0.9 0.9
【观察并分析】各物质的浓度如何变化?
【问题5】当反应物和生成物的浓度不再变化时反应是否就停止了呢?
某温度和压强下,在密闭容器中发生反应:
2SO2+O2 2SO3
催化剂
△
环节三:探究可逆反应存在限度的原因
50
v正
v逆
v正=v逆
≠0
0
t/min
v
0
结论:反应并未停止,还在继续进行。
化学平衡状态
环节四:认识并判断化学平衡状态
对象:可逆反应
本质:v正=v逆≠0
标志:浓度不变
逆
等
动
定
在一定条件下的可逆反应中,当正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变,到达一种表面静止的状态,称为“化学平衡状态”,简称化学平衡。
化学平衡状态
特征
【方法归纳】判断化学平衡状态
(1)内在本质——正、逆反应速率相等
如aA+bB cC + dD,
v正(A)=v逆(A)
v正(A)∶v逆(B)= a ∶ b
(2)外在标志——根据各组分的浓度保持不变
【问题解决】在恒容密闭容器中投入SO2和O2,可说明反应 达到化学平衡状态的是( )
A. v正(SO2) = v逆(O2)
B. 单位时间内生成n mol SO3同时消耗n mol SO2
C. SO2浓度不再改变
D. SO2、 O2、 SO3的物质的量浓度之比为2∶1 ∶2
2SO2 +O2 2SO3
C
【追问】在恒容密闭容器中按物质的量2:1投入SO2和O2,一段时间后,SO2、 O2、 SO3的物质的量浓度之比为2∶1 ∶2,能否说明反应 达到化学平衡状态的是?
2SO2 +O2 2SO3
哈伯:锇作催化剂, 500~600℃, 17.5MPa~20.0MPa ,得到超过6%的氨。
【交流与思考】
博施:找到了合适的催化剂、完善了高压反应器,建成了第一座合成氨工厂。
【化学史话】合成氨的发展
现代工业合成氨:铁为主体的催化剂,400~500℃,10MPa~30MPa。
哈伯与能斯特的实验条件有何相似之处?
哈伯为什么能获得更多氨气?
现在工业合成氨为什么不选择更低的
温度和更高的压强来提高氨的产率?
能斯特:铂粉、锰作催化剂, 685℃,5MPa,得到 0.96%的氨。
化学平衡状态的特征
化学平衡状态
对象:可逆反应
本质:v正=v逆≠0
标志:含量不变
是可以改变的
逆
等
动
定
变
环节五:控制“化学反应条件”
1、目的:①促进有利的化学反应
②抑制有害的化学反应
2、方法:改变速率、限度
【交流与讨论】
为提高燃料的燃烧效率,应如何调控燃烧反应的条件?
(提示:可以从以下几方面考虑,如燃料的状态、空气用量、炉膛材料、烟道废气中热能的利用等等。)
燃煤状态 空气用量 炉膛材料 烟道废气中热能的利用
措施 煤粉代替煤块 空气充足 保温、隔热、耐热 预热通入
的空气
原因 燃烧充分,加快反应 充分燃烧放热多 减少热量的损失 对废气热能
再利用
讨论结果:
【科学史话】炼铁高炉尾气之谜
炼铁工程师发现在工业炼铁过程中,炼铁炉排出的尾气中含有一定量的 CO,并认为是CO 与原料接触时间不够导致,为此耗巨资增加高炉的高度来解决问题,然而,令人惊讶的是并未减少高炉中 CO 的含量。
Fe2O3+3CO 2Fe+3CO
C + CO2 2CO
课堂小结
化学反应速率
化学反应限度
(化学平衡)
v正=v逆
反应条件控制
温度
浓度
催化剂
……
温度
浓度
压强
……
调控
影响
调控
影响
逆、等、动、定、变
特征
