3.2.2物质的量在化学方程式计算中的应用 课件(共18张ppt)化学人教版(2019)必修第一册
文档属性
| 名称 | 3.2.2物质的量在化学方程式计算中的应用 课件(共18张ppt)化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 18:41:36 | ||
图片预览






文档简介
(共18张PPT)
高中化学
CHEMISTRY
教学新理念
第三章 铁 金属材料
3.2.2 物质的量在化学方程式计算中的应用
n之比 = 化学计量数之比
=
V
Vm
=
m
M
n =
N
NA
= cB V
1 1
n(Fe) 0.5 mol
n(H2SO4)=cV液 =2 mol/L×0.25 L = 0.5 mol
反应方程式:Fe + H2SO4 =FeSO4 + H2↑
1 n(Fe)
1 0.5 mol n(Fe)=0.5 mol
=
例1 250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标准状况)。
计算出参加反应的H2SO4的物质的量:
物质的量在化学方程式计算中的应用
解题步骤
写方程式
落系数
成比例
算结果
物质的量在化学方程式计算中的应用
n(H2)= 0.5 mol
1 1
0.5 mol n(H2)
1 0.5 mol
1 n(H2)
=
V(H2)= n(H2) × Vm
= 0.5 mol×22.4 L/mol
=11.2 L
(2) Fe + H2SO4—FeSO4 + H2↑
例1 250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标况)。
解法一:
解题步骤
写方程式
落系数
成比例
算结果
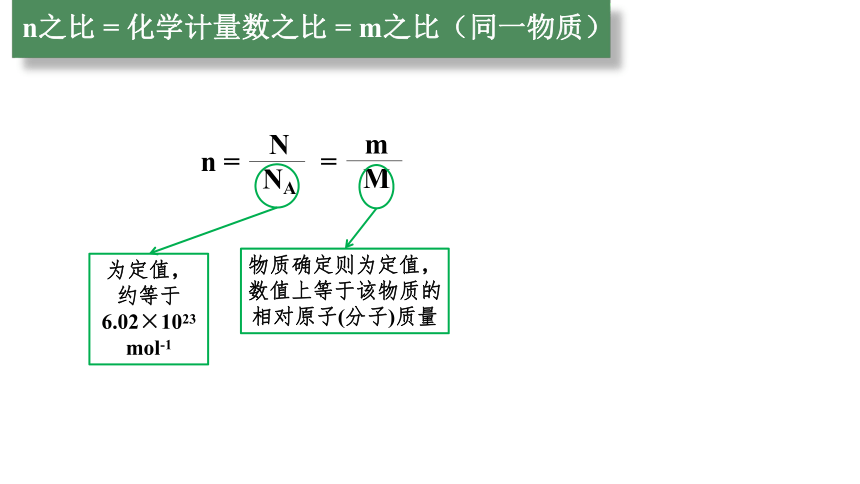
n之比 = 化学计量数之比 = m之比(同一物质)
=
m
M
n =
N
NA
为定值,约等于6.02×1023
mol-1
物质确定则为定值,数值上等于该物质的相对原子(分子)质量
物质的量在化学方程式计算中的应用
例2 相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为( )
n相同
n之比 = 化学计量数之比 = m之比(同一物质)
= V之比(同T同P)
=
m
M
n =
N
NA
为定值,约等于6.02×1023
mol-1
物质确定则为定值,数值上等于该物质的相对原子(分子)质量
=
V
Vm
对于气体,
同T同P下为定值
物质的量在化学方程式计算中的应用
例2 相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为( )
n相同
n之比
解:2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
2Al + 6HCl === 2AlCl3 + 3H2↑
2Al ~ 3H2
1比1
方法1:关系式法
物质的量在化学方程式计算中的应用
例3 相同条件下,等物质的量的Na、Mg、Al分别与足量的稀硫酸反应制取氢气,生成H2的体积比为( )
n相同
n之比
2Na~H2
Mg(Fe、Zn)~H2
2Al ~ 3H2
1:2:3
变式 相同条件下,等质量的Na、Mg、Al分别与足量的稀硫酸反应制取氢气,生成H2的体积比为( )
: :
方法1:关系式法
物质的量在化学方程式计算中的应用
例4 相同条件下,Na、Mg、Al分别与足量的稀硫酸反应制取氢气,生成H2的体积相同,则Na、Mg、Al 的物质的量之比为( )
n相同
2Na~H2
Mg(Fe、Zn)~H2
2Al ~ 3H2
6:3:2
变式 标准状况下,Na、Mg、Al分别与足量的稀硫酸反应制取氢气,均生成22.4LH2,则Na、Mg、Al 的质量分别为( )
46g、24g、18g
方法1:关系式法
物质的量在化学方程式计算中的应用
A
方法2:极值法
例5 两种金属混合物粉末15g,与足量的盐酸反应时生成标准状况下氢气11.2L,符合上述情况的金属混合物是( )
A. Mg、 Fe
B. Zn、 Al
C. Fe 、 Zn、
D. Mg 、 Al
n(H2)=11.2L÷22.4L/mol=0.5mol
Mg
~
H2
0.5mol
24g
1mol
12g
Fe
~
H2
0.5mol
56g
1mol
28g
Zn
~
H2
0.5mol
65g
1mol
32.5g
Al
~
H2
0.5mol
18g
1mol
9g
解析:
=
V
Vm
=
m
M
n =
N
NA
= cB V
为定值,约等于6.02×1023
mol-1
物质确定则为定值,数值上等于该物质的相对原子(分子)质量
对于气体,
同T同P下为定值
溶液的体积
n之比 = 化学计量数之比 = m之比(同一物质)
= V之比(同T同P)= c之比(V一定)
物质的量在化学方程式计算中的应用
例6 在200ml 0.5mol/L CaCl2溶液中,Cl-的物质的量浓度是( )
1mol/L
物质的量在化学方程式计算中的应用
方法3:守恒法
例7 4.6 g钠在空气中久置,最终得到Na2CO3的质量是 g。
解:Na在空气中最终转化为Na2CO3的过程中钠的原子个数不变,可得关系式:
10.6
2Na ~ Na2CO3
2×23 106
4.6 g m(Na2CO3)
物质的量在化学方程式计算中的应用
方法4:差量法
例8 把铁棒插入CuSO4溶液,一段时间后取出,铁棒质量增加了4 g,参加反应的Fe的质量为 。
28 g
解:Fe + CuSO4 === FeSO4 + Cu
56 g 64 g
m(Fe)
Δm
64 g-56 g=8 g
4 g
=
物质的量在化学方程式计算中的应用
方法4:差量法
例9 铁粉可与高温水蒸气反应,若反映后得到的干燥固体的质量比反应前铁粉的质量增加了32g,则参加反应的铁粉的物质的量是 ( )
1.5mol
Δm
64 g
32 g
解:3Fe + 4H2O(g) === Fe3O4 + 4H2
168 g 232 g
m(Fe)
高温
=
n
感谢聆听!
CHEMISTRY
高中化学
CHEMISTRY
教学新理念
第三章 铁 金属材料
3.2.2 物质的量在化学方程式计算中的应用
n之比 = 化学计量数之比
=
V
Vm
=
m
M
n =
N
NA
= cB V
1 1
n(Fe) 0.5 mol
n(H2SO4)=cV液 =2 mol/L×0.25 L = 0.5 mol
反应方程式:Fe + H2SO4 =FeSO4 + H2↑
1 n(Fe)
1 0.5 mol n(Fe)=0.5 mol
=
例1 250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标准状况)。
计算出参加反应的H2SO4的物质的量:
物质的量在化学方程式计算中的应用
解题步骤
写方程式
落系数
成比例
算结果
物质的量在化学方程式计算中的应用
n(H2)= 0.5 mol
1 1
0.5 mol n(H2)
1 0.5 mol
1 n(H2)
=
V(H2)= n(H2) × Vm
= 0.5 mol×22.4 L/mol
=11.2 L
(2) Fe + H2SO4—FeSO4 + H2↑
例1 250 mL 2 mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标况)。
解法一:
解题步骤
写方程式
落系数
成比例
算结果
n之比 = 化学计量数之比 = m之比(同一物质)
=
m
M
n =
N
NA
为定值,约等于6.02×1023
mol-1
物质确定则为定值,数值上等于该物质的相对原子(分子)质量
物质的量在化学方程式计算中的应用
例2 相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为( )
n相同
n之比 = 化学计量数之比 = m之比(同一物质)
= V之比(同T同P)
=
m
M
n =
N
NA
为定值,约等于6.02×1023
mol-1
物质确定则为定值,数值上等于该物质的相对原子(分子)质量
=
V
Vm
对于气体,
同T同P下为定值
物质的量在化学方程式计算中的应用
例2 相同质量的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下体积之比为( )
n相同
n之比
解:2Al + 2NaOH + 2H2O === 2NaAlO2 + 3H2↑
2Al + 6HCl === 2AlCl3 + 3H2↑
2Al ~ 3H2
1比1
方法1:关系式法
物质的量在化学方程式计算中的应用
例3 相同条件下,等物质的量的Na、Mg、Al分别与足量的稀硫酸反应制取氢气,生成H2的体积比为( )
n相同
n之比
2Na~H2
Mg(Fe、Zn)~H2
2Al ~ 3H2
1:2:3
变式 相同条件下,等质量的Na、Mg、Al分别与足量的稀硫酸反应制取氢气,生成H2的体积比为( )
: :
方法1:关系式法
物质的量在化学方程式计算中的应用
例4 相同条件下,Na、Mg、Al分别与足量的稀硫酸反应制取氢气,生成H2的体积相同,则Na、Mg、Al 的物质的量之比为( )
n相同
2Na~H2
Mg(Fe、Zn)~H2
2Al ~ 3H2
6:3:2
变式 标准状况下,Na、Mg、Al分别与足量的稀硫酸反应制取氢气,均生成22.4LH2,则Na、Mg、Al 的质量分别为( )
46g、24g、18g
方法1:关系式法
物质的量在化学方程式计算中的应用
A
方法2:极值法
例5 两种金属混合物粉末15g,与足量的盐酸反应时生成标准状况下氢气11.2L,符合上述情况的金属混合物是( )
A. Mg、 Fe
B. Zn、 Al
C. Fe 、 Zn、
D. Mg 、 Al
n(H2)=11.2L÷22.4L/mol=0.5mol
Mg
~
H2
0.5mol
24g
1mol
12g
Fe
~
H2
0.5mol
56g
1mol
28g
Zn
~
H2
0.5mol
65g
1mol
32.5g
Al
~
H2
0.5mol
18g
1mol
9g
解析:
=
V
Vm
=
m
M
n =
N
NA
= cB V
为定值,约等于6.02×1023
mol-1
物质确定则为定值,数值上等于该物质的相对原子(分子)质量
对于气体,
同T同P下为定值
溶液的体积
n之比 = 化学计量数之比 = m之比(同一物质)
= V之比(同T同P)= c之比(V一定)
物质的量在化学方程式计算中的应用
例6 在200ml 0.5mol/L CaCl2溶液中,Cl-的物质的量浓度是( )
1mol/L
物质的量在化学方程式计算中的应用
方法3:守恒法
例7 4.6 g钠在空气中久置,最终得到Na2CO3的质量是 g。
解:Na在空气中最终转化为Na2CO3的过程中钠的原子个数不变,可得关系式:
10.6
2Na ~ Na2CO3
2×23 106
4.6 g m(Na2CO3)
物质的量在化学方程式计算中的应用
方法4:差量法
例8 把铁棒插入CuSO4溶液,一段时间后取出,铁棒质量增加了4 g,参加反应的Fe的质量为 。
28 g
解:Fe + CuSO4 === FeSO4 + Cu
56 g 64 g
m(Fe)
Δm
64 g-56 g=8 g
4 g
=
物质的量在化学方程式计算中的应用
方法4:差量法
例9 铁粉可与高温水蒸气反应,若反映后得到的干燥固体的质量比反应前铁粉的质量增加了32g,则参加反应的铁粉的物质的量是 ( )
1.5mol
Δm
64 g
32 g
解:3Fe + 4H2O(g) === Fe3O4 + 4H2
168 g 232 g
m(Fe)
高温
=
n
感谢聆听!
CHEMISTRY
