1.1.3燃烧热 课件(共36张PPT)化学人教版(2019)选择性必修第一册
文档属性
| 名称 | 1.1.3燃烧热 课件(共36张PPT)化学人教版(2019)选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 882.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 18:43:34 | ||
图片预览










文档简介
(共36张PPT)
第一章 化学反应的热效应
第一节 反应热
燃烧热
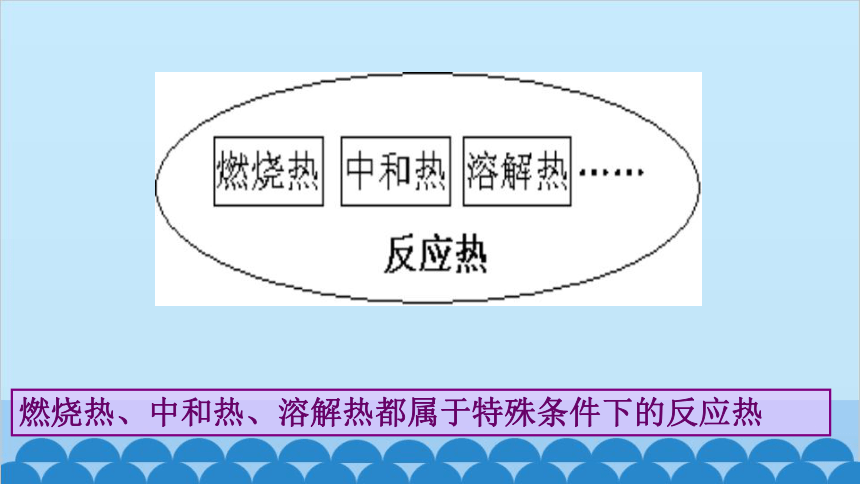
由于反应的情况不同,反应热可分为燃烧热、中和热、溶解热等,其中以燃烧热的实际应用最广泛。
思考 ?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
一、燃烧热
1.燃烧热的的概念:
在25℃ 、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
指定温度、压强
生成物不能继续燃烧
C -- CO2 (g)
S – SO2 (g)
H– H2O(l)
单位: kJ/mol
限定燃料的物质的量
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=-11036KJ/mol
思考:①C8H18的燃烧热是多少
△H=-5518KJ/mol
②1mol C8H18燃烧时放出了多少热
5518KJ
在25℃ 、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
说明:
Ⅰ、在25℃ 101kPa时,完全燃烧生成稳定的氧化物 如:C→C02 (g),H→H20(l),S→S02 (g)等
Ⅱ、燃烧热通常由实验测得
Ⅲ、燃烧热规定了可燃物的物质的量为1mol.
IV、物质是在O2 中燃烧:没有特别说明时,燃烧一般是指在氧气中燃烧。
V、物质的燃烧热要求纯物质,比如石墨、金刚石组成的混合物,虽然只含同一种元素,但配比不同,燃烧热不同。
VI、由于燃烧是放热反应,故文字表达不标明“+”“-”,但用△H表示时必须注明“-”。(△H<0)
H2(g)+ O2(g)=H2O(l) H =- 285.8kJ/mol
H2的燃烧热为285.8kJ/mol,
文字表示 在25℃ 101kPa时,1molH2完全燃烧放出285.8kJ的热量
用符号表示为:△H =-285.8kJ/mol
例:语言表述——CH4的燃烧热为890.3 kJ/mol
符号表示——△H= -890.3 kJ/mol
例:语言表述——H2的燃烧热为285.8 kJ/mol
符号表示——△H= -285.8 kJ/mol
燃烧热是反应热的一种。由于燃烧是放热反应,故文字表达使用“正值”,但用△H表示时必须注明符号
燃烧热、中和热、溶解热都属于特殊条件下的反应热
例:分析以下几个热化学方程式,哪个是表示固态碳和气态氢气燃烧时的燃烧热的?为什么?
A.C(s)+O2(g)===CO(g); ΔH=110.5 kJ/mol
B.C(s)+O2(g)===CO2(g); ΔH=-393.5 kJ/mol
C.2H2(g)+ O2(g)===2H2O(l); ΔH=-571.6 kJ/mol
D.H2(g)+ O2(g)===H2O(g); ΔH=-241.8 kJ/mol
B
解析:
A项 C(s)燃烧未生成稳定氧化物CO2(g),故其反应热不能叫燃烧热;
B项符合燃烧热的定义;
C项H2虽然转变成了稳定的氧化物H2O(l),但由于其反应热表示的是2 mol H2 完全燃烧时的热量变化,故不能叫燃烧热;
D项参加燃烧的H2虽然是1 mol,但其生成H2O(g),而不是H2O(l),故它的反应热也不为H2的燃烧热。
2、2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH=-571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
答:ΔH=-285.8 kJ/mol
【练 习】
1、C(s)+ O2(g)=CO(g);△H=-110.5kJ/mol
C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
则C的燃烧热为 。
393.5kJ/mol
3、石墨与金刚石的燃烧热是否相同,为什么?请分别写出石墨和金刚石燃烧的热化学方程式。
不相同,因为石墨与金刚石的晶体结构不同,共具有的能量也不相同
C(石墨s)+ O2(g)= CO2(g) ΔH= -393.5 kl/mol
C(金刚石s)+ O2(g)= CO2(g) ΔH= -395.0 kl/mol
说明金刚石具有的总能量高,不稳定
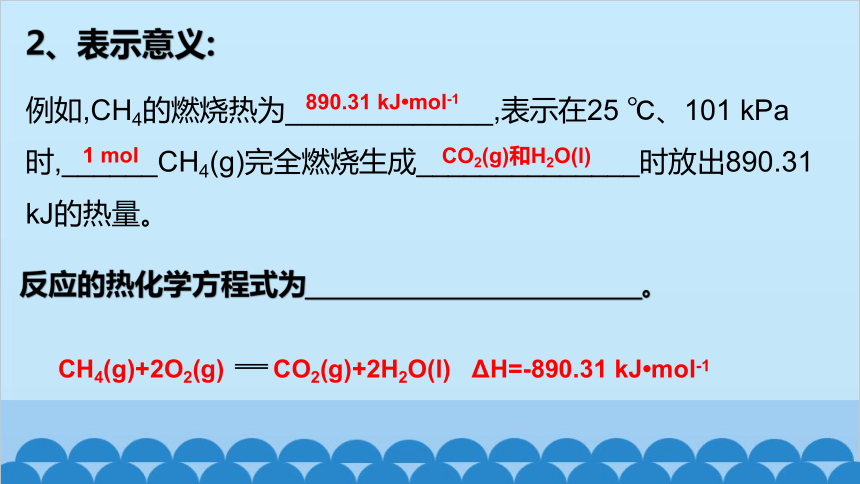
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.31 kJ mol-1
反应的热化学方程式为_____________________。
例如,CH4的燃烧热为_____________,表示在25 ℃、101 kPa时,______CH4(g)完全燃烧生成______________时放出890.31 kJ的热量。
CO2(g)和H2O(l)
890.31 kJ mol-1
1 mol
2、表示意义:
物质的量
n(可燃物)×|ΔH|
燃烧热ΔH的绝对值
一定量的可燃物完全燃烧放出的热量,等于可燃物的__________乘以该物质的__________________,
即Q放= ___________________。
3、一定量可燃物完全燃烧时放出的热量
4.表示燃烧热的热化学方程式的书写:
应以1mol可燃物质的标准来配平其余物质的化学计量数(常出现分数)
燃烧热的热化学方程式的书写注意:
① 燃烧的条件是在25℃ 、101kPa(一般省略);
②应以1mol物质的标准来配平其余物质的化学计量数.在燃烧热的热化学方程式中,可燃物的化学计量数必须为1,其余物质的化学计量数可为分数;
③ 物质燃烧都是放热反应,所以表达物质燃烧时的△H均为负值;
④生成的产物是稳定的氧化物,C的燃烧热是指生成CO2,而不是CO;H2的燃烧热是指生成H2O(l),而不是H2O(g) ;H2S的燃烧热是指生成SO2 。
如H2(g)+ 1/2 O2(g) = H2O(l) △H =-285.8 kJ/mol
⑤燃烧的热化学方程式和燃烧热的热化学方程式、中和反应的热化学方程式和中和热的热化学方程式
例:0.3mol的气态高能燃料乙炔(C2H2)在氧气中完全燃烧,生成气态CO2和液态水,放出389.88kJ热量,其热化学方程式为
其燃烧热为
表示燃烧热的热化学方程式为
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2kJ/mol
1299.6kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-1299.6kJ/mol
答:① 燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而燃烧热规定是1 mol的纯物质;
② 研究燃烧放出的热量并未限定燃烧产物的形态,而研究燃烧热必须是生成稳定的氧化物。
【思考】燃烧放出的热量与燃烧热有什么不同?
区别:
燃烧的热化学方程式和燃烧热的热化学方程式、中和反应的热化学方程式和中和热的热化学方程式
【思考1】可燃物的物质的量发生变化,其燃烧热变吗?
【温馨提示】不是。燃烧热指1 mol可燃物燃烧放出的热量,与可燃物的物质的量无关。
【思考2】如何书写或判断燃烧热的热化学方程式?
【温馨提示】书写或判断表示燃烧热的热化学方程式要做到“四看”:
一看可燃物的化学计量数是否为1。
二看碳元素完全燃烧生成的氧化物是否为CO2(g)。
三看氢元素完全燃烧生成的氧化物是否为H2O(l)。
四看ΔH是否为“—”及单位是否正确。
二、中和热
1.定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时的反应热叫做中和热。
2.中和热的表示: H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
3.要点:
Ⅰ、条件:稀溶液。稀溶液是指溶于大量水的离子
Ⅱ、反应物: (强)酸与(强)碱。中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H20,若反应过程中有其他物质生成,这部分反应热也不在中和热之内
Ⅳ、放出的热量:57.3kJ/mol
容易混淆问题:
酸碱中和反应的热化学方程式≠中和热的热化学方程式
酸碱中和反应的热化学方程式
——水的系数可以是任意的!
中和热的热化学方程式
——水的系数必须是“1”
书写中和热的热化学方程式的时,应该以生成 1mol H2O 为标准来配平其余物质的化学计量数。
【归纳总结】:中和热与中和反应的反应热辨析
(3)有弱酸或弱碱参加的中和反应,其中和热的数值都小于57.3,这是因为反应时弱酸或弱碱发生电离需要吸收热量。
(1)中和热指中和反应每生成1 mol H2O时的反应热,与强酸、强碱的类别无关。
(2)任何中和反应的中和热都相同,但是不同的中和反应的反应热可能不同。
例:已知H+(aq)+OH-(aq)=H2O(l); H=-57.3kJ/mol ,求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反应放出_______ kJ的热量。
(2)用28gKOH配稀溶液跟足量稀硝酸反应,放出______kJ的热量。
28.7
28.7
1.下列说法正确的是( )
A.中和热一定是强酸跟强碱反应放出的热量
B.1 mol酸与1 mol碱完全反应放出的热量是中和热
C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热
D.测定中和热时可用稀硫酸和稀Ba(OH)2溶液
【解析】本题考查的是中和热的概念,关键是记清楚有关中和热的问题。中和热是指稀酸、稀碱中和反应生成1 mol H2O(l)时所放出的热量,故C正确;
H2SO4和Ba(OH)2反应时,除生成水外,还有BaSO4沉淀生成,所以其反应热不是中和热,D错误。
C
【练习】
2.已知强酸与强碱的稀溶液发生中和反应的热化学方程式为 H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2
C.ΔH1=ΔH3>ΔH2 D.ΔH1>ΔH3>ΔH2
【解析】因为稀醋酸是弱酸,难电离,电离时吸热,浓硫酸溶于水时放热,故中和反应时放出的热量Q(浓硫酸)>Q(稀硝酸)>Q(稀醋酸),又因放热反应中ΔH为负值,即ΔH=-Q,故ΔH2<ΔH3<ΔH1,因而选D。
D
燃烧热与中和热的区别与联系
相 同 点 燃烧热 中和热
能量变化
ΔH
不 同 点 反应物的量
生成物的量
反应热 的含义
ΔH<0 , 单位 kJ/mol
放热反应
1mol纯物质
1mol水
1mol纯物质完全燃烧生成稳定氧化物时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热相同,均为57.3kJ/mol
不限量
可能是1mol也可以是0.5mol (不限)
[例题1]1.在101 kPa时,1 mol CH4 完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
解析:1 mol CH4完全燃烧的热化学方程式为:
CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.3 kJ/mol
即CH4的燃烧热为890.3 kJ/mol。
1 000 L CH4(标准状况)的物质的量为:n(CH4)= =44.6 mol,44.6 mol CH4 完全燃烧放出的热量为:44.6 mol×890.3 kJ/mol=3.97×104 kJ
三、燃烧热的计算及应用
[例题2]葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l)ΔH=-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算100 g葡萄糖在人体中完全氧化时所产生的热量。
解析:
根据题意,葡萄糖的燃烧热为2 800 kJ/mol,100 g葡萄糖的物质的量为: n(C6H12O6)==0.556 mol
1 mol C6H12O6完全燃烧放出2 800 kJ的热量,0.556 mol C6H12O6完全燃烧放出的热量为: 0.556 mol×2 800 kJ/mol=1 557 kJ
答案:100 g葡萄糖在人体中完全氧化时产生1 557 kJ的热量。
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ。 ( )
(2)S(s)+O2(g)=SO2(g) ΔH=+296.8 kJ· mol-1。 ( )
(3)1 mol H2燃烧放出的热量为氢气的燃烧热。 ( )
(4)1 mol硫完全燃烧生成SO3所放出的热量为硫的燃烧热。 ( )
(5)根据2H2(g)+O2(g)=2H2O(l) ΔH=-571 kJ· mol-1可知氢气的燃烧热为571 kJ· mol-1。 ( )
(6)表示乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ· mol-1。 ( )
1.正误判断
×
×
×
×
×
×
2.以下能表示物质燃烧热的热化学方程式是 ( )
解析:A项,C(s)燃烧未生成CO2(g),故A项不能表示碳的燃烧热;B项,符合燃烧热的定义;C项,H2虽然生成了H2O(l),但由于其反应热表示的是2 mol H2 完全燃烧时的热量变化,故C项不能表示H2的燃烧热;D项,反应中生成的是H2O(g),而不是H2O(l),故D项不能表示H2的燃烧热。
B
一看可燃物的化学计量数是否为1。
二看燃烧后是否生成指定产物:即看碳元素完全燃烧生成的氧化物是否为CO2(g),看氢元素完全燃烧生成的氧化物是否为H2O(l),看硫元素完全燃烧生成的氧化物是否为SO2(g)等。
三看ΔH符号是否为“-”及单位是否正确。
书写或判断表示物质燃烧热的热化学方程式要做到“三看”
3.下列热化学方程式中ΔH的数值表示可燃物燃烧热的是( )。
A
4.已知反应:H2S(g)+aO2(g) X+cH2O(l) ΔH,若ΔH表示该反应的燃烧热,则X为( )。
A.S(s) B.SO2(g) C.SO3(g) D.SO2(l)
B
3.下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)
ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g)
ΔH=-296.8 kJ·mol-1(反应热)
D.2NO2===O2+2NO
ΔH=+116.2 kJ·mol-1(反应热)
C
5.下列说法正确的是( )
A.在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热。
B.酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热。
C.燃烧热或中和热是反应热的种类之一。
D.在25 ℃、101 kPa时,纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
【解析】本题旨在考查对燃烧热、中和热定义的理解。A中没有指明“纯物质完全燃烧生成稳定的氧化物”这一条件,故不正确;B中缺少“在稀强溶液中”这一前提,故不正确;D中未限定可燃物的物质的量为1 mol,故也不正确。
C
4.下列关于反应热的叙述中正确的是( )。
A.当ΔH<0时,表示该反应为吸热反应
B.由C(s)+1/2O2(g) CO(g)的反应热为110.5kJ mol-1,
可知碳的燃烧热ΔH为-110.5 kJ mol-1
C.反应热的大小与反应物和生成物所具有的能量无关
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOHD
6.为减少大气污染,一些城市公共汽车正逐步使用CNG(压缩天然气)清洁燃料。实验测得0.16 g该气体燃料完全燃烧,生成224 mL (标准状况下)CO2和0.36 g 液态水,并放出 8.903 kJ 的热量。
(1)CNG的化学式为_______。
(2)请写出CNG完全燃烧的热化学方程式:
________________________________________________。
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.3 kJ mol-1
CH4
在理解物质燃烧热的定义时,要注意以下几点:
①研究条件:101 kPa
②反应程度:完全燃烧,产物是稳定的氧化物。
③燃烧物的物质的量:1 mol
④研究内容:放出的热量。(ΔH<0,单位kJ/mol)
⑤在没有特别说明的情况下,外界压强一般指101 kPa所谓完全燃烧也是完全氧化。
燃 烧 热
1.定义:在 101 kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
课堂总结
2.研究物质燃烧热的意义
3.燃烧热的有关计算
第一章 化学反应的热效应
第一节 反应热
燃烧热
由于反应的情况不同,反应热可分为燃烧热、中和热、溶解热等,其中以燃烧热的实际应用最广泛。
思考 ?
我们知道物质燃烧都会放出热量,那么是不是物质燃烧放出的热量就叫燃烧热呢?
一、燃烧热
1.燃烧热的的概念:
在25℃ 、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
指定温度、压强
生成物不能继续燃烧
C -- CO2 (g)
S – SO2 (g)
H– H2O(l)
单位: kJ/mol
限定燃料的物质的量
2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H=-11036KJ/mol
思考:①C8H18的燃烧热是多少
△H=-5518KJ/mol
②1mol C8H18燃烧时放出了多少热
5518KJ
在25℃ 、101kPa时,1mol纯物质完全燃烧生成稳定的化合物时所放出的热量。
说明:
Ⅰ、在25℃ 101kPa时,完全燃烧生成稳定的氧化物 如:C→C02 (g),H→H20(l),S→S02 (g)等
Ⅱ、燃烧热通常由实验测得
Ⅲ、燃烧热规定了可燃物的物质的量为1mol.
IV、物质是在O2 中燃烧:没有特别说明时,燃烧一般是指在氧气中燃烧。
V、物质的燃烧热要求纯物质,比如石墨、金刚石组成的混合物,虽然只含同一种元素,但配比不同,燃烧热不同。
VI、由于燃烧是放热反应,故文字表达不标明“+”“-”,但用△H表示时必须注明“-”。(△H<0)
H2(g)+ O2(g)=H2O(l) H =- 285.8kJ/mol
H2的燃烧热为285.8kJ/mol,
文字表示 在25℃ 101kPa时,1molH2完全燃烧放出285.8kJ的热量
用符号表示为:△H =-285.8kJ/mol
例:语言表述——CH4的燃烧热为890.3 kJ/mol
符号表示——△H= -890.3 kJ/mol
例:语言表述——H2的燃烧热为285.8 kJ/mol
符号表示——△H= -285.8 kJ/mol
燃烧热是反应热的一种。由于燃烧是放热反应,故文字表达使用“正值”,但用△H表示时必须注明符号
燃烧热、中和热、溶解热都属于特殊条件下的反应热
例:分析以下几个热化学方程式,哪个是表示固态碳和气态氢气燃烧时的燃烧热的?为什么?
A.C(s)+O2(g)===CO(g); ΔH=110.5 kJ/mol
B.C(s)+O2(g)===CO2(g); ΔH=-393.5 kJ/mol
C.2H2(g)+ O2(g)===2H2O(l); ΔH=-571.6 kJ/mol
D.H2(g)+ O2(g)===H2O(g); ΔH=-241.8 kJ/mol
B
解析:
A项 C(s)燃烧未生成稳定氧化物CO2(g),故其反应热不能叫燃烧热;
B项符合燃烧热的定义;
C项H2虽然转变成了稳定的氧化物H2O(l),但由于其反应热表示的是2 mol H2 完全燃烧时的热量变化,故不能叫燃烧热;
D项参加燃烧的H2虽然是1 mol,但其生成H2O(g),而不是H2O(l),故它的反应热也不为H2的燃烧热。
2、2H2( g ) + O2 ( g) = 2H2O ( l ) ΔH=-571.6 kJ/mol
H2( g ) +1/2 O2 ( g) = H2O ( g ) ΔH=-241.8 kJ/mol
求氢气的燃烧热。
答:ΔH=-285.8 kJ/mol
【练 习】
1、C(s)+ O2(g)=CO(g);△H=-110.5kJ/mol
C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
则C的燃烧热为 。
393.5kJ/mol
3、石墨与金刚石的燃烧热是否相同,为什么?请分别写出石墨和金刚石燃烧的热化学方程式。
不相同,因为石墨与金刚石的晶体结构不同,共具有的能量也不相同
C(石墨s)+ O2(g)= CO2(g) ΔH= -393.5 kl/mol
C(金刚石s)+ O2(g)= CO2(g) ΔH= -395.0 kl/mol
说明金刚石具有的总能量高,不稳定
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.31 kJ mol-1
反应的热化学方程式为_____________________。
例如,CH4的燃烧热为_____________,表示在25 ℃、101 kPa时,______CH4(g)完全燃烧生成______________时放出890.31 kJ的热量。
CO2(g)和H2O(l)
890.31 kJ mol-1
1 mol
2、表示意义:
物质的量
n(可燃物)×|ΔH|
燃烧热ΔH的绝对值
一定量的可燃物完全燃烧放出的热量,等于可燃物的__________乘以该物质的__________________,
即Q放= ___________________。
3、一定量可燃物完全燃烧时放出的热量
4.表示燃烧热的热化学方程式的书写:
应以1mol可燃物质的标准来配平其余物质的化学计量数(常出现分数)
燃烧热的热化学方程式的书写注意:
① 燃烧的条件是在25℃ 、101kPa(一般省略);
②应以1mol物质的标准来配平其余物质的化学计量数.在燃烧热的热化学方程式中,可燃物的化学计量数必须为1,其余物质的化学计量数可为分数;
③ 物质燃烧都是放热反应,所以表达物质燃烧时的△H均为负值;
④生成的产物是稳定的氧化物,C的燃烧热是指生成CO2,而不是CO;H2的燃烧热是指生成H2O(l),而不是H2O(g) ;H2S的燃烧热是指生成SO2 。
如H2(g)+ 1/2 O2(g) = H2O(l) △H =-285.8 kJ/mol
⑤燃烧的热化学方程式和燃烧热的热化学方程式、中和反应的热化学方程式和中和热的热化学方程式
例:0.3mol的气态高能燃料乙炔(C2H2)在氧气中完全燃烧,生成气态CO2和液态水,放出389.88kJ热量,其热化学方程式为
其燃烧热为
表示燃烧热的热化学方程式为
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2599.2kJ/mol
1299.6kJ/mol
C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l) △H=-1299.6kJ/mol
答:① 燃烧放出的热量与物质的多少有关,燃烧的物质越多,放出的热量就越多,而燃烧热规定是1 mol的纯物质;
② 研究燃烧放出的热量并未限定燃烧产物的形态,而研究燃烧热必须是生成稳定的氧化物。
【思考】燃烧放出的热量与燃烧热有什么不同?
区别:
燃烧的热化学方程式和燃烧热的热化学方程式、中和反应的热化学方程式和中和热的热化学方程式
【思考1】可燃物的物质的量发生变化,其燃烧热变吗?
【温馨提示】不是。燃烧热指1 mol可燃物燃烧放出的热量,与可燃物的物质的量无关。
【思考2】如何书写或判断燃烧热的热化学方程式?
【温馨提示】书写或判断表示燃烧热的热化学方程式要做到“四看”:
一看可燃物的化学计量数是否为1。
二看碳元素完全燃烧生成的氧化物是否为CO2(g)。
三看氢元素完全燃烧生成的氧化物是否为H2O(l)。
四看ΔH是否为“—”及单位是否正确。
二、中和热
1.定义:在稀溶液中,酸跟碱发生中和反应,生成1mol水时的反应热叫做中和热。
2.中和热的表示: H+(aq)+OH-(aq)=H2O (1) △H=-57.3kJ/mol
3.要点:
Ⅰ、条件:稀溶液。稀溶液是指溶于大量水的离子
Ⅱ、反应物: (强)酸与(强)碱。中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应
Ⅲ、生成1mol水。中和反应的实质是H+和OH-化合生成H20,若反应过程中有其他物质生成,这部分反应热也不在中和热之内
Ⅳ、放出的热量:57.3kJ/mol
容易混淆问题:
酸碱中和反应的热化学方程式≠中和热的热化学方程式
酸碱中和反应的热化学方程式
——水的系数可以是任意的!
中和热的热化学方程式
——水的系数必须是“1”
书写中和热的热化学方程式的时,应该以生成 1mol H2O 为标准来配平其余物质的化学计量数。
【归纳总结】:中和热与中和反应的反应热辨析
(3)有弱酸或弱碱参加的中和反应,其中和热的数值都小于57.3,这是因为反应时弱酸或弱碱发生电离需要吸收热量。
(1)中和热指中和反应每生成1 mol H2O时的反应热,与强酸、强碱的类别无关。
(2)任何中和反应的中和热都相同,但是不同的中和反应的反应热可能不同。
例:已知H+(aq)+OH-(aq)=H2O(l); H=-57.3kJ/mol ,求下列中和反应中放出的热量。
(1)用20gNaOH配稀溶液跟足量稀盐酸反应放出_______ kJ的热量。
(2)用28gKOH配稀溶液跟足量稀硝酸反应,放出______kJ的热量。
28.7
28.7
1.下列说法正确的是( )
A.中和热一定是强酸跟强碱反应放出的热量
B.1 mol酸与1 mol碱完全反应放出的热量是中和热
C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O(l)时的反应热叫做中和热
D.测定中和热时可用稀硫酸和稀Ba(OH)2溶液
【解析】本题考查的是中和热的概念,关键是记清楚有关中和热的问题。中和热是指稀酸、稀碱中和反应生成1 mol H2O(l)时所放出的热量,故C正确;
H2SO4和Ba(OH)2反应时,除生成水外,还有BaSO4沉淀生成,所以其反应热不是中和热,D错误。
C
【练习】
2.已知强酸与强碱的稀溶液发生中和反应的热化学方程式为 H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( )
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH3<ΔH2
C.ΔH1=ΔH3>ΔH2 D.ΔH1>ΔH3>ΔH2
【解析】因为稀醋酸是弱酸,难电离,电离时吸热,浓硫酸溶于水时放热,故中和反应时放出的热量Q(浓硫酸)>Q(稀硝酸)>Q(稀醋酸),又因放热反应中ΔH为负值,即ΔH=-Q,故ΔH2<ΔH3<ΔH1,因而选D。
D
燃烧热与中和热的区别与联系
相 同 点 燃烧热 中和热
能量变化
ΔH
不 同 点 反应物的量
生成物的量
反应热 的含义
ΔH<0 , 单位 kJ/mol
放热反应
1mol纯物质
1mol水
1mol纯物质完全燃烧生成稳定氧化物时放出的热量;不同的物质燃烧热不同
酸碱中和生成1molH2O时放出的热量,强酸强碱间的中和反应中和热相同,均为57.3kJ/mol
不限量
可能是1mol也可以是0.5mol (不限)
[例题1]1.在101 kPa时,1 mol CH4 完全燃烧生成CO2和液态H2O,放出890.3 kJ的热量,CH4的燃烧热为多少?1000 L CH4(标准状况)燃烧后所产生的热量为多少?
解析:1 mol CH4完全燃烧的热化学方程式为:
CH4(g)+2O2(g)===CO2(g)+2H2O(l);ΔH=-890.3 kJ/mol
即CH4的燃烧热为890.3 kJ/mol。
1 000 L CH4(标准状况)的物质的量为:n(CH4)= =44.6 mol,44.6 mol CH4 完全燃烧放出的热量为:44.6 mol×890.3 kJ/mol=3.97×104 kJ
三、燃烧热的计算及应用
[例题2]葡萄糖是人体所需能量的重要来源之一。葡萄糖燃烧的热化学方程式为:
C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l)ΔH=-2 800 kJ/mol 葡萄糖在人体组织中氧化的热化学方程式与它燃烧的热化学方程式相同。计算100 g葡萄糖在人体中完全氧化时所产生的热量。
解析:
根据题意,葡萄糖的燃烧热为2 800 kJ/mol,100 g葡萄糖的物质的量为: n(C6H12O6)==0.556 mol
1 mol C6H12O6完全燃烧放出2 800 kJ的热量,0.556 mol C6H12O6完全燃烧放出的热量为: 0.556 mol×2 800 kJ/mol=1 557 kJ
答案:100 g葡萄糖在人体中完全氧化时产生1 557 kJ的热量。
(1)CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ。 ( )
(2)S(s)+O2(g)=SO2(g) ΔH=+296.8 kJ· mol-1。 ( )
(3)1 mol H2燃烧放出的热量为氢气的燃烧热。 ( )
(4)1 mol硫完全燃烧生成SO3所放出的热量为硫的燃烧热。 ( )
(5)根据2H2(g)+O2(g)=2H2O(l) ΔH=-571 kJ· mol-1可知氢气的燃烧热为571 kJ· mol-1。 ( )
(6)表示乙醇燃烧热的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1 367.0 kJ· mol-1。 ( )
1.正误判断
×
×
×
×
×
×
2.以下能表示物质燃烧热的热化学方程式是 ( )
解析:A项,C(s)燃烧未生成CO2(g),故A项不能表示碳的燃烧热;B项,符合燃烧热的定义;C项,H2虽然生成了H2O(l),但由于其反应热表示的是2 mol H2 完全燃烧时的热量变化,故C项不能表示H2的燃烧热;D项,反应中生成的是H2O(g),而不是H2O(l),故D项不能表示H2的燃烧热。
B
一看可燃物的化学计量数是否为1。
二看燃烧后是否生成指定产物:即看碳元素完全燃烧生成的氧化物是否为CO2(g),看氢元素完全燃烧生成的氧化物是否为H2O(l),看硫元素完全燃烧生成的氧化物是否为SO2(g)等。
三看ΔH符号是否为“-”及单位是否正确。
书写或判断表示物质燃烧热的热化学方程式要做到“三看”
3.下列热化学方程式中ΔH的数值表示可燃物燃烧热的是( )。
A
4.已知反应:H2S(g)+aO2(g) X+cH2O(l) ΔH,若ΔH表示该反应的燃烧热,则X为( )。
A.S(s) B.SO2(g) C.SO3(g) D.SO2(l)
B
3.下列热化学方程式书写正确的是(ΔH的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)
ΔH=-1 367.0 kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=+57.3 kJ·mol-1(中和热)
C.S(s)+O2(g)===SO2(g)
ΔH=-296.8 kJ·mol-1(反应热)
D.2NO2===O2+2NO
ΔH=+116.2 kJ·mol-1(反应热)
C
5.下列说法正确的是( )
A.在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热。
B.酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热。
C.燃烧热或中和热是反应热的种类之一。
D.在25 ℃、101 kPa时,纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
【解析】本题旨在考查对燃烧热、中和热定义的理解。A中没有指明“纯物质完全燃烧生成稳定的氧化物”这一条件,故不正确;B中缺少“在稀强溶液中”这一前提,故不正确;D中未限定可燃物的物质的量为1 mol,故也不正确。
C
4.下列关于反应热的叙述中正确的是( )。
A.当ΔH<0时,表示该反应为吸热反应
B.由C(s)+1/2O2(g) CO(g)的反应热为110.5kJ mol-1,
可知碳的燃烧热ΔH为-110.5 kJ mol-1
C.反应热的大小与反应物和生成物所具有的能量无关
D.1 mol NaOH分别和1 mol CH3COOH、1 mol HNO3反应放出的热量:CH3COOH
6.为减少大气污染,一些城市公共汽车正逐步使用CNG(压缩天然气)清洁燃料。实验测得0.16 g该气体燃料完全燃烧,生成224 mL (标准状况下)CO2和0.36 g 液态水,并放出 8.903 kJ 的热量。
(1)CNG的化学式为_______。
(2)请写出CNG完全燃烧的热化学方程式:
________________________________________________。
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890.3 kJ mol-1
CH4
在理解物质燃烧热的定义时,要注意以下几点:
①研究条件:101 kPa
②反应程度:完全燃烧,产物是稳定的氧化物。
③燃烧物的物质的量:1 mol
④研究内容:放出的热量。(ΔH<0,单位kJ/mol)
⑤在没有特别说明的情况下,外界压强一般指101 kPa所谓完全燃烧也是完全氧化。
燃 烧 热
1.定义:在 101 kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
课堂总结
2.研究物质燃烧热的意义
3.燃烧热的有关计算
