福建省闽清高级中学等四校2014-2015高二上学期期中联考化学试题
文档属性
| 名称 | 福建省闽清高级中学等四校2014-2015高二上学期期中联考化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 133.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2014-12-11 10:12:52 | ||
图片预览



文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
福建省闽清高级中学等四校2014-2015高二上学期期中联考化学试题
可能用到的相对分子质量:H:1 O:16 Cu:64
第Ⅰ卷(选择题 共45分)
一、选择题(每小题3分,共45分。下列每小题所给选项只有一项符合题意)
1.未来新能源的特点是资源丰富,在使用时 ( http: / / www.21cnjy.com )对环境无污染或很少污染,且有些可以再生。下列属于新能源( )
①天然气 ②氢能 ③生物质能 ④太阳能 ⑤ 石油 ⑥燃料电池 ⑦风能 ⑧煤
A.①②③④⑥ B.④⑤⑥⑦⑧
C.③④⑤⑥⑦ D.②③④⑥⑦
2. 我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做 ( )21世纪教育网版权所有
A.阳极 B.阴极 C.正极 D.负极
3. 已知:①1 mol H2分子中化学键 ( http: / / www.21cnjy.com )断裂时需要吸收436kJ的能量②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量,下列叙述正确的是( )2·1·c·n·j·y
A.氢气和氯气反应生成2mol氯化氢气体 ( http: / / www.21cnjy.com ),反应的△H=-183kJ/mol
B.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=+183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
4.下列热化学方程式书写正确的是(的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H= —1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H= + 57.3kJ/mol(中和热)
C.S(s)+O2(g)==SO2(g);△H= —296.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
5.用3g铁屑与适量3mo ( http: / / www.21cnjy.com )l/L稀硫酸反应制取H2气体,若要增大反应速率,可采取的措施是:
① 再加入适量1mol/L硫酸 ②再 ( http: / / www.21cnjy.com )加入适量3mol/L硫酸 ③ 改用3g铁粉 ④适当升高温度 ⑤ 加几滴CuSO4溶液 ⑥ 用98%浓硫酸代替1mol/L稀硫酸
A.①④⑤ B.②③④ C.③④⑤ D.③④⑥
6.原电池的负极和电解池的阴极所发生的反应分别是 ( )
A.氧化、还原 B.还原、氧化 C.氧化、氧化 D.还原、还原
7.下列能说明可逆反应2A(g)+B(g)2 C(g)+D(g)在一定条件下已达到化学平衡状态的事实是( )
A.容器内压强不随时间的变化而变化 B.容器内A、B、C、D四者共存
C.C的生成速率是D的生成速率的两倍 D. A的消耗速率是D的消耗速率的两倍
8.下列有关能量的判断或表示方法正确的是( )
A. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
B. 从C(s,石墨)====C(s,金刚石) ΔH=+1.9kJ·mol-1,可知石墨比金刚石更稳定
C.由H+(aq)+ OH-(aq ( http: / / www.21cnjy.com ))=== H2O(l) ΔH =-57.3 kJ·mol-1 ,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJwww.21-cn-jy.com
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为
2H2(g)+O2(g)==== 2H2O(l) ΔH=-285.8 kJ·mol-1
9.下列反应中,熵减小的是( )
A. (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
B. 2N2O5(g)=4NO2(g)+O2(g)
C. MgCO3(s)=MgO(s)+CO2(g)
D. 2CO(g)=2C(s)+O2(g)
10.反应A(g)+3B(g) 2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是 【来源:21·世纪·教育·网】
A.v(A)= 0.15 mol /(L·min) B.v(B)= 0.06 mol /(L·min)
C.v(C)= 0.04 mol /(L·s) D.v(D) = 0.01 mol /(L·s))
11. 对化学反应限度的叙述,错误的是( )
A.任何可逆反应都有一定的限度 B.化学反应的限度是不可改变的
C.化学反应的限度与时间的长短无关 D.化学反应达到最大限度时正逆反应速率相等
12. 一个原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池的合理组成是( )21cnjy.com
正极 负极 电解质溶液
A Cu Zn CuSO4
B Cu Zn H2SO4
C Zn Cu CuCl2
D Mg Zn CuCl2
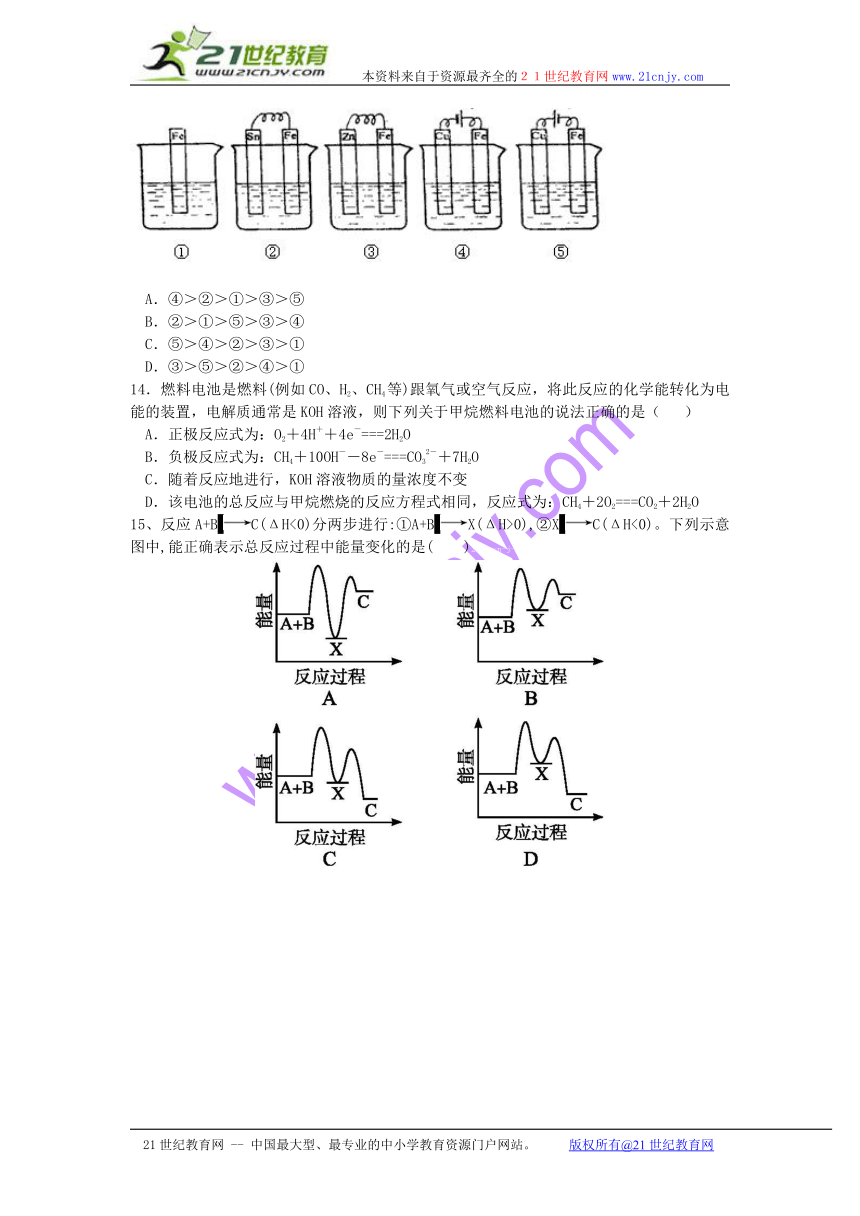
13、下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
( http: / / www.21cnjy.com )
A.④>②>①>③>⑤
B.②>①>⑤>③>④
C.⑤>④>②>③>①
D.③>⑤>②>④>①
14.燃料电池是燃料(例如CO、H ( http: / / www.21cnjy.com )2、CH4等)跟氧气或空气反应,将此反应的化学能转化为电能的装置,电解质通常是KOH溶液,则下列关于甲烷燃料电池的说法正确的是( )
A.正极反应式为:O2+4H++4e-===2H2O
B.负极反应式为:CH4+10OH--8e-===CO32-+7H2O
C.随着反应地进行,KOH溶液物质的量浓度不变
D.该电池的总反应与甲烷燃烧的反应方程式相同,反应式为:CH4+2O2===CO2+2H2O
15、反应A+B C(ΔH<0)分两步进行:①A+B X(ΔH>0),②X C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )2-1-c-n-j-y
( http: / / www.21cnjy.com )
第Ⅰ卷(非选择题 共55分)
二.填空题
16.(7分)(1)在一定条件下,在水溶液中 1 molCl–、ClOx–(x=1,2,3,4)的能量(kJ)的相对大小如右图所示。 21*cnjy*com
①D是 (填离子符号)
②B → A + C反应的热化学方程式为:
(用离子符号表示)
(2)已知:C(s)+O2(g)== CO2(g) △H1= -393.5kJ/mol
CO(g)+1/2O2(g)== CO2(g) △H2= -283kJ/mol
则1 mol C(s)与O2(g)反应生成CO(g)的△H=
17.(14分)某课外兴趣小组用如图装置进行实验,试回答:
(1)若开始时开关K与a连接,则A电极反应式为_____________________________.【来源:21cnj*y.co*m】
(2)若开始时开关K与b连接,这种方法经常用 ( http: / / www.21cnjy.com )于金属的防护这种防护措施叫做 _________________________, 则B电极反应式为 __________________________________,电解的总反应离子方程式为 _________________________________.
(3)开关K与b连接,铁和 ( http: / / www.21cnjy.com )石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为 ______________________ , Fe(OH)2在空气中被氧化的化学方程式为:【出处:21教育名师】
__________________________________
18.(10分)在25℃ ( http: / / www.21cnjy.com )时,用石墨电极电解2.0L 2.5 mol.L -1CuSO4溶液,如有0.4 mol电子发生转移,请回答下列问题:【版权所有:21教育】
⑴阳极发生_______(填“氧化”或“还原”)反应,阴极的电极反应式为 __________________________。21教育名师原创作品
⑵电解后得到的铜的质量是________,得到氧气的体积是________(标准状况)。
⑶如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差_____________
19.(10分)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ mol-1.回答有关中和反应的问题.21教育网
(1)用0.1mol NaOH配成稀溶液与足量稀硝酸反应,能放出___________热量.
(2)如图装置中缺少的的仪器名称是____________碎泡沫塑料的作用____________
(3)若通过实验测定中和热的△H,其结 ( http: / / www.21cnjy.com )果常常大于-57.3kJ mol-1,其原因可能是______________________________
(4)用相同浓度和体积的氨水(NH3 ( http: / / www.21cnjy.com )H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”、“偏小”、“无影响”).
20.(14分)某探究小组用HNO ( http: / / www.21cnjy.com )3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填空:21*cnjy*com
实验
编号 温度
(℃) 大理石
规格 HNO3浓度(mol/L) 实验目的
① 25 粗颗粒 2.00 (I)实验①和②探究浓度对反应速率的影响;
(II)实验①和③探究_____C_________对反应速率的影响;(III)实验①和④探究___D___________对反应速率的影响
② 25 粗颗粒 A
③ B 粗颗粒 2.00
④ 25 细颗粒 2.00
(2)实验①中CO2质量随时间变化的关系 ( http: / / www.21cnjy.com )见下图.计算实验①中70s-90s范围内用HNO3表示的平均反应速率= ___________(忽略溶液体积变化,不需要写出计算过程).
( http: / / www.21cnjy.com )
(3)该实验小组用如图实验装置进行实验。
①除电子天平、干燥管、胶头滴管、秒表、玻璃棒、锥形瓶、药匙、胶塞等仪器外,必需的玻璃仪器还有____________21·cn·jy·com
②干燥管中应放置的试剂是___________
A.碱石灰 B.无水CaCl2固体
C.P2O5 D.浓硫酸
闽侯二中、闽清高级中学、永泰二中、连江侨中、长乐二中
2014—2015学年第一学期高二年段化学学科答案卷
(满分为100 分,答题时间为 90 分钟)
一、选择题:(本题包括15小题,每小题3分,共45分。每小题只有一个正确答案)
题号 1 2 3 4 5 6 7 8
答案
题号 9 10 11 12 13 14 15
答案
二.填空题(共55分)
16.(7分)
(1)①
②
(2)△H=
17.(14分)(1) _____________________________.
(2)_________________________,
__________________________________,
_________________________________. 21·世纪*教育网
(3) ______________________ ,
__________________________________
18.(10分)
⑴_______
__________________________。
⑵________________, ________________
⑶_____________________
19.(10分)(1)___________
(2)____________ ____________
(3)______________________________
(4)____________
20.(14分)
(1)A______________________B_______________________www-2-1-cnjy-com
C_______________________D______________________
(2)________
①____________
②____________
2014—2015学年第一学期高二年段化学学科参考答案
一、选择题:(本题包括15小题,每小题3分,共45分。每小题只有一个正确答案)
题号 1 2 3 4 5 6 7 8
答案 D B A C C A D B
题号 9 10 11 12 13 14 15
答案 D C B A A B D
二.填空题(共55分)
16.(7分)
(1)(2分)①ClO4-
②3ClO—(aq)=ClO3—(aq) + 2Cl—(aq)ΔH=-117KJ/mol(3分)
(2)△H=-110.5 kJ/mol(2分)
17.(14分)(1) O2+2H2O+4e-═4OH-.(2分)
(2)外接电源的阴极保护法(2分)
2H++2e-=H2↑;(2分)
2Cl-+2H2O2OH-+H2↑ +Cl2 ↑ (3分)
(3)Fe-2e-===Fe2+(2分)
4Fe(OH) 2+O2+H2O===4Fe(OH) 3(3分)
18.(10分)每空各2分
⑴氧化
Cu2++2e-=Cu
⑵12.8g, 2.24L
⑶25.6g
19.(10分) 每空各2分
(1)5.73KJ
(2)环形玻璃搅拌棒 保温、隔热作用
(3)实验过程中难免有热量散失
(4)偏小
20.(14分)每空各2分
(1)A:1.00mol/L B:35℃
C:温度 D:固体物质的表面积
(2) 0.01mol L-1 S-1 ①量筒
②BC
学校 班级 姓名 座号
---------密………封…………装…………订………线----------
. .
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
福建省闽清高级中学等四校2014-2015高二上学期期中联考化学试题
可能用到的相对分子质量:H:1 O:16 Cu:64
第Ⅰ卷(选择题 共45分)
一、选择题(每小题3分,共45分。下列每小题所给选项只有一项符合题意)
1.未来新能源的特点是资源丰富,在使用时 ( http: / / www.21cnjy.com )对环境无污染或很少污染,且有些可以再生。下列属于新能源( )
①天然气 ②氢能 ③生物质能 ④太阳能 ⑤ 石油 ⑥燃料电池 ⑦风能 ⑧煤
A.①②③④⑥ B.④⑤⑥⑦⑧
C.③④⑤⑥⑦ D.②③④⑥⑦
2. 我国第五套人民币中的一元硬币材料为钢芯镀镍,依据你所掌握的电镀原理,你认为在硬币制作时,钢芯应做 ( )21世纪教育网版权所有
A.阳极 B.阴极 C.正极 D.负极
3. 已知:①1 mol H2分子中化学键 ( http: / / www.21cnjy.com )断裂时需要吸收436kJ的能量②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量,下列叙述正确的是( )2·1·c·n·j·y
A.氢气和氯气反应生成2mol氯化氢气体 ( http: / / www.21cnjy.com ),反应的△H=-183kJ/mol
B.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
C.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=+183kJ/mol
D.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/mol
4.下列热化学方程式书写正确的是(的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H= —1367.0 kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H= + 57.3kJ/mol(中和热)
C.S(s)+O2(g)==SO2(g);△H= —296.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
5.用3g铁屑与适量3mo ( http: / / www.21cnjy.com )l/L稀硫酸反应制取H2气体,若要增大反应速率,可采取的措施是:
① 再加入适量1mol/L硫酸 ②再 ( http: / / www.21cnjy.com )加入适量3mol/L硫酸 ③ 改用3g铁粉 ④适当升高温度 ⑤ 加几滴CuSO4溶液 ⑥ 用98%浓硫酸代替1mol/L稀硫酸
A.①④⑤ B.②③④ C.③④⑤ D.③④⑥
6.原电池的负极和电解池的阴极所发生的反应分别是 ( )
A.氧化、还原 B.还原、氧化 C.氧化、氧化 D.还原、还原
7.下列能说明可逆反应2A(g)+B(g)2 C(g)+D(g)在一定条件下已达到化学平衡状态的事实是( )
A.容器内压强不随时间的变化而变化 B.容器内A、B、C、D四者共存
C.C的生成速率是D的生成速率的两倍 D. A的消耗速率是D的消耗速率的两倍
8.下列有关能量的判断或表示方法正确的是( )
A. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
B. 从C(s,石墨)====C(s,金刚石) ΔH=+1.9kJ·mol-1,可知石墨比金刚石更稳定
C.由H+(aq)+ OH-(aq ( http: / / www.21cnjy.com ))=== H2O(l) ΔH =-57.3 kJ·mol-1 ,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJwww.21-cn-jy.com
D.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为
2H2(g)+O2(g)==== 2H2O(l) ΔH=-285.8 kJ·mol-1
9.下列反应中,熵减小的是( )
A. (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
B. 2N2O5(g)=4NO2(g)+O2(g)
C. MgCO3(s)=MgO(s)+CO2(g)
D. 2CO(g)=2C(s)+O2(g)
10.反应A(g)+3B(g) 2C(g)+ 2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是 【来源:21·世纪·教育·网】
A.v(A)= 0.15 mol /(L·min) B.v(B)= 0.06 mol /(L·min)
C.v(C)= 0.04 mol /(L·s) D.v(D) = 0.01 mol /(L·s))
11. 对化学反应限度的叙述,错误的是( )
A.任何可逆反应都有一定的限度 B.化学反应的限度是不可改变的
C.化学反应的限度与时间的长短无关 D.化学反应达到最大限度时正逆反应速率相等
12. 一个原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池的合理组成是( )21cnjy.com
正极 负极 电解质溶液
A Cu Zn CuSO4
B Cu Zn H2SO4
C Zn Cu CuCl2
D Mg Zn CuCl2
13、下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( )
( http: / / www.21cnjy.com )
A.④>②>①>③>⑤
B.②>①>⑤>③>④
C.⑤>④>②>③>①
D.③>⑤>②>④>①
14.燃料电池是燃料(例如CO、H ( http: / / www.21cnjy.com )2、CH4等)跟氧气或空气反应,将此反应的化学能转化为电能的装置,电解质通常是KOH溶液,则下列关于甲烷燃料电池的说法正确的是( )
A.正极反应式为:O2+4H++4e-===2H2O
B.负极反应式为:CH4+10OH--8e-===CO32-+7H2O
C.随着反应地进行,KOH溶液物质的量浓度不变
D.该电池的总反应与甲烷燃烧的反应方程式相同,反应式为:CH4+2O2===CO2+2H2O
15、反应A+B C(ΔH<0)分两步进行:①A+B X(ΔH>0),②X C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )2-1-c-n-j-y
( http: / / www.21cnjy.com )
第Ⅰ卷(非选择题 共55分)
二.填空题
16.(7分)(1)在一定条件下,在水溶液中 1 molCl–、ClOx–(x=1,2,3,4)的能量(kJ)的相对大小如右图所示。 21*cnjy*com
①D是 (填离子符号)
②B → A + C反应的热化学方程式为:
(用离子符号表示)
(2)已知:C(s)+O2(g)== CO2(g) △H1= -393.5kJ/mol
CO(g)+1/2O2(g)== CO2(g) △H2= -283kJ/mol
则1 mol C(s)与O2(g)反应生成CO(g)的△H=
17.(14分)某课外兴趣小组用如图装置进行实验,试回答:
(1)若开始时开关K与a连接,则A电极反应式为_____________________________.【来源:21cnj*y.co*m】
(2)若开始时开关K与b连接,这种方法经常用 ( http: / / www.21cnjy.com )于金属的防护这种防护措施叫做 _________________________, 则B电极反应式为 __________________________________,电解的总反应离子方程式为 _________________________________.
(3)开关K与b连接,铁和 ( http: / / www.21cnjy.com )石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为 ______________________ , Fe(OH)2在空气中被氧化的化学方程式为:【出处:21教育名师】
__________________________________
18.(10分)在25℃ ( http: / / www.21cnjy.com )时,用石墨电极电解2.0L 2.5 mol.L -1CuSO4溶液,如有0.4 mol电子发生转移,请回答下列问题:【版权所有:21教育】
⑴阳极发生_______(填“氧化”或“还原”)反应,阴极的电极反应式为 __________________________。21教育名师原创作品
⑵电解后得到的铜的质量是________,得到氧气的体积是________(标准状况)。
⑶如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差_____________
19.(10分)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ mol-1.回答有关中和反应的问题.21教育网
(1)用0.1mol NaOH配成稀溶液与足量稀硝酸反应,能放出___________热量.
(2)如图装置中缺少的的仪器名称是____________碎泡沫塑料的作用____________
(3)若通过实验测定中和热的△H,其结 ( http: / / www.21cnjy.com )果常常大于-57.3kJ mol-1,其原因可能是______________________________
(4)用相同浓度和体积的氨水(NH3 ( http: / / www.21cnjy.com )H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会____________(填“偏大”、“偏小”、“无影响”).
20.(14分)某探究小组用HNO ( http: / / www.21cnjy.com )3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g.
(1)请完成以下实验设计表,并在实验目的一栏中填空:21*cnjy*com
实验
编号 温度
(℃) 大理石
规格 HNO3浓度(mol/L) 实验目的
① 25 粗颗粒 2.00 (I)实验①和②探究浓度对反应速率的影响;
(II)实验①和③探究_____C_________对反应速率的影响;(III)实验①和④探究___D___________对反应速率的影响
② 25 粗颗粒 A
③ B 粗颗粒 2.00
④ 25 细颗粒 2.00
(2)实验①中CO2质量随时间变化的关系 ( http: / / www.21cnjy.com )见下图.计算实验①中70s-90s范围内用HNO3表示的平均反应速率= ___________(忽略溶液体积变化,不需要写出计算过程).
( http: / / www.21cnjy.com )
(3)该实验小组用如图实验装置进行实验。
①除电子天平、干燥管、胶头滴管、秒表、玻璃棒、锥形瓶、药匙、胶塞等仪器外,必需的玻璃仪器还有____________21·cn·jy·com
②干燥管中应放置的试剂是___________
A.碱石灰 B.无水CaCl2固体
C.P2O5 D.浓硫酸
闽侯二中、闽清高级中学、永泰二中、连江侨中、长乐二中
2014—2015学年第一学期高二年段化学学科答案卷
(满分为100 分,答题时间为 90 分钟)
一、选择题:(本题包括15小题,每小题3分,共45分。每小题只有一个正确答案)
题号 1 2 3 4 5 6 7 8
答案
题号 9 10 11 12 13 14 15
答案
二.填空题(共55分)
16.(7分)
(1)①
②
(2)△H=
17.(14分)(1) _____________________________.
(2)_________________________,
__________________________________,
_________________________________. 21·世纪*教育网
(3) ______________________ ,
__________________________________
18.(10分)
⑴_______
__________________________。
⑵________________, ________________
⑶_____________________
19.(10分)(1)___________
(2)____________ ____________
(3)______________________________
(4)____________
20.(14分)
(1)A______________________B_______________________www-2-1-cnjy-com
C_______________________D______________________
(2)________
①____________
②____________
2014—2015学年第一学期高二年段化学学科参考答案
一、选择题:(本题包括15小题,每小题3分,共45分。每小题只有一个正确答案)
题号 1 2 3 4 5 6 7 8
答案 D B A C C A D B
题号 9 10 11 12 13 14 15
答案 D C B A A B D
二.填空题(共55分)
16.(7分)
(1)(2分)①ClO4-
②3ClO—(aq)=ClO3—(aq) + 2Cl—(aq)ΔH=-117KJ/mol(3分)
(2)△H=-110.5 kJ/mol(2分)
17.(14分)(1) O2+2H2O+4e-═4OH-.(2分)
(2)外接电源的阴极保护法(2分)
2H++2e-=H2↑;(2分)
2Cl-+2H2O2OH-+H2↑ +Cl2 ↑ (3分)
(3)Fe-2e-===Fe2+(2分)
4Fe(OH) 2+O2+H2O===4Fe(OH) 3(3分)
18.(10分)每空各2分
⑴氧化
Cu2++2e-=Cu
⑵12.8g, 2.24L
⑶25.6g
19.(10分) 每空各2分
(1)5.73KJ
(2)环形玻璃搅拌棒 保温、隔热作用
(3)实验过程中难免有热量散失
(4)偏小
20.(14分)每空各2分
(1)A:1.00mol/L B:35℃
C:温度 D:固体物质的表面积
(2) 0.01mol L-1 S-1 ①量筒
②BC
学校 班级 姓名 座号
---------密………封…………装…………订………线----------
. .
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
