3.1.1弱电解质的电离 课件(共33张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1.1弱电解质的电离 课件(共33张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 13.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-29 23:10:12 | ||
图片预览










文档简介
(共33张PPT)
自然生态平衡:
水体污染
污染治理
第三章 水溶液中的电离平衡
人体内环境稳态:
水至关重要
第三章 水溶液中的电离平衡
第一节 弱电解质的电离
第一课时
课前复习:
电解质:在水溶液中或熔融状态下能导电的化合物
(1) 只需满足上述两条件之一能导电即可,电解质本身不一定能导电。
(2)电解质溶液中自由离子浓度越大,导电能力越强,离子所带电荷数越多,导电能力越强。
注意:
非电解质:在水溶液中和熔融状态下均不能导电的化合物
1.概念:
课前复习:
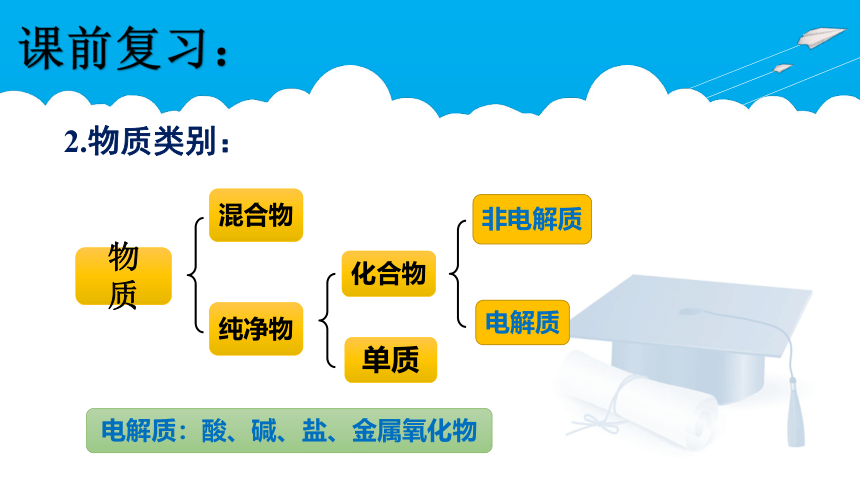
2.物质类别:
化合物
电解质
非电解质
单质
纯净物
混合物
物 质
电解质:酸、碱、盐、金属氧化物
下列物质能导电的是( ),属于电解质的是( ),属于非电解质的是( ) 。
a.铜丝 b.金刚石 c.石墨 d.熔融的NaCl
e.盐酸 f.蔗糖 g.CO2 h.NaOH固体
i.硫酸 j.Ba(OH) 2溶液 k.氯气 l.CaCO3
a c d e j
d h i l
f g
课前复习:
练一练:
习题小结:
课前复习:
(1)混合物既不是电解质,也不是非电解质。
(2)单质既不是电解质,也不是非电解质。
(3)CO2、SO2、NH3等物质溶于水能导电,是因为溶于水后生成H2CO3、H2SO3、NH3·H2O等电解质导电,不是其本身电离出的离子,故为非电解质。
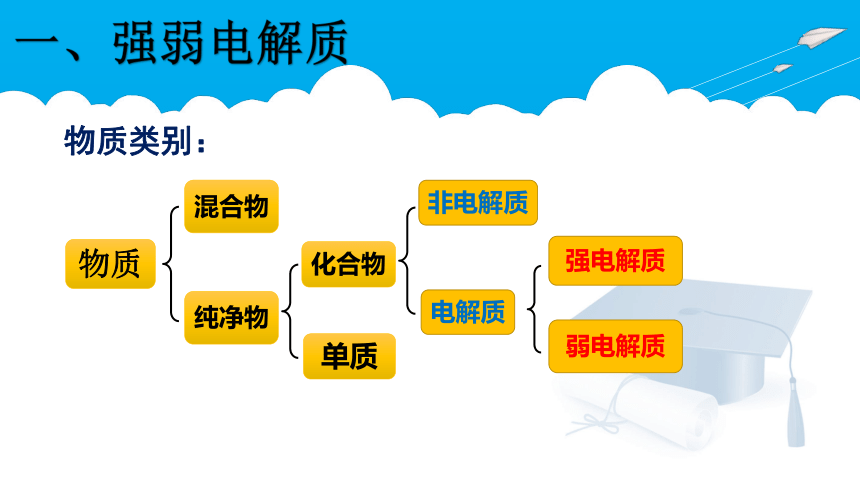
物质类别:
强电解质
弱电解质
化合物
非电解质
电解质
单质
纯净物
混合物
物质
一、强弱电解质
思考:
强弱电解质的划分依据是什么?何为强?何为弱?
一、强弱电解质
一、强弱电解质
1.概念:
(1)强电解质:在水溶液中能够全部电离的电解质。
(2)弱电解质:在水溶液中部分电离的电解质。
强电解质:强酸、强碱、绝大多数盐
弱电解质:弱酸、弱碱、水、少部分盐
思考:
如何用实验证明强弱电解质的电离程度不同?
一、强弱电解质
一、强弱电解质
2.实验探究(一):等体积、等浓度的HCl、CH3COOH / NaOH、 NH3·H2O /NaCl、乙醇分别测试其导电能力。
组号 物质 灯泡明暗程度
① HCl
CH3COOH
② NaOH
NH3·H2O
③ NaCl
乙醇
明
明
暗
明
暗
不亮
一、强弱电解质
2.实验探究(二):等体积的1mol/L 的HCl、CH3COOH分别与等量的镁条反应;并测量溶液的pH。
1 mol/L HCl 1 mol/L CH3COOH
与镁反应现象
溶液pH
镁条反应较快
镁条反应缓慢
0.00
2.38
补充:pH= — lg c(H+)
一、强弱电解质
2.实验分析与结论:
实验事实:
c(H+)不同
①灯泡明亮程度不同
②反应剧烈程度不同
相同体积、相同浓度的强电解质和弱电解质溶液,电离程度不同,强电解质完全电离,弱电解质部分电离。
结论:
电解质的强弱之分,在于电离程度不同
③pH分别为0.00和2.38
离子浓度不同
定性分析
定量分析
NaCl在水中溶解电离微观示意图
一、强弱电解质
HCl、CH3COOH分别在水中电离微观示意图
一、强弱电解质
在醋酸溶液中电离出的离子会杂乱无序的运动,这个过程CH3COO – 和H+会相遇然后相互碰撞形成醋酸分子,说明电离过程是可逆的。
弱电解质在水中分子、离子共存
一、强弱电解质
3.电离方程式的书写
(2)弱电解质:弱电解质部分电离,书写时用“ ”。
CH3COOH CH3COO- + H +
一、强弱电解质
NH3·H2O NH4 + + OH-
(1)强电解质:强电解质完全电离,书写时用“ = ”。
HCl = H+ + Cl-
NaOH = Na+ + OH-
一、强弱电解质
练习:写出下列电解质的电离方程式
HClO、CH3COONH4、NaHSO4
3.电离方程式的书写
(3)多元弱酸分步电离,分步书写,以第一步为主。
H2CO3 H+ + HCO3-
HCO3- H+ + CO32-
思考:如何证明碳酸的电离是分步进行的?
验证:盐酸滴入碳酸钠溶液中,开始时无明显现象,过一段时间后产生气泡。
一、强弱电解质
3.电离方程式的书写
(4)多元弱碱一步电离,一步书写。
Cu(OH)2 Cu2+ + 2OH-
一、强弱电解质
Fe(OH)3 Fe3+ + 3OH-
难溶于水
分子浓度小
二、弱电解质的电离
1.弱电解质的电离平衡
(1) 概念 :一定条件下,弱电解质在水溶液中的电离达到最大程度,此时,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,分子浓度和离子浓度保持不变,则达到电离平衡。
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
二、弱电解质的电离
1.弱电解质的电离平衡
(2) 建立过程 :
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
v(电离)
v(结合)
v(电离) = v(结合)
υ
t
电离平衡状态
二、弱电解质的电离
2.弱电解质的电离平衡的特征
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
逆
弱电解质的电离可逆
定
溶液中各分子、离子的浓度不变
等
v电离= v结合≠0
动
电离平衡是一种动态平衡
变
条件改变时,电离平衡发生移动
二、弱电解质的电离
以CH3COOH CH3COO- + H+为例
改变条件 平衡移动方向 C(H+) n(H+) 电离程度
①加热
②加水
③通HCl
④加NaAc(s)
⑤加NaOH(s)
⑥加冰醋酸
正向
正向
逆向
逆向
正向
正向
↑
↑
↓
↑
↑
↑
↑
↑
↑
↑
↑
↓
↓
↓
↓
↓
↓
↓
3.影响电离平衡的因素
二、弱电解质的电离
3.影响电离平衡的因素
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
内因:电解质本身的性质。
外因:温度、浓度
当外界条件改变时,平衡发生移动,同样可以用“勒夏特列原理”解释。
二、弱电解质的电离
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
(1)温度:电离过程是吸热过程,升高温度, 平衡正向移动 。
(2)浓度:
①加水稀释,电离程度增大。
②加电解质:
a.加弱电解质,平衡正向移动;
b.加入电离出的同种离子的强电解质,平衡逆向移动;
c.加入消耗电离出离子的强电解质,平衡正向移动。
3.影响电离平衡的因素
三、电离平衡常数
1.概念:
一定温度下,弱电解质达到电离平衡时,弱电解质电离生成的各种离子浓度幂之积与溶液中未电离的分子浓度的比值为一常数,叫做电离常数,用K表示。
2.表达式:
(1)一元弱酸:
(2)一元弱碱:
HA H+ + A-
Ka=
c ( H+) .c( A-)
c(HA)
MOH M+ + OH-
Kb=
c ( M+).c( OH- )
c(MOH)
三、电离平衡常数
2.表达式:
(3)多元弱酸:
H2S H+ + HS-
HS- H+ + S2-
(第一步电离 K1)
(第二步电离 K2)
K1=
c ( H+) .c( HS-)
c(H2S)
K2=
c ( H+) .c(S2-)
c(HS-)
对于多元弱酸来说,以第一步电离为主K1 》K2,一般要相差105。
三、电离平衡常数
3.K的意义:
K值越大,电离程度越大,相应酸(或碱)的酸(或碱)性越强。
4.影响K的因素:
电离平衡常数只与温度有关;升高温度,K 值增大。
二、弱电解质的电离
实验视频
THANKS
自然生态平衡:
水体污染
污染治理
第三章 水溶液中的电离平衡
人体内环境稳态:
水至关重要
第三章 水溶液中的电离平衡
第一节 弱电解质的电离
第一课时
课前复习:
电解质:在水溶液中或熔融状态下能导电的化合物
(1) 只需满足上述两条件之一能导电即可,电解质本身不一定能导电。
(2)电解质溶液中自由离子浓度越大,导电能力越强,离子所带电荷数越多,导电能力越强。
注意:
非电解质:在水溶液中和熔融状态下均不能导电的化合物
1.概念:
课前复习:
2.物质类别:
化合物
电解质
非电解质
单质
纯净物
混合物
物 质
电解质:酸、碱、盐、金属氧化物
下列物质能导电的是( ),属于电解质的是( ),属于非电解质的是( ) 。
a.铜丝 b.金刚石 c.石墨 d.熔融的NaCl
e.盐酸 f.蔗糖 g.CO2 h.NaOH固体
i.硫酸 j.Ba(OH) 2溶液 k.氯气 l.CaCO3
a c d e j
d h i l
f g
课前复习:
练一练:
习题小结:
课前复习:
(1)混合物既不是电解质,也不是非电解质。
(2)单质既不是电解质,也不是非电解质。
(3)CO2、SO2、NH3等物质溶于水能导电,是因为溶于水后生成H2CO3、H2SO3、NH3·H2O等电解质导电,不是其本身电离出的离子,故为非电解质。
物质类别:
强电解质
弱电解质
化合物
非电解质
电解质
单质
纯净物
混合物
物质
一、强弱电解质
思考:
强弱电解质的划分依据是什么?何为强?何为弱?
一、强弱电解质
一、强弱电解质
1.概念:
(1)强电解质:在水溶液中能够全部电离的电解质。
(2)弱电解质:在水溶液中部分电离的电解质。
强电解质:强酸、强碱、绝大多数盐
弱电解质:弱酸、弱碱、水、少部分盐
思考:
如何用实验证明强弱电解质的电离程度不同?
一、强弱电解质
一、强弱电解质
2.实验探究(一):等体积、等浓度的HCl、CH3COOH / NaOH、 NH3·H2O /NaCl、乙醇分别测试其导电能力。
组号 物质 灯泡明暗程度
① HCl
CH3COOH
② NaOH
NH3·H2O
③ NaCl
乙醇
明
明
暗
明
暗
不亮
一、强弱电解质
2.实验探究(二):等体积的1mol/L 的HCl、CH3COOH分别与等量的镁条反应;并测量溶液的pH。
1 mol/L HCl 1 mol/L CH3COOH
与镁反应现象
溶液pH
镁条反应较快
镁条反应缓慢
0.00
2.38
补充:pH= — lg c(H+)
一、强弱电解质
2.实验分析与结论:
实验事实:
c(H+)不同
①灯泡明亮程度不同
②反应剧烈程度不同
相同体积、相同浓度的强电解质和弱电解质溶液,电离程度不同,强电解质完全电离,弱电解质部分电离。
结论:
电解质的强弱之分,在于电离程度不同
③pH分别为0.00和2.38
离子浓度不同
定性分析
定量分析
NaCl在水中溶解电离微观示意图
一、强弱电解质
HCl、CH3COOH分别在水中电离微观示意图
一、强弱电解质
在醋酸溶液中电离出的离子会杂乱无序的运动,这个过程CH3COO – 和H+会相遇然后相互碰撞形成醋酸分子,说明电离过程是可逆的。
弱电解质在水中分子、离子共存
一、强弱电解质
3.电离方程式的书写
(2)弱电解质:弱电解质部分电离,书写时用“ ”。
CH3COOH CH3COO- + H +
一、强弱电解质
NH3·H2O NH4 + + OH-
(1)强电解质:强电解质完全电离,书写时用“ = ”。
HCl = H+ + Cl-
NaOH = Na+ + OH-
一、强弱电解质
练习:写出下列电解质的电离方程式
HClO、CH3COONH4、NaHSO4
3.电离方程式的书写
(3)多元弱酸分步电离,分步书写,以第一步为主。
H2CO3 H+ + HCO3-
HCO3- H+ + CO32-
思考:如何证明碳酸的电离是分步进行的?
验证:盐酸滴入碳酸钠溶液中,开始时无明显现象,过一段时间后产生气泡。
一、强弱电解质
3.电离方程式的书写
(4)多元弱碱一步电离,一步书写。
Cu(OH)2 Cu2+ + 2OH-
一、强弱电解质
Fe(OH)3 Fe3+ + 3OH-
难溶于水
分子浓度小
二、弱电解质的电离
1.弱电解质的电离平衡
(1) 概念 :一定条件下,弱电解质在水溶液中的电离达到最大程度,此时,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,分子浓度和离子浓度保持不变,则达到电离平衡。
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
二、弱电解质的电离
1.弱电解质的电离平衡
(2) 建立过程 :
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
v(电离)
v(结合)
v(电离) = v(结合)
υ
t
电离平衡状态
二、弱电解质的电离
2.弱电解质的电离平衡的特征
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
逆
弱电解质的电离可逆
定
溶液中各分子、离子的浓度不变
等
v电离= v结合≠0
动
电离平衡是一种动态平衡
变
条件改变时,电离平衡发生移动
二、弱电解质的电离
以CH3COOH CH3COO- + H+为例
改变条件 平衡移动方向 C(H+) n(H+) 电离程度
①加热
②加水
③通HCl
④加NaAc(s)
⑤加NaOH(s)
⑥加冰醋酸
正向
正向
逆向
逆向
正向
正向
↑
↑
↓
↑
↑
↑
↑
↑
↑
↑
↑
↓
↓
↓
↓
↓
↓
↓
3.影响电离平衡的因素
二、弱电解质的电离
3.影响电离平衡的因素
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
内因:电解质本身的性质。
外因:温度、浓度
当外界条件改变时,平衡发生移动,同样可以用“勒夏特列原理”解释。
二、弱电解质的电离
化学平衡
概念与平衡建立
平衡的特征
影响因素
化学平衡常数
(1)温度:电离过程是吸热过程,升高温度, 平衡正向移动 。
(2)浓度:
①加水稀释,电离程度增大。
②加电解质:
a.加弱电解质,平衡正向移动;
b.加入电离出的同种离子的强电解质,平衡逆向移动;
c.加入消耗电离出离子的强电解质,平衡正向移动。
3.影响电离平衡的因素
三、电离平衡常数
1.概念:
一定温度下,弱电解质达到电离平衡时,弱电解质电离生成的各种离子浓度幂之积与溶液中未电离的分子浓度的比值为一常数,叫做电离常数,用K表示。
2.表达式:
(1)一元弱酸:
(2)一元弱碱:
HA H+ + A-
Ka=
c ( H+) .c( A-)
c(HA)
MOH M+ + OH-
Kb=
c ( M+).c( OH- )
c(MOH)
三、电离平衡常数
2.表达式:
(3)多元弱酸:
H2S H+ + HS-
HS- H+ + S2-
(第一步电离 K1)
(第二步电离 K2)
K1=
c ( H+) .c( HS-)
c(H2S)
K2=
c ( H+) .c(S2-)
c(HS-)
对于多元弱酸来说,以第一步电离为主K1 》K2,一般要相差105。
三、电离平衡常数
3.K的意义:
K值越大,电离程度越大,相应酸(或碱)的酸(或碱)性越强。
4.影响K的因素:
电离平衡常数只与温度有关;升高温度,K 值增大。
二、弱电解质的电离
实验视频
THANKS
