【人教版】高中化学 选择性必修一 3.4 沉淀溶解平衡 课时训练(含解析)
文档属性
| 名称 | 【人教版】高中化学 选择性必修一 3.4 沉淀溶解平衡 课时训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-30 11:01:54 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
选必修1 3.4 沉淀溶解平衡 课时训练(含解析)
一、单选题
1.化学在生活中有着重要的应用。下列叙述错误的是( )
A.2019年春节部分地方燃放的“烟花”应用了某些金属的焰色反应
B.棉 麻 桑蚕丝均是天然有机高分子材料
C.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用稀硫酸反应即可
D.医院常用体积分数为75%的酒精溶液进行消毒
2.以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2.根据上述实验事实,可推知MnS具有的相关性质是( )
A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
3.根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 将2滴0.1mol·L-1MgSO4溶液滴入2mL0.1mol·L-1NaOH溶液中充分反应,再滴加0.1mol·L-1CuSO4溶液,出现蓝色沉淀 Ksp[Cu(OH)2]B 向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀 蛋白质发生了盐析
C 将乙醇和浓H2SO4混合加热产生的气体通入酸性KMnO4溶液,溶液褪色 乙醇发生消去反应 生成乙烯
D 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 淀粉部分水解或未水解
A.A B.B C.C D.D
4.化学与生产、生活密切相关。下列物质的应用与盐类水解无关的是( )
A.用热溶液清洗油污
B.用溶液处理锅炉水垢中的
C.用溶液除去焊接金属接头的铁锈
D.用明矾净水
5.下列解释事实的方程式错误的是( )
A.NO遇空气变为红棕色:2NO+O2=2NO2
B.用NaOH溶液吸收Cl2:OH-+Cl2=HClO+Cl-
C.明矾净水:Al3++3H2O Al(OH)3(胶体)+3H+
D.向AgI悬浊液中滴加Na2S溶液,沉淀变黑:2AgI(s)+S2-(aq) Ag2S(s)+2I-(aq)
6.如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是( )
A.加入Na2SO4(s)可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
7.下列说法错误的是( )
A.升高HCl稀溶液温度,溶液中c(H+)不变
B.常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-)
C.向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中氯离子浓度和溴离子浓度比不变
D.25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0
8.TK时,现有25mL含KCl和KCN的溶液,用0.1000mol L-1的硝酸银标准溶液对该混合液进行电位滴定(CN-与H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示:
已知:Ⅰ.Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]-②[Ag(CN)2]-+Ag+=2AgCN↓。
Ⅱ.TK时,Ksp(AgCN)=2×10-16,Ksp(AgCl)=2×10-10。
Ⅲ.电极电位E发生突跃时,说明滴定到达终点,即曲线上的转折点为化学计量点。
下列说法正确的是( )
A.在A点,生成AgCN的物质的量为0.025mol
B.c(KCN)=0.02000mol L-1,c(KCl)=0.03000mol L-1
C.反应①的平衡常数为K1,反应②的平衡常数为K2,则K1×K2=2Ksp(AgCN)
D.将AgCN饱和溶液和AgCl饱和溶液等体积混合,加入足量硝酸银溶液,析出固体AgCN多与AgCl
9.下列物质间不能发生化学反应的是( )
A.AgCl固体和KI溶液 B.Na2SO4固体和浓盐酸
C.CH3COONa固体和浓盐酸 D.NaHCO3固体和石灰水
10.化学与社会、生活密切相关。下列说法错误的是( )
A.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
B.泡沫灭火剂利用了硫酸铝溶液与碳酸氢钠溶液混合后能发生剧烈双水解反应
C.打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释
D.明矾净水与自来水的杀菌消毒原理相同
二、多选题
11.常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。下列叙述正确的是( )
A.Ksp(Ag2C2O4)等于10-6
B.n点表示Ag2C2O4的不饱和溶液
C.向c(Cl-)=c(C2O )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl- 2AgCl+C2O 的平衡常数为108
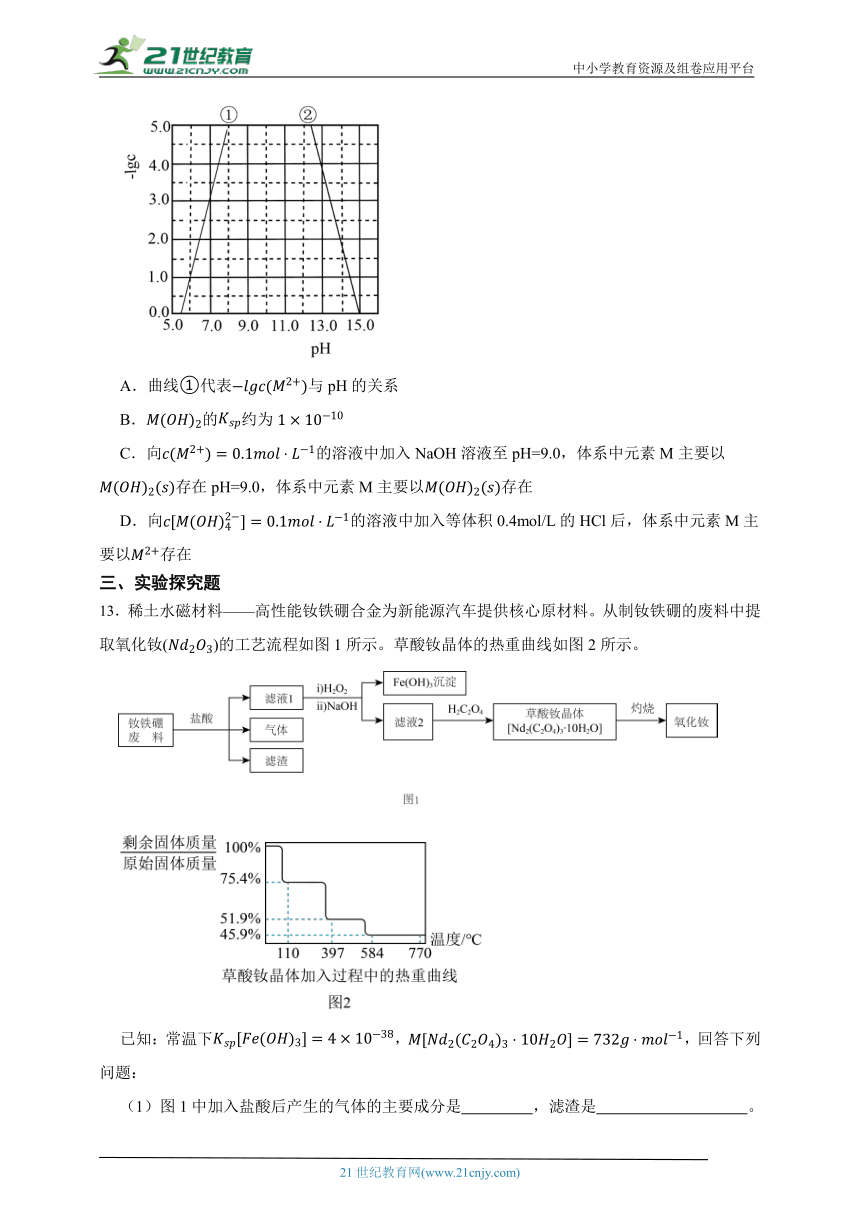
12.某元素M的氢氧化物在水中的溶解反应为:、,25℃,-lgc与pH的关系如图所示,c为或浓度的值,下列说法错误的是( )
A.曲线①代表与pH的关系
B.的约为
C.向的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以存在pH=9.0,体系中元素M主要以存在
D.向的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以存在
三、实验探究题
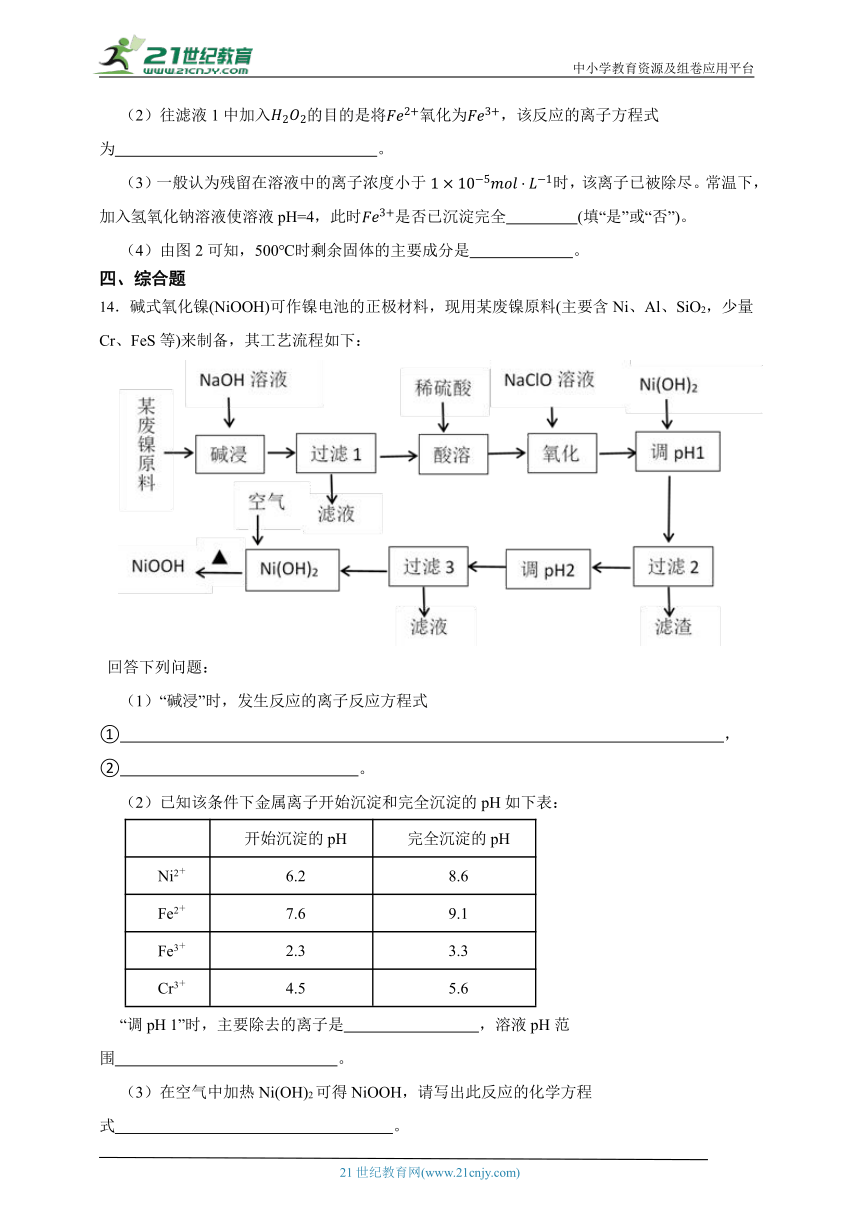
13.稀土水磁材料——高性能钕铁硼合金为新能源汽车提供核心原材料。从制钕铁硼的废料中提取氧化钕()的工艺流程如图1所示。草酸钕晶体的热重曲线如图2所示。
已知:常温下,,回答下列问题:
(1)图1中加入盐酸后产生的气体的主要成分是 ,滤渣是 。
(2)往滤液1中加入的目的是将氧化为,该反应的离子方程式为 。
(3)一般认为残留在溶液中的离子浓度小于时,该离子已被除尽。常温下,加入氢氧化钠溶液使溶液pH=4,此时是否已沉淀完全 (填“是”或“否”)。
(4)由图2可知,500℃时剩余固体的主要成分是 。
四、综合题
14.碱式氧化镍(NiOOH)可作镍电池的正极材料,现用某废镍原料(主要含Ni、Al、SiO2,少量Cr、FeS等)来制备,其工艺流程如下:
回答下列问题:
(1)“碱浸”时,发生反应的离子反应方程式① ,② 。
(2)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH 完全沉淀的pH
Ni2+ 6.2 8.6
Fe2+ 7.6 9.1
Fe3+ 2.3 3.3
Cr3+ 4.5 5.6
“调pH 1”时,主要除去的离子是 ,溶液pH范围 。
(3)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式 。
(4)在酸性溶液中CrO 可以转化成Cr2O ,用离子方程式表示该转化反应 ,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO 沉淀完全(c(CrO )≤1×10-5mol·L-1),溶液中钡离子浓度至少为 mol·L-1。
15.
(1)已知在25℃时,Ksp[Mg(OH)2]=3.2×10-11,假设饱和Mg(OH)2溶液的浓度为1 g/mL,则Mg(OH)2的溶解度为 g。
(2)在25℃时,向0.02 mol L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为 mol L-1。
(3)25℃时,向浓度均为0.02mol L﹣1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀 (填化学式);当两种沉淀共存时, = 。(已知25℃时,Ksp[Cu(OH)2]=2.2×10-20)(每个小题都写出计算过程)
答案解析部分
1.【答案】C
【解析】【解答】A.“烟花”的焰色来源于高温下金属离子的焰色反应,故A不符合题意;
B. 棉麻的成分是纤维素、桑蚕丝的成分是蛋白质,都是天然有机高分子材料,故B不符合题意;
C.锅炉水垢中含有的CaSO4,处理该水垢的方法是:先用Na2CO3溶液处理将其转化为碳酸钙,再用盐酸将碳酸钙溶解。若用稀硫酸溶解,由于碳酸钙与硫酸反应生成微溶物硫酸钙,水垢不能完全除去,故C符合题意;
D. 体积分数为75%的酒精溶液的消毒效果好,所以医院常用体积分数为75%的酒精溶液进行消毒,故D不符合题意。
故答案为:C。
【分析】A.焰色反应是某些金属元素在高温下特定光波的现象;
B.注意天然、高分子、有机物几个重点词语;
C.水后中加入过量碳酸钠溶液后,应再加入盐酸;
D.75% 的酒精能使蛋白质变性。
2.【答案】C
【解析】【解答】添加过量的难溶电解质MnS,可使MnCl2溶液中的Cu2+、Pb2+、Cd2+形成硫化物沉淀,根据沉淀转化的一般原则,说明MnS转化为更难溶的CuS、PbS、CdS,即MnS的溶解度大于CuS、PbS、CdS;C符合题意。
故答案为:C
【分析】根据题干信息,添加过量的难溶电解质MnS,发生了如下反应:Cu2++MnS=CuS+Mn2+、Pb2++MnS=PbS+Mn2+、Cd2++MnS=CdS+Mn2+。
3.【答案】D
【解析】【解答】A.将2滴0.1mol·L-1MgSO4溶液滴入2mL0.1mol·L-1NaOH溶液中充分反应,产生氢氧化镁沉淀、氢氧化钠溶液过量,再滴加的0.1mol·L-1CuSO4溶液必然与氢氧化钠溶液反应出现蓝色沉淀,故不能判断是否实现了沉淀转化、不能得出Ksp[Cu(OH)2]B.醋酸铅是重金属盐,向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀,蛋白质发生了变性,则B不符合题意;
C.乙醇易挥发、碳碳双键和乙醇都能使酸性KMnO4溶液褪色,不能证明乙醇发生消去反应生成乙烯,则C不符合题意;
D.碘单质遇到淀粉溶液显蓝色、中性中碘水不会被消耗,则D符合题意;
故答案为:D。
【分析】A. NaOH溶液过量,分别与硫酸镁、硫酸铜反应生成沉淀;
B.蛋白质溶液中加入醋酸铅溶液,发生变性;
C.挥发的乙醇可使酸性高锰酸钾溶液褪色;
D.淀粉遇碘变蓝。
4.【答案】B
【解析】【解答】A.热
溶液水解的碱性可使油污水解而被去除,A项不符合题意;
B.
溶液通过沉淀的转化将
转化为
,与水解无关,B项符合题意;
C.
溶液水解的酸性可将铁锈溶解,C项不符合题意;
D.明矾溶于水电离出的
水解可产生
胶体,使悬浮物发生聚沉,D项不符合题意;
故答案为:B。
【分析】A.碳酸根离子水解呈碱性,油脂在碱性条件下水解;
B.溶解度小的沉淀转化为溶解度更小的沉淀;
C.铵根离子水解呈酸性;
D.铝离子水解生成氢氧化铝的胶体,吸附沉淀。
5.【答案】B
【解析】【解答】A.NO遇空气,会与空气中的O2反应:2NO+O2=2NO2,生成红棕色气体NO2,A不符合题意;
B.用NaOH溶液吸收Cl2,由于溶液呈碱性,HClO不能稳定存在,所以离子方程式为2OH-+Cl2=ClO-+Cl-+H2O,B符合题意;
C.明矾溶于水,Al3+会发生水解:Al3++3H2O Al(OH)3(胶体)+3H+,生成的Al(OH)3(胶体)具有吸附水中悬浮颗粒物的能力,所以可用于净水,C不符合题意;
D.由于Ag2S的Ksp比AgI的Ksp还小,所以向AgI悬浊液中滴加Na2S溶液,发生反应:2AgI(s)+S2-(aq) Ag2S(s)+2I-(aq),从而产生黑色沉淀,D不符合题意;
故答案为:B。
【分析】A.NO无色,易被氧化为红棕色的NO2;
B.氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
C.铝离子水解生成氢氧化铝胶体;
D.Ag2S溶解度小于AgI,发生沉淀的转化。
6.【答案】D
【解析】【解答】A、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,A不符合题意;
B、在曲线上方区域(不含曲线)任意一点时,Qc>Ksp,溶液过饱和,有沉淀析出,B不符合题意;
C、c点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,所以可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b),C不符合题意;
D、升高温度, 溶剂水蒸发,c(SO42-)、c(Ba2+)均增大,溶液过饱和,有沉淀析出,不会使溶液由b点变为c点,D符合题意;
故答案为;D
【分析】A.根据浓度对平衡移动的影响分析;
B.曲线上的点表示平衡状态,曲线上方的点可形成沉淀;
C.蒸发溶剂,溶液中c(Ba2+)、c(SO42-)都增大;
D.升高温度,b点会移向曲线上方;
7.【答案】A
【解析】【解答】A.升高HCl稀溶液温度,溶液中c(H+)增加,升温水的电离常数增大,c(H+)增加,故A符合题意;
B.常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则c(H+)= c(OH-),结合电荷守恒可知混合液中:c(Na+)=c(CH3COO-),故B不符合题意;
C.B.氯离子和溴离子浓度的比值为: ,Ksp与温度有关,与浓度无关,则加入少量AgNO3后,AgCl和AgBr的溶度积Ksp均不变,则氯离子和溴离子浓度的比值不变,故C不符合题意;
D.NaOH为强电解质,加水稀释100倍,c(OH-)=0.001mol/L,c(H+)=1×10-14mol/L÷0.001mol/L=1×10-11mol/L,所得溶液的pH=11.0,故D不符合题意;
故答案为:A。
【分析】A.升高温度,水的离子积变大,氢离子浓度变大
B.根据电荷守恒即可判断
C.根据难溶电解质的转换即可判断,温度不变,比值不变
D.根据给出的数据即可计算出溶液的pH
8.【答案】B
【解析】【解答】A.A点加入2.50mLAgNO3标准溶液,根据反应Ag++2CN-=[Ag(CN)2]-,原溶液中n(CN-)=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,生成的[Ag(CN)2]-物质的量为2.5×10-4mol,AB段才会发生的反应为[Ag(CN)2]-+Ag+=2AgCN↓,生成AgCN的物质的量为0mol,A不符合题意;
B.AB段会发生的反应为[Ag(CN)2]-+Ag+=2AgCN↓,2.5×10-4mol[Ag(CN)2]-消耗2.5×10-4molAg+转化成AgCN沉淀,所耗标准AgNO3溶液的体积为V== =2.5×10-3L=2.50mL,则B点的V1=2.50+2.50=5.00原溶液中n(CN-)=cV=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,c(KCN)===0.02000mol·L-1,BC段发生的反应为Ag++Cl-=AgCl↓,BC段消耗的标准AgNO3溶液的体积为12.50mL-5.00mL=7.50mL,则原溶液中n(Cl-)=cV=0.1000mol·L-1×7.50×10-3L=7.5×10-4mol,c(KCl)== =0.03000mol·L-1,B符合题意;
C.①Ag++2CN-=[Ag(CN)2]-的平衡常数为K1=,②[Ag(CN)2]-+Ag+=2AgCN↓的平衡常数为:K2=,Ksp(AgCN)=c(Ag+)·c(CN-),则K1×K2=,C不符合题意;
D.因为Ksp(AgCN)< Ksp(AgCl),所以混合溶液中c(CN-)-),等体积n(CN-)-)加入足量硝酸银后根据CN-~AgCN,Cl-~AgCl,nAgCN,D不符合题意;
故答案为:B。
【分析】A.根据题意知,银离子和CN-的反应是分步反应,A点得到的是Ag(CN)-,不是AgCN
B.根据题意知在C点达到②滴定终点,结合数据即可计算出数据
C.根据公式代入即可写出关系式
D.根据比较Ksp的大小即可判断
9.【答案】B
【解析】【解答】A、根据沉淀的转化原理,反应能够由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行,KI溶液与AgCl固体混合搅拌,生成了溶解度更小的碘化银,故A不符合题意;
B、强酸制弱酸,不挥发性酸制挥发性的酸,硫酸和盐酸都是强酸,盐酸易挥发,硫酸难挥发,Na2SO4固体和浓盐酸不反应,故B符合题意;
C、强酸制弱酸,盐酸是强酸,醋酸是弱酸,CH3COONa固体和浓盐酸反应生成醋酸,故C不符合题意;
D、NaHCO3固体和石灰水生成难溶于水的碳酸钙和水,NaHCO3固体和石灰水能发生化学反应,故D不符合题意;
故答案为:B。
【分析】A.难溶物会向更加难容的方向进行转化;
B.挥发性酸不能制取难挥发性酸;
C.强酸可以制取弱酸;
D.碳酸氢根离子能与氢氧根离子反应,生成的碳酸根离子与钙离子反应生成碳酸钙沉淀。
10.【答案】D
【解析】【解答】A.硫酸钙微溶,碳酸钙难溶,锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理转化为更难溶的CaCO3,CaCO3能溶于盐酸而除去,故A符合题意;
B.泡沫灭火器装有碳酸氢钠溶液和硫酸铝溶液,二者混合发生双水解生成氢氧化铝和二氧化碳,故B符合题意;
C.因在较大压强的作用下二氧化碳被压入汽水瓶中,打开汽水瓶,压强减小,溶解平衡向逆向移动,则二氧化碳逸出,即可用勒复特列原理解释,故C符合题意;
D.明矾中的铝离子在水中水解生成氢氧化铝胶体能吸附水中的悬浮颗粒,从而起到净水作用,但是明矾没有强氧化性不能杀菌消毒,故D不符合题意;
故答案为:D。
【分析】明矾中的铝离子在水溶液中会水解为氢氧化铝胶体,胶体具有吸附杂质粒子的作用;自来水中的杀菌消毒使用的是氯水,是利用了其强氧化性,二者的原理是不相同的。
11.【答案】B,D
【解析】【解答】A.结合图示数据,Ksp(Ag2C2O4)= c2(Ag+)×c(C2O )= (10-4)2×10-2=10-10,故A不符合题意;
B.n点时c(Ag+)比Ag2C2O4溶解平衡曲线上的c(Ag+)小,Ag2C2O4溶解平衡向形成Ag+的方向移动,所以n点表示Ag2C2O4的不饱和溶液,故B符合题意;
C.由图象可知,当阴离子浓度c(Cl-)=c(C2O )相同时,生成AgCl沉淀所需的c(Ag+)小,则向c(Cl-)=c(C2O )的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C不符合题意;
D.Ag2C2O4+2Cl- 2AgCl+C2O 的平衡常数K= ,此时溶液中的c(Ag+)相同,故有:K= = =108,故D符合题意;
故答案为:BD。
【分析】A.根据Ksp(Ag2C2O4)= c2(Ag+)×c(C2O )计算;
B. 在n点,c(Ag+)大于平衡浓度;
C. 根据图象可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小;
D.Ag2C2O4+2Cl- 2AgCl+C2O 的平衡常数K= 。
12.【答案】B,D
【解析】【解答】A.由分析可知,曲线①代表-lg c(M2+)与pH的关系,A不符合题意;
B.由图象,pH=7.0时,-lg c(M2+)=3.0,则M(OH)2的Ksp=c(M2+)·c2(OH-)=1×10-17,B符合题意;
C.向c(M2+)=0.1mol/L的溶液中加入NaOH溶液至pH=9.0,根据图像,pH=9.0时,c(M2+)、c[M(OH)]均极小,则体系中元素M主要以M(OH)2(s)存在,C不符合题意;
D.c[M(OH)]=0.1mol/L的溶液中,由于溶解平衡是少量的,因此加入等体积的0.4mol/L的HCl后,体系中元素M仍主要以M(OH)存在,D符合题意;
故答案为:BD。
【分析】根据溶解反应可知,当酸性较强时, 的平衡正向移动,的平衡逆向移动,则曲线①代表-lg c(M2+)与pH的关系,曲线②代表-lg c( )与pH的关系。
13.【答案】(1)氢气;硼和不溶性杂质
(2)2Fe2++H2O2+2H+=2Fe3++2H2O
(3)是
(4)
【解析】【解答】(1)由分析可知,图1中加入盐酸后产生的气体的主要成分是氢气,滤渣是硼和不溶性杂质;
(2)加入的目的是将氧化为,该反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)加入氢氧化钠溶液使溶液pH=4,pOH=10,若铁离子恰好沉淀完全浓度为,则Q=,说明此时已经沉淀完全;
(4)草酸钕晶体加热首先失去结晶水,,结晶水含量为,剩余固体75.4%,则110℃时已经完全失去结晶水;当温度大于584℃时得到,则在500℃时发生自身氧化还原反应,草酸根离子生成一氧化碳、二氧化碳、碳酸根离子,由电子守恒可知反应生成二价碳、三价碳的比例为1:1,得到钕的碳酸盐,,此时剩余固体的摩尔质量为,的摩尔质量为,故由图2可知,500℃时剩余固体的主要成分是。
【分析】一般思路:确定该流程的目的,看懂生产流程图;了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用;解析流程图并思考从原料到产品依次进行了什么反应,利用了什么原理。
14.【答案】(1)2Al+2OH-+2H2O=2AlO +3H2↑(或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑);SiO2 + 2OH-=SiO +H2O
(2)Fe3+、Cr3+;5.6~6.2(或5.6≤pH<6.2)
(3)4Ni(OH)2+O2 4NiOOH+2H2O
(4)2CrO +2H+ Cr2O +H2O;1.2×10-5
【解析】【解答】(1) 由分析可知,碱浸时发生的反应为铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为Al+2OH-+2H2O=2AlO +3H2↑或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为SiO2 + 2OH-=SiO +H2O,故答案为:Al+2OH-+2H2O=2AlO +3H2↑(或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑);SiO2 + 2OH-=SiO +H2O;
(2) 由分析可知,向得到的硫酸盐溶液中加入次氯酸钠溶液将亚铁离子氧化为铁离子后,调节溶液pH 1在5.6~6.2范围内,将铁离子和铬离子转化为氢氧化铁和氢氧化铬沉淀,过滤除去铁离子和铬离子,故答案为:Fe3+、Cr3+;5.6~6.2(或5.6≤pH<6.2);
(3) 空气中加热氢氧化镍可得碱式氧化镍的反应为氢氧化镍被空气中氧气在加热条件下氧化为碱式氧化镍,反应的化学方程式为4Ni(OH)2+O2 4NiOOH+2H2O,故答案为:4Ni(OH)2+O2 4NiOOH+2H2O;
(4) 在酸性溶液中,铬酸根离子与氢离子反应生成重铬酸根和水,反应的离子方程式为2CrO +2H+ Cr2O +H2O;由BaCrO4的Ksp=1.2×10-10可知,要使溶液中CrO 沉淀完全,溶液中钡离子浓度c(Ba2+)≥ = =1.2×10-5 mol·L-1,故答案为:2CrO +2H+ Cr2O +H2O;1.2×10-5。
【分析】由题给流程可知,向某废镍原料加入氢氧化钠溶液碱浸,铝和二氧化硅与氢氧化钠溶液反应生成偏铝酸钠和硅酸钠,过滤得到滤渣1;向滤渣1中加入稀硫酸酸溶,镍、铬和硫化亚铁与硫酸反应得到硫酸盐溶液,向反应后的溶液中加入次氯酸钠溶液将亚铁离子氧化为铁离子后,加入氢氧化镍调节溶液pH在5.6~6.2范围内,将铁离子和铬离子转化为氢氧化铁和氢氧化铬沉淀,过滤得到含有氢氧化铁和氢氧化铬的滤渣2和硫酸镍溶液;向硫酸镍溶液加入碱溶液调节溶液pH,过滤得到氢氧化镍沉淀;在空气中加热氢氧化镍制得碱式氧化镍。
15.【答案】(1)1.16×10-3
(2)4.0×10-5
(3)Cu(OH)2;1.45×109
【解析】【解答】(1)设饱和溶液Mg(OH)2的物质的量浓度为c,则c(Mg2+)×c2(OH-)=4c3=3.2×10-11,解得c=2×10-4 mol/L,假设饱和Mg(OH)2溶液的浓度为1 g/mL,则100 mL溶液的质量为100 g,含有溶质的质量m[Mg(OH)2]=2×10-4 mol/L×0.1 L×58 g/mol=1.16×10-3 g,溶剂的质量约为100 g,所以其溶解度S≈1.16×10-3 g;(2)如果溶液中Qc>Ksp[Mg(OH)2]就能产生沉淀,c(OH-)= =4.0×10-5 mol/L;(3)溶度积常数越小的物质先产生沉淀,由于Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以先生成沉淀的是Cu(OH)2,当两种沉淀共存时, =1.45×109。
【分析】(1)求溶解度,就是要求在某一物温度下,固体在100g溶剂中溶解溶质达到饱和状态的固体的质量,给出的条件是 饱和Mg(OH)2溶液的浓度为1 g/mL ,即是在100mL溶液里面有溶液为100g.根据难溶物质的dialing平衡,额可以求出镁离子的物质的量浓度,可以计算出100mL溶液含有的氢氧化镁的质量即可
(2)根据Ksp=c(Mg2+)×c2(OH-)可以计算出氢氧根离子的浓度即可
(3)根据溶度积进行比较,越小越难溶解,根据Ksp(Mg(OH)2)=c(Mg2+)×c2(OH-),Ksp(Cu(OH)2)=c(Cu2+)×c2(OH-)进行公式换算即可求出答案
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
选必修1 3.4 沉淀溶解平衡 课时训练(含解析)
一、单选题
1.化学在生活中有着重要的应用。下列叙述错误的是( )
A.2019年春节部分地方燃放的“烟花”应用了某些金属的焰色反应
B.棉 麻 桑蚕丝均是天然有机高分子材料
C.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用稀硫酸反应即可
D.医院常用体积分数为75%的酒精溶液进行消毒
2.以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再经蒸发、结晶,可得纯净的MnCl2.根据上述实验事实,可推知MnS具有的相关性质是( )
A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
3.根据下列实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 将2滴0.1mol·L-1MgSO4溶液滴入2mL0.1mol·L-1NaOH溶液中充分反应,再滴加0.1mol·L-1CuSO4溶液,出现蓝色沉淀 Ksp[Cu(OH)2]
C 将乙醇和浓H2SO4混合加热产生的气体通入酸性KMnO4溶液,溶液褪色 乙醇发生消去反应 生成乙烯
D 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 淀粉部分水解或未水解
A.A B.B C.C D.D
4.化学与生产、生活密切相关。下列物质的应用与盐类水解无关的是( )
A.用热溶液清洗油污
B.用溶液处理锅炉水垢中的
C.用溶液除去焊接金属接头的铁锈
D.用明矾净水
5.下列解释事实的方程式错误的是( )
A.NO遇空气变为红棕色:2NO+O2=2NO2
B.用NaOH溶液吸收Cl2:OH-+Cl2=HClO+Cl-
C.明矾净水:Al3++3H2O Al(OH)3(胶体)+3H+
D.向AgI悬浊液中滴加Na2S溶液,沉淀变黑:2AgI(s)+S2-(aq) Ag2S(s)+2I-(aq)
6.如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法错误的是( )
A.加入Na2SO4(s)可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
7.下列说法错误的是( )
A.升高HCl稀溶液温度,溶液中c(H+)不变
B.常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-)
C.向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中氯离子浓度和溴离子浓度比不变
D.25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0
8.TK时,现有25mL含KCl和KCN的溶液,用0.1000mol L-1的硝酸银标准溶液对该混合液进行电位滴定(CN-与H+的反应可以忽略),获得电动势(E)和硝酸银标准溶液体积(V)的电位滴定曲线如图所示:
已知:Ⅰ.Ag+与CN-反应过程为:①Ag++2CN-=[Ag(CN)2]-②[Ag(CN)2]-+Ag+=2AgCN↓。
Ⅱ.TK时,Ksp(AgCN)=2×10-16,Ksp(AgCl)=2×10-10。
Ⅲ.电极电位E发生突跃时,说明滴定到达终点,即曲线上的转折点为化学计量点。
下列说法正确的是( )
A.在A点,生成AgCN的物质的量为0.025mol
B.c(KCN)=0.02000mol L-1,c(KCl)=0.03000mol L-1
C.反应①的平衡常数为K1,反应②的平衡常数为K2,则K1×K2=2Ksp(AgCN)
D.将AgCN饱和溶液和AgCl饱和溶液等体积混合,加入足量硝酸银溶液,析出固体AgCN多与AgCl
9.下列物质间不能发生化学反应的是( )
A.AgCl固体和KI溶液 B.Na2SO4固体和浓盐酸
C.CH3COONa固体和浓盐酸 D.NaHCO3固体和石灰水
10.化学与社会、生活密切相关。下列说法错误的是( )
A.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
B.泡沫灭火剂利用了硫酸铝溶液与碳酸氢钠溶液混合后能发生剧烈双水解反应
C.打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释
D.明矾净水与自来水的杀菌消毒原理相同
二、多选题
11.常温下,用AgNO3溶液分别滴定浓度均为0.01mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O 的水解)。下列叙述正确的是( )
A.Ksp(Ag2C2O4)等于10-6
B.n点表示Ag2C2O4的不饱和溶液
C.向c(Cl-)=c(C2O )的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4+2Cl- 2AgCl+C2O 的平衡常数为108
12.某元素M的氢氧化物在水中的溶解反应为:、,25℃,-lgc与pH的关系如图所示,c为或浓度的值,下列说法错误的是( )
A.曲线①代表与pH的关系
B.的约为
C.向的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以存在pH=9.0,体系中元素M主要以存在
D.向的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以存在
三、实验探究题
13.稀土水磁材料——高性能钕铁硼合金为新能源汽车提供核心原材料。从制钕铁硼的废料中提取氧化钕()的工艺流程如图1所示。草酸钕晶体的热重曲线如图2所示。
已知:常温下,,回答下列问题:
(1)图1中加入盐酸后产生的气体的主要成分是 ,滤渣是 。
(2)往滤液1中加入的目的是将氧化为,该反应的离子方程式为 。
(3)一般认为残留在溶液中的离子浓度小于时,该离子已被除尽。常温下,加入氢氧化钠溶液使溶液pH=4,此时是否已沉淀完全 (填“是”或“否”)。
(4)由图2可知,500℃时剩余固体的主要成分是 。
四、综合题
14.碱式氧化镍(NiOOH)可作镍电池的正极材料,现用某废镍原料(主要含Ni、Al、SiO2,少量Cr、FeS等)来制备,其工艺流程如下:
回答下列问题:
(1)“碱浸”时,发生反应的离子反应方程式① ,② 。
(2)已知该条件下金属离子开始沉淀和完全沉淀的pH如下表:
开始沉淀的pH 完全沉淀的pH
Ni2+ 6.2 8.6
Fe2+ 7.6 9.1
Fe3+ 2.3 3.3
Cr3+ 4.5 5.6
“调pH 1”时,主要除去的离子是 ,溶液pH范围 。
(3)在空气中加热Ni(OH)2可得NiOOH,请写出此反应的化学方程式 。
(4)在酸性溶液中CrO 可以转化成Cr2O ,用离子方程式表示该转化反应 ,已知BaCrO4的Ksp=1.2×10-10,要使溶液中CrO 沉淀完全(c(CrO )≤1×10-5mol·L-1),溶液中钡离子浓度至少为 mol·L-1。
15.
(1)已知在25℃时,Ksp[Mg(OH)2]=3.2×10-11,假设饱和Mg(OH)2溶液的浓度为1 g/mL,则Mg(OH)2的溶解度为 g。
(2)在25℃时,向0.02 mol L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为 mol L-1。
(3)25℃时,向浓度均为0.02mol L﹣1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀 (填化学式);当两种沉淀共存时, = 。(已知25℃时,Ksp[Cu(OH)2]=2.2×10-20)(每个小题都写出计算过程)
答案解析部分
1.【答案】C
【解析】【解答】A.“烟花”的焰色来源于高温下金属离子的焰色反应,故A不符合题意;
B. 棉麻的成分是纤维素、桑蚕丝的成分是蛋白质,都是天然有机高分子材料,故B不符合题意;
C.锅炉水垢中含有的CaSO4,处理该水垢的方法是:先用Na2CO3溶液处理将其转化为碳酸钙,再用盐酸将碳酸钙溶解。若用稀硫酸溶解,由于碳酸钙与硫酸反应生成微溶物硫酸钙,水垢不能完全除去,故C符合题意;
D. 体积分数为75%的酒精溶液的消毒效果好,所以医院常用体积分数为75%的酒精溶液进行消毒,故D不符合题意。
故答案为:C。
【分析】A.焰色反应是某些金属元素在高温下特定光波的现象;
B.注意天然、高分子、有机物几个重点词语;
C.水后中加入过量碳酸钠溶液后,应再加入盐酸;
D.75% 的酒精能使蛋白质变性。
2.【答案】C
【解析】【解答】添加过量的难溶电解质MnS,可使MnCl2溶液中的Cu2+、Pb2+、Cd2+形成硫化物沉淀,根据沉淀转化的一般原则,说明MnS转化为更难溶的CuS、PbS、CdS,即MnS的溶解度大于CuS、PbS、CdS;C符合题意。
故答案为:C
【分析】根据题干信息,添加过量的难溶电解质MnS,发生了如下反应:Cu2++MnS=CuS+Mn2+、Pb2++MnS=PbS+Mn2+、Cd2++MnS=CdS+Mn2+。
3.【答案】D
【解析】【解答】A.将2滴0.1mol·L-1MgSO4溶液滴入2mL0.1mol·L-1NaOH溶液中充分反应,产生氢氧化镁沉淀、氢氧化钠溶液过量,再滴加的0.1mol·L-1CuSO4溶液必然与氢氧化钠溶液反应出现蓝色沉淀,故不能判断是否实现了沉淀转化、不能得出Ksp[Cu(OH)2]
C.乙醇易挥发、碳碳双键和乙醇都能使酸性KMnO4溶液褪色,不能证明乙醇发生消去反应生成乙烯,则C不符合题意;
D.碘单质遇到淀粉溶液显蓝色、中性中碘水不会被消耗,则D符合题意;
故答案为:D。
【分析】A. NaOH溶液过量,分别与硫酸镁、硫酸铜反应生成沉淀;
B.蛋白质溶液中加入醋酸铅溶液,发生变性;
C.挥发的乙醇可使酸性高锰酸钾溶液褪色;
D.淀粉遇碘变蓝。
4.【答案】B
【解析】【解答】A.热
溶液水解的碱性可使油污水解而被去除,A项不符合题意;
B.
溶液通过沉淀的转化将
转化为
,与水解无关,B项符合题意;
C.
溶液水解的酸性可将铁锈溶解,C项不符合题意;
D.明矾溶于水电离出的
水解可产生
胶体,使悬浮物发生聚沉,D项不符合题意;
故答案为:B。
【分析】A.碳酸根离子水解呈碱性,油脂在碱性条件下水解;
B.溶解度小的沉淀转化为溶解度更小的沉淀;
C.铵根离子水解呈酸性;
D.铝离子水解生成氢氧化铝的胶体,吸附沉淀。
5.【答案】B
【解析】【解答】A.NO遇空气,会与空气中的O2反应:2NO+O2=2NO2,生成红棕色气体NO2,A不符合题意;
B.用NaOH溶液吸收Cl2,由于溶液呈碱性,HClO不能稳定存在,所以离子方程式为2OH-+Cl2=ClO-+Cl-+H2O,B符合题意;
C.明矾溶于水,Al3+会发生水解:Al3++3H2O Al(OH)3(胶体)+3H+,生成的Al(OH)3(胶体)具有吸附水中悬浮颗粒物的能力,所以可用于净水,C不符合题意;
D.由于Ag2S的Ksp比AgI的Ksp还小,所以向AgI悬浊液中滴加Na2S溶液,发生反应:2AgI(s)+S2-(aq) Ag2S(s)+2I-(aq),从而产生黑色沉淀,D不符合题意;
故答案为:B。
【分析】A.NO无色,易被氧化为红棕色的NO2;
B.氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;
C.铝离子水解生成氢氧化铝胶体;
D.Ag2S溶解度小于AgI,发生沉淀的转化。
6.【答案】D
【解析】【解答】A、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2SO4,会增大c(SO42-),平衡左移,c(Ba2+)应降低,A不符合题意;
B、在曲线上方区域(不含曲线)任意一点时,Qc>Ksp,溶液过饱和,有沉淀析出,B不符合题意;
C、c点时溶液不饱和,蒸发溶剂水,c(SO42-)、c(Ba2+)均增大,所以可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b),C不符合题意;
D、升高温度, 溶剂水蒸发,c(SO42-)、c(Ba2+)均增大,溶液过饱和,有沉淀析出,不会使溶液由b点变为c点,D符合题意;
故答案为;D
【分析】A.根据浓度对平衡移动的影响分析;
B.曲线上的点表示平衡状态,曲线上方的点可形成沉淀;
C.蒸发溶剂,溶液中c(Ba2+)、c(SO42-)都增大;
D.升高温度,b点会移向曲线上方;
7.【答案】A
【解析】【解答】A.升高HCl稀溶液温度,溶液中c(H+)增加,升温水的电离常数增大,c(H+)增加,故A符合题意;
B.常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则c(H+)= c(OH-),结合电荷守恒可知混合液中:c(Na+)=c(CH3COO-),故B不符合题意;
C.B.氯离子和溴离子浓度的比值为: ,Ksp与温度有关,与浓度无关,则加入少量AgNO3后,AgCl和AgBr的溶度积Ksp均不变,则氯离子和溴离子浓度的比值不变,故C不符合题意;
D.NaOH为强电解质,加水稀释100倍,c(OH-)=0.001mol/L,c(H+)=1×10-14mol/L÷0.001mol/L=1×10-11mol/L,所得溶液的pH=11.0,故D不符合题意;
故答案为:A。
【分析】A.升高温度,水的离子积变大,氢离子浓度变大
B.根据电荷守恒即可判断
C.根据难溶电解质的转换即可判断,温度不变,比值不变
D.根据给出的数据即可计算出溶液的pH
8.【答案】B
【解析】【解答】A.A点加入2.50mLAgNO3标准溶液,根据反应Ag++2CN-=[Ag(CN)2]-,原溶液中n(CN-)=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,生成的[Ag(CN)2]-物质的量为2.5×10-4mol,AB段才会发生的反应为[Ag(CN)2]-+Ag+=2AgCN↓,生成AgCN的物质的量为0mol,A不符合题意;
B.AB段会发生的反应为[Ag(CN)2]-+Ag+=2AgCN↓,2.5×10-4mol[Ag(CN)2]-消耗2.5×10-4molAg+转化成AgCN沉淀,所耗标准AgNO3溶液的体积为V== =2.5×10-3L=2.50mL,则B点的V1=2.50+2.50=5.00原溶液中n(CN-)=cV=2×0.1000mol·L-1×2.50×10-3L=5×10-4mol,c(KCN)===0.02000mol·L-1,BC段发生的反应为Ag++Cl-=AgCl↓,BC段消耗的标准AgNO3溶液的体积为12.50mL-5.00mL=7.50mL,则原溶液中n(Cl-)=cV=0.1000mol·L-1×7.50×10-3L=7.5×10-4mol,c(KCl)== =0.03000mol·L-1,B符合题意;
C.①Ag++2CN-=[Ag(CN)2]-的平衡常数为K1=,②[Ag(CN)2]-+Ag+=2AgCN↓的平衡常数为:K2=,Ksp(AgCN)=c(Ag+)·c(CN-),则K1×K2=,C不符合题意;
D.因为Ksp(AgCN)< Ksp(AgCl),所以混合溶液中c(CN-)-),等体积n(CN-)-)加入足量硝酸银后根据CN-~AgCN,Cl-~AgCl,nAgCN,D不符合题意;
故答案为:B。
【分析】A.根据题意知,银离子和CN-的反应是分步反应,A点得到的是Ag(CN)-,不是AgCN
B.根据题意知在C点达到②滴定终点,结合数据即可计算出数据
C.根据公式代入即可写出关系式
D.根据比较Ksp的大小即可判断
9.【答案】B
【解析】【解答】A、根据沉淀的转化原理,反应能够由溶解度相对较大的物质向生成溶解度相对较小的物质的方向进行,KI溶液与AgCl固体混合搅拌,生成了溶解度更小的碘化银,故A不符合题意;
B、强酸制弱酸,不挥发性酸制挥发性的酸,硫酸和盐酸都是强酸,盐酸易挥发,硫酸难挥发,Na2SO4固体和浓盐酸不反应,故B符合题意;
C、强酸制弱酸,盐酸是强酸,醋酸是弱酸,CH3COONa固体和浓盐酸反应生成醋酸,故C不符合题意;
D、NaHCO3固体和石灰水生成难溶于水的碳酸钙和水,NaHCO3固体和石灰水能发生化学反应,故D不符合题意;
故答案为:B。
【分析】A.难溶物会向更加难容的方向进行转化;
B.挥发性酸不能制取难挥发性酸;
C.强酸可以制取弱酸;
D.碳酸氢根离子能与氢氧根离子反应,生成的碳酸根离子与钙离子反应生成碳酸钙沉淀。
10.【答案】D
【解析】【解答】A.硫酸钙微溶,碳酸钙难溶,锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理转化为更难溶的CaCO3,CaCO3能溶于盐酸而除去,故A符合题意;
B.泡沫灭火器装有碳酸氢钠溶液和硫酸铝溶液,二者混合发生双水解生成氢氧化铝和二氧化碳,故B符合题意;
C.因在较大压强的作用下二氧化碳被压入汽水瓶中,打开汽水瓶,压强减小,溶解平衡向逆向移动,则二氧化碳逸出,即可用勒复特列原理解释,故C符合题意;
D.明矾中的铝离子在水中水解生成氢氧化铝胶体能吸附水中的悬浮颗粒,从而起到净水作用,但是明矾没有强氧化性不能杀菌消毒,故D不符合题意;
故答案为:D。
【分析】明矾中的铝离子在水溶液中会水解为氢氧化铝胶体,胶体具有吸附杂质粒子的作用;自来水中的杀菌消毒使用的是氯水,是利用了其强氧化性,二者的原理是不相同的。
11.【答案】B,D
【解析】【解答】A.结合图示数据,Ksp(Ag2C2O4)= c2(Ag+)×c(C2O )= (10-4)2×10-2=10-10,故A不符合题意;
B.n点时c(Ag+)比Ag2C2O4溶解平衡曲线上的c(Ag+)小,Ag2C2O4溶解平衡向形成Ag+的方向移动,所以n点表示Ag2C2O4的不饱和溶液,故B符合题意;
C.由图象可知,当阴离子浓度c(Cl-)=c(C2O )相同时,生成AgCl沉淀所需的c(Ag+)小,则向c(Cl-)=c(C2O )的混合液中滴入AgNO3溶液时,先析出氯化银沉淀,故C不符合题意;
D.Ag2C2O4+2Cl- 2AgCl+C2O 的平衡常数K= ,此时溶液中的c(Ag+)相同,故有:K= = =108,故D符合题意;
故答案为:BD。
【分析】A.根据Ksp(Ag2C2O4)= c2(Ag+)×c(C2O )计算;
B. 在n点,c(Ag+)大于平衡浓度;
C. 根据图象可知,当阴离子浓度相同时,生成AgCl沉淀所需的c(Ag+)小;
D.Ag2C2O4+2Cl- 2AgCl+C2O 的平衡常数K= 。
12.【答案】B,D
【解析】【解答】A.由分析可知,曲线①代表-lg c(M2+)与pH的关系,A不符合题意;
B.由图象,pH=7.0时,-lg c(M2+)=3.0,则M(OH)2的Ksp=c(M2+)·c2(OH-)=1×10-17,B符合题意;
C.向c(M2+)=0.1mol/L的溶液中加入NaOH溶液至pH=9.0,根据图像,pH=9.0时,c(M2+)、c[M(OH)]均极小,则体系中元素M主要以M(OH)2(s)存在,C不符合题意;
D.c[M(OH)]=0.1mol/L的溶液中,由于溶解平衡是少量的,因此加入等体积的0.4mol/L的HCl后,体系中元素M仍主要以M(OH)存在,D符合题意;
故答案为:BD。
【分析】根据溶解反应可知,当酸性较强时, 的平衡正向移动,的平衡逆向移动,则曲线①代表-lg c(M2+)与pH的关系,曲线②代表-lg c( )与pH的关系。
13.【答案】(1)氢气;硼和不溶性杂质
(2)2Fe2++H2O2+2H+=2Fe3++2H2O
(3)是
(4)
【解析】【解答】(1)由分析可知,图1中加入盐酸后产生的气体的主要成分是氢气,滤渣是硼和不溶性杂质;
(2)加入的目的是将氧化为,该反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)加入氢氧化钠溶液使溶液pH=4,pOH=10,若铁离子恰好沉淀完全浓度为,则Q=,说明此时已经沉淀完全;
(4)草酸钕晶体加热首先失去结晶水,,结晶水含量为,剩余固体75.4%,则110℃时已经完全失去结晶水;当温度大于584℃时得到,则在500℃时发生自身氧化还原反应,草酸根离子生成一氧化碳、二氧化碳、碳酸根离子,由电子守恒可知反应生成二价碳、三价碳的比例为1:1,得到钕的碳酸盐,,此时剩余固体的摩尔质量为,的摩尔质量为,故由图2可知,500℃时剩余固体的主要成分是。
【分析】一般思路:确定该流程的目的,看懂生产流程图;了解流程图以外的文字描述、表格信息、后续设问中的提示性信息,并在下一步分析和解题中随时进行联系和调用;解析流程图并思考从原料到产品依次进行了什么反应,利用了什么原理。
14.【答案】(1)2Al+2OH-+2H2O=2AlO +3H2↑(或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑);SiO2 + 2OH-=SiO +H2O
(2)Fe3+、Cr3+;5.6~6.2(或5.6≤pH<6.2)
(3)4Ni(OH)2+O2 4NiOOH+2H2O
(4)2CrO +2H+ Cr2O +H2O;1.2×10-5
【解析】【解答】(1) 由分析可知,碱浸时发生的反应为铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子反应方程式为Al+2OH-+2H2O=2AlO +3H2↑或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式为SiO2 + 2OH-=SiO +H2O,故答案为:Al+2OH-+2H2O=2AlO +3H2↑(或2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑);SiO2 + 2OH-=SiO +H2O;
(2) 由分析可知,向得到的硫酸盐溶液中加入次氯酸钠溶液将亚铁离子氧化为铁离子后,调节溶液pH 1在5.6~6.2范围内,将铁离子和铬离子转化为氢氧化铁和氢氧化铬沉淀,过滤除去铁离子和铬离子,故答案为:Fe3+、Cr3+;5.6~6.2(或5.6≤pH<6.2);
(3) 空气中加热氢氧化镍可得碱式氧化镍的反应为氢氧化镍被空气中氧气在加热条件下氧化为碱式氧化镍,反应的化学方程式为4Ni(OH)2+O2 4NiOOH+2H2O,故答案为:4Ni(OH)2+O2 4NiOOH+2H2O;
(4) 在酸性溶液中,铬酸根离子与氢离子反应生成重铬酸根和水,反应的离子方程式为2CrO +2H+ Cr2O +H2O;由BaCrO4的Ksp=1.2×10-10可知,要使溶液中CrO 沉淀完全,溶液中钡离子浓度c(Ba2+)≥ = =1.2×10-5 mol·L-1,故答案为:2CrO +2H+ Cr2O +H2O;1.2×10-5。
【分析】由题给流程可知,向某废镍原料加入氢氧化钠溶液碱浸,铝和二氧化硅与氢氧化钠溶液反应生成偏铝酸钠和硅酸钠,过滤得到滤渣1;向滤渣1中加入稀硫酸酸溶,镍、铬和硫化亚铁与硫酸反应得到硫酸盐溶液,向反应后的溶液中加入次氯酸钠溶液将亚铁离子氧化为铁离子后,加入氢氧化镍调节溶液pH在5.6~6.2范围内,将铁离子和铬离子转化为氢氧化铁和氢氧化铬沉淀,过滤得到含有氢氧化铁和氢氧化铬的滤渣2和硫酸镍溶液;向硫酸镍溶液加入碱溶液调节溶液pH,过滤得到氢氧化镍沉淀;在空气中加热氢氧化镍制得碱式氧化镍。
15.【答案】(1)1.16×10-3
(2)4.0×10-5
(3)Cu(OH)2;1.45×109
【解析】【解答】(1)设饱和溶液Mg(OH)2的物质的量浓度为c,则c(Mg2+)×c2(OH-)=4c3=3.2×10-11,解得c=2×10-4 mol/L,假设饱和Mg(OH)2溶液的浓度为1 g/mL,则100 mL溶液的质量为100 g,含有溶质的质量m[Mg(OH)2]=2×10-4 mol/L×0.1 L×58 g/mol=1.16×10-3 g,溶剂的质量约为100 g,所以其溶解度S≈1.16×10-3 g;(2)如果溶液中Qc>Ksp[Mg(OH)2]就能产生沉淀,c(OH-)= =4.0×10-5 mol/L;(3)溶度积常数越小的物质先产生沉淀,由于Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以先生成沉淀的是Cu(OH)2,当两种沉淀共存时, =1.45×109。
【分析】(1)求溶解度,就是要求在某一物温度下,固体在100g溶剂中溶解溶质达到饱和状态的固体的质量,给出的条件是 饱和Mg(OH)2溶液的浓度为1 g/mL ,即是在100mL溶液里面有溶液为100g.根据难溶物质的dialing平衡,额可以求出镁离子的物质的量浓度,可以计算出100mL溶液含有的氢氧化镁的质量即可
(2)根据Ksp=c(Mg2+)×c2(OH-)可以计算出氢氧根离子的浓度即可
(3)根据溶度积进行比较,越小越难溶解,根据Ksp(Mg(OH)2)=c(Mg2+)×c2(OH-),Ksp(Cu(OH)2)=c(Cu2+)×c2(OH-)进行公式换算即可求出答案
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
