1.1.1反应热及 焓变 课件(共29张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1.1反应热及 焓变 课件(共29张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 96.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-30 22:19:32 | ||
图片预览







文档简介
(共29张PPT)
第一章 第一节 反应热
选择性必修一 化学反应原理
第一课时 反应热、焓变
知识导航
从宏,微观两个视角认识反应热
2
反应热的概念,中和反应反应热的测定原理
1
本节重点
本节难点
生活体验
神舟十五号发射
鸟巢上空的烟火
化学反应过程中释放或吸收的热量在生活、生产和科学研究中具有广泛应用。
边防战士使用自热火锅
木炭在空气里燃烧
木炭在氧气里燃烧
木炭在液氧里燃烧
化学反应中的能量变化是以物质变化为基础的,能量变化的多少与参加反应的物质种类和多少密切相关。与研究化学反应中的物质变化一样,研究化学反应中的能量变化同样具有重要意义。
那么,如何定量描述化学反应中释放或者吸收的热量呢?
新课导入
体系(系统)
研究反应热时,需要明确体系和环境
示例:盐酸与NaOH溶液的反应
试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系
被研究的物质系统
环境
盛溶液的试管和溶液之外的空气等看作环境
因温度不同而在体系与环境之间交换或传递的能量
热量
与体系相互影响的其他部分
说明
反应热及其测定
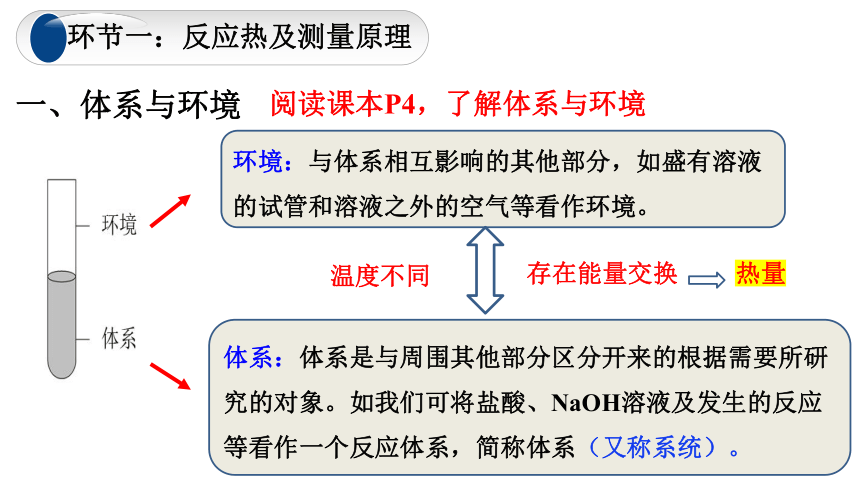
一、体系与环境
温度不同
阅读课本P4,了解体系与环境
环境:与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等看作环境。
体系:体系是与周围其他部分区分开来的根据需要所研究的对象。如我们可将盐酸、NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)。
存在能量交换
环节一:反应热及测量原理
热量
环节一:反应热及测量原理
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
定义
符号
Q
指反应发生后,使体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。
二、反应热
1、定义及表示
环节一:反应热及测量原理
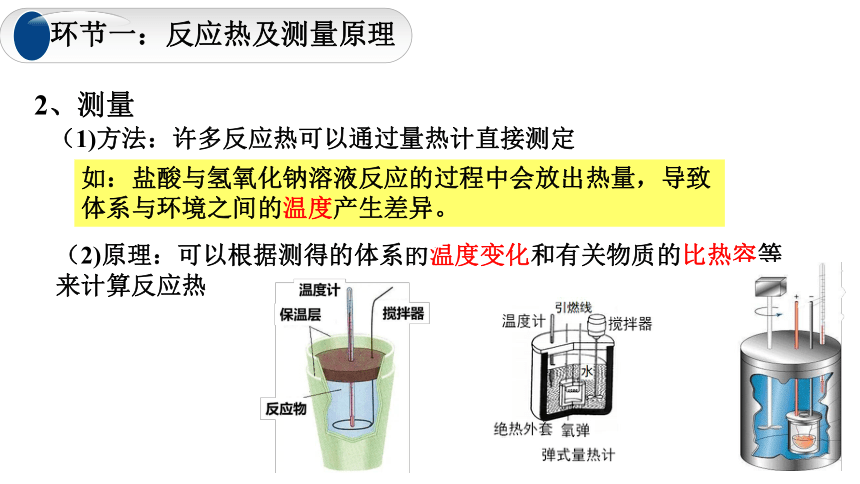
2、测量
(1)方法:许多反应热可以通过量热计直接测定
如:盐酸与氢氧化钠溶液反应的过程中会放出热量,导致体系与环境之间的温度产生差异。
(2)原理:可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热
环节一:反应热及测量原理
3、中和反应反应热的测定
阅读课本P5探究:中和反应反应热的测定
Q = mCΔt
Q:中和反应放出的热量 m:反应混合液的质量
C:反应混合液的比热容 Δt:反应前后溶液温度的差值
(1)实验原理
【思考】在测定中和反应的反应热时,应该测量哪些数据 如何根据测得的数据计算反应热
(2)需要测量的 数据
反应物质量(通过体积、浓度和密度可计算)
反应前体系的温度
反应后体系温度
环节一:反应热及测量原理
(3)实验装置及步骤
【思考】本实验为了提高测定的准确度采取了哪些措施 (提示:可从实验装置、试剂用量、实验操作三个角度考虑)
1. 使用同一个温度计测量温度,减少仪器误差。
2. 需要保温装置(内筒外壳上口对齐,中间有保温层)保证反应过程中,不与外界发生热交换。
3. 玻璃搅拌器(不传热)搅拌,保证溶液温度均匀等
实验装置
4、都用稀溶液,避免稀释带来的热量变化。采用碱稍过量的方法保证酸液完全被中和。
7、 重复上述步骤2次,取平均值使得测量温度差更准确。
6、混合后立即盖上杯盖以减少热量损失,密切关注温度的变化,记录最高的温度。
试剂
操作
5、测完酸后用水冲洗干净,擦干:防止测定碱液时带入酸液中和放热
(3)实验装置及步骤
【思考】本实验为了提高测定的准确度采取了哪些措施 (提示:可从仪器、试剂用量、实验操作三个角度考虑)
环节一:反应热及测量原理
(4)实验数据处理
注意:1、取三次测量所得温度差的平均值
2、t2 - t1若异常要舍去
环节一:反应热及测量原理
为了计算简便,可以近似的认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:
①50mL 盐酸的质量m1=50g, 50mL NaOH溶液质量m2=50g;
②反应后生成的溶液的比热容c=4.18 J/(g .℃),50 mL 0.50 mol/L盐酸与 50 mL 0.55 mol/LNaOH溶液发生中和反应时放出的热量为:Q=(m1+m2)·c·(t2-t1)=_______________。
0.418(t2-t1) kJ
③生成1mol水时放出的热量为 。
0.418(t2 - t1)
0.025
kJ
HCl(aq) + NaOH (aq) = H2O(l) + NaCl (aq)
1 1 1 ?
0.025mol 0.0275mol 0.025mol Q = 0.418(t2-t1) kJ
环节一:反应热及测量原理
50.2KJ
大量实验测得,在25℃和101kpa下强酸稀溶液与强碱稀溶液发生中和反应生成1mol水时,放出57.3kJ的热量。为何刚才实验中所测得的数据小于57.3 kJ呢?
(5)误差分析
可能的原因有:
1.温度计的读数有误(偏低)
2.实验过程中有液体洒在外面
3.混合酸、碱溶液时,动作缓慢,导致实验误差
4.隔热层隔热效果不好,致使实验过程中热量损失而导致误差
5.测过盐酸后的温度计未用水清洗而便立即去测碱的温度,致使酸碱发生中和反应后碱的温度偏高而引起误差
环节一:反应热及测量原理
【例1】为了测定酸碱反应的中和热,计算时至少需要的数据是( )
①酸溶液的浓度和体积
②碱溶液的浓度和体积
③比热容
④反应后溶液的质量(单位:kg)
⑤生成水的物质的量
⑥反应前后温度变化
⑦操作所需的时间
A.①②③⑥ B.①③④⑤
C.③④⑤⑥ D.全部
C
课堂小练
环节二:反应热与焓变
【思考】化学反应为什么会产生反应热?为什么有的化学反应释放能量,有的化学反应吸收能量?
这是因为化学反应前后体系的内能(符号为U)发生了变化。
体系内物质的各种能量的总和,受温度、压强和物质的凝聚状态等影响。
【思考】在科学研究和生产实践中,化学反应通常是在等压条件下进行的。如何描述等压条件下的反应热?
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为H)。
环节二:反应热与焓变
三、焓变—— 生成物的总焓与反应物的总焓之差,符号为 H
1、表达式:ΔH = H(生成物) - H(反应物)
在等压条件下进行的化学反应,反应热等于焓变。
3、规定:
①当反应体系放热时其焓减小,ΔH为“-”,即ΔH < 0;
②当反应体系吸热时其焓增大,ΔH为“+”,即ΔH > 0。
2、单位:kJ/mol(或kJ·mol-1)
放热反应 ΔH<0
焓(H)
反应物
生成物
反应进程
焓(H)
反应物
生成物
反应进程
吸热反应 ΔH>0
阅读课本P6 反应热与焓变相关内容
环节二:反应热与焓变
【例1】在25℃和101 kPa下,1 molH2与1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量,则该反应的反应热为:
ΔH= - 184.6 kJ/mol
【例2】在25 ℃和101 kPa下,1 mol C(如无特别说明,C均指石墨)与1 mol H2O(g)反应,生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
ΔH= +131.5 kJ/mol
【注意】ΔH右端的+或-不可省略,单位kJ/mol必须标出。
4、焓变的表示方法
以1 mol H2(g)和1 mol Cl2(g)在在25℃和101kPa下反应生成2mol HCl(g)的能量变化为例。
求H2(g)+Cl2(g)=2HCl(g)反应的反应热?
断键吸收能量:
436 KJ + 243 kJ = 679 kJ
成键放出能量:
431 kJ + 431 kJ = 862 kJ
ΔH = -183 kJ/mol
环节二:反应热与焓变
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
度来讨论反应热的实质
图示
吸收能量679 kJ
释放能量862 kJ
反应热
H= 183 kJ/mol
环节二:反应热与焓变
四、反应热的实质
反应热的实质:反应物中旧键的断裂(吸热),生成物中新键的形成(放热)。
H=断键吸收的总能量(E吸) - 成键放出的能量(E放)
【例1】依据信息估算2 mol H2(g) 和1 mol O2(g) 反应生成2 mol H2O(g) 的反应热 H=?
H(估算)= ∑E (反应物键能)-∑E (生成物键能)
=2×436 kJ/mol+498 kJ/mol-4×463.4 kJ/mol
= 483.6 kJ/mol
2H2(g) + O2(g) 2H2O(g) H=?
2H2
O2
4H
2O
2H2O
1 mol H2(g)中的H-H键断裂吸收436 kJ能量
1 mol O2(g)中的化学键断裂吸收498 kJ能量
形成H2O(g)中1 mol H-O键释放463.4 kJ能量
基元反应、过渡态理论及活化能
基元反应
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,往往要经过多个反应步骤才能实现。每一步反应都称为基元反应。
过渡态理论
过渡态理论认为,反应物分子并不只是通过简单碰撞直接形成产物,而是必须要经过一个过渡状态,并且达到这个过渡状态需要一定的活化能。
课堂拓展
1.下列说法正确的是( )
A.吸热反应使环境的温度升高
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为负值
D.需要加热才能发生的反应一定是吸热反应
C
2.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A.该反应每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B放出a kJ能量
B
随堂测试
3.SF6是一种优良的绝缘气体,分子结构中只存在S—F。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g)===SF6(g)的反应热ΔH为( )
A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.+430 kJ·mol-1
B
4.将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
B
随堂测试
5.下表是部分化学键的键能数据:
(1)已知1 mol白磷燃烧生成P4O10(s)的反应热ΔH=-2 982 kJ·mol-1,白磷(P4)、P4O6、P4O10结构如图所示,则上表中x=________。
(2)0.5 mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为________ kJ。
化学键 P—P P—O O==O P==O
键能/(kJ·mol-1) 198 360 498 x
585
819
随堂测试
环节三:课堂小结
中和反应反应热的测定
测量
选择性必修一 化学反应原理
感谢聆听!
第一章 第一节 反应热
选择性必修一 化学反应原理
第一课时 反应热、焓变
知识导航
从宏,微观两个视角认识反应热
2
反应热的概念,中和反应反应热的测定原理
1
本节重点
本节难点
生活体验
神舟十五号发射
鸟巢上空的烟火
化学反应过程中释放或吸收的热量在生活、生产和科学研究中具有广泛应用。
边防战士使用自热火锅
木炭在空气里燃烧
木炭在氧气里燃烧
木炭在液氧里燃烧
化学反应中的能量变化是以物质变化为基础的,能量变化的多少与参加反应的物质种类和多少密切相关。与研究化学反应中的物质变化一样,研究化学反应中的能量变化同样具有重要意义。
那么,如何定量描述化学反应中释放或者吸收的热量呢?
新课导入
体系(系统)
研究反应热时,需要明确体系和环境
示例:盐酸与NaOH溶液的反应
试管中的盐酸、NaOH溶液及发生的反应等看作一个反应体系
被研究的物质系统
环境
盛溶液的试管和溶液之外的空气等看作环境
因温度不同而在体系与环境之间交换或传递的能量
热量
与体系相互影响的其他部分
说明
反应热及其测定
一、体系与环境
温度不同
阅读课本P4,了解体系与环境
环境:与体系相互影响的其他部分,如盛有溶液的试管和溶液之外的空气等看作环境。
体系:体系是与周围其他部分区分开来的根据需要所研究的对象。如我们可将盐酸、NaOH溶液及发生的反应等看作一个反应体系,简称体系(又称系统)。
存在能量交换
环节一:反应热及测量原理
热量
环节一:反应热及测量原理
在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
定义
符号
Q
指反应发生后,使体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。
二、反应热
1、定义及表示
环节一:反应热及测量原理
2、测量
(1)方法:许多反应热可以通过量热计直接测定
如:盐酸与氢氧化钠溶液反应的过程中会放出热量,导致体系与环境之间的温度产生差异。
(2)原理:可以根据测得的体系的温度变化和有关物质的比热容等来计算反应热
环节一:反应热及测量原理
3、中和反应反应热的测定
阅读课本P5探究:中和反应反应热的测定
Q = mCΔt
Q:中和反应放出的热量 m:反应混合液的质量
C:反应混合液的比热容 Δt:反应前后溶液温度的差值
(1)实验原理
【思考】在测定中和反应的反应热时,应该测量哪些数据 如何根据测得的数据计算反应热
(2)需要测量的 数据
反应物质量(通过体积、浓度和密度可计算)
反应前体系的温度
反应后体系温度
环节一:反应热及测量原理
(3)实验装置及步骤
【思考】本实验为了提高测定的准确度采取了哪些措施 (提示:可从实验装置、试剂用量、实验操作三个角度考虑)
1. 使用同一个温度计测量温度,减少仪器误差。
2. 需要保温装置(内筒外壳上口对齐,中间有保温层)保证反应过程中,不与外界发生热交换。
3. 玻璃搅拌器(不传热)搅拌,保证溶液温度均匀等
实验装置
4、都用稀溶液,避免稀释带来的热量变化。采用碱稍过量的方法保证酸液完全被中和。
7、 重复上述步骤2次,取平均值使得测量温度差更准确。
6、混合后立即盖上杯盖以减少热量损失,密切关注温度的变化,记录最高的温度。
试剂
操作
5、测完酸后用水冲洗干净,擦干:防止测定碱液时带入酸液中和放热
(3)实验装置及步骤
【思考】本实验为了提高测定的准确度采取了哪些措施 (提示:可从仪器、试剂用量、实验操作三个角度考虑)
环节一:反应热及测量原理
(4)实验数据处理
注意:1、取三次测量所得温度差的平均值
2、t2 - t1若异常要舍去
环节一:反应热及测量原理
为了计算简便,可以近似的认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:
①50mL 盐酸的质量m1=50g, 50mL NaOH溶液质量m2=50g;
②反应后生成的溶液的比热容c=4.18 J/(g .℃),50 mL 0.50 mol/L盐酸与 50 mL 0.55 mol/LNaOH溶液发生中和反应时放出的热量为:Q=(m1+m2)·c·(t2-t1)=_______________。
0.418(t2-t1) kJ
③生成1mol水时放出的热量为 。
0.418(t2 - t1)
0.025
kJ
HCl(aq) + NaOH (aq) = H2O(l) + NaCl (aq)
1 1 1 ?
0.025mol 0.0275mol 0.025mol Q = 0.418(t2-t1) kJ
环节一:反应热及测量原理
50.2KJ
大量实验测得,在25℃和101kpa下强酸稀溶液与强碱稀溶液发生中和反应生成1mol水时,放出57.3kJ的热量。为何刚才实验中所测得的数据小于57.3 kJ呢?
(5)误差分析
可能的原因有:
1.温度计的读数有误(偏低)
2.实验过程中有液体洒在外面
3.混合酸、碱溶液时,动作缓慢,导致实验误差
4.隔热层隔热效果不好,致使实验过程中热量损失而导致误差
5.测过盐酸后的温度计未用水清洗而便立即去测碱的温度,致使酸碱发生中和反应后碱的温度偏高而引起误差
环节一:反应热及测量原理
【例1】为了测定酸碱反应的中和热,计算时至少需要的数据是( )
①酸溶液的浓度和体积
②碱溶液的浓度和体积
③比热容
④反应后溶液的质量(单位:kg)
⑤生成水的物质的量
⑥反应前后温度变化
⑦操作所需的时间
A.①②③⑥ B.①③④⑤
C.③④⑤⑥ D.全部
C
课堂小练
环节二:反应热与焓变
【思考】化学反应为什么会产生反应热?为什么有的化学反应释放能量,有的化学反应吸收能量?
这是因为化学反应前后体系的内能(符号为U)发生了变化。
体系内物质的各种能量的总和,受温度、压强和物质的凝聚状态等影响。
【思考】在科学研究和生产实践中,化学反应通常是在等压条件下进行的。如何描述等压条件下的反应热?
为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为H)。
环节二:反应热与焓变
三、焓变—— 生成物的总焓与反应物的总焓之差,符号为 H
1、表达式:ΔH = H(生成物) - H(反应物)
在等压条件下进行的化学反应,反应热等于焓变。
3、规定:
①当反应体系放热时其焓减小,ΔH为“-”,即ΔH < 0;
②当反应体系吸热时其焓增大,ΔH为“+”,即ΔH > 0。
2、单位:kJ/mol(或kJ·mol-1)
放热反应 ΔH<0
焓(H)
反应物
生成物
反应进程
焓(H)
反应物
生成物
反应进程
吸热反应 ΔH>0
阅读课本P6 反应热与焓变相关内容
环节二:反应热与焓变
【例1】在25℃和101 kPa下,1 molH2与1 mol Cl2反应生成2 mol HCl时放出184.6 kJ的热量,则该反应的反应热为:
ΔH= - 184.6 kJ/mol
【例2】在25 ℃和101 kPa下,1 mol C(如无特别说明,C均指石墨)与1 mol H2O(g)反应,生成1 mol CO和1 mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
ΔH= +131.5 kJ/mol
【注意】ΔH右端的+或-不可省略,单位kJ/mol必须标出。
4、焓变的表示方法
以1 mol H2(g)和1 mol Cl2(g)在在25℃和101kPa下反应生成2mol HCl(g)的能量变化为例。
求H2(g)+Cl2(g)=2HCl(g)反应的反应热?
断键吸收能量:
436 KJ + 243 kJ = 679 kJ
成键放出能量:
431 kJ + 431 kJ = 862 kJ
ΔH = -183 kJ/mol
环节二:反应热与焓变
化学反应中焓的变化
微观分析
以H2与Cl2反应生成HCl为例,从微观角度来讨论反应热的实质
度来讨论反应热的实质
图示
吸收能量679 kJ
释放能量862 kJ
反应热
H= 183 kJ/mol
环节二:反应热与焓变
四、反应热的实质
反应热的实质:反应物中旧键的断裂(吸热),生成物中新键的形成(放热)。
H=断键吸收的总能量(E吸) - 成键放出的能量(E放)
【例1】依据信息估算2 mol H2(g) 和1 mol O2(g) 反应生成2 mol H2O(g) 的反应热 H=?
H(估算)= ∑E (反应物键能)-∑E (生成物键能)
=2×436 kJ/mol+498 kJ/mol-4×463.4 kJ/mol
= 483.6 kJ/mol
2H2(g) + O2(g) 2H2O(g) H=?
2H2
O2
4H
2O
2H2O
1 mol H2(g)中的H-H键断裂吸收436 kJ能量
1 mol O2(g)中的化学键断裂吸收498 kJ能量
形成H2O(g)中1 mol H-O键释放463.4 kJ能量
基元反应、过渡态理论及活化能
基元反应
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,往往要经过多个反应步骤才能实现。每一步反应都称为基元反应。
过渡态理论
过渡态理论认为,反应物分子并不只是通过简单碰撞直接形成产物,而是必须要经过一个过渡状态,并且达到这个过渡状态需要一定的活化能。
课堂拓展
1.下列说法正确的是( )
A.吸热反应使环境的温度升高
B.当反应放热时ΔH>0,反应吸热时ΔH<0
C.化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH为负值
D.需要加热才能发生的反应一定是吸热反应
C
2.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A.该反应每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B放出a kJ能量
B
随堂测试
3.SF6是一种优良的绝缘气体,分子结构中只存在S—F。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F需吸收的能量分别为160 kJ、330 kJ。则反应S(s)+3F2(g)===SF6(g)的反应热ΔH为( )
A.-1 780 kJ·mol-1 B.-1 220 kJ·mol-1
C.-450 kJ·mol-1 D.+430 kJ·mol-1
B
4.将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
B
随堂测试
5.下表是部分化学键的键能数据:
(1)已知1 mol白磷燃烧生成P4O10(s)的反应热ΔH=-2 982 kJ·mol-1,白磷(P4)、P4O6、P4O10结构如图所示,则上表中x=________。
(2)0.5 mol白磷(P4)与O2完全反应生成固态P4O6放出的热量为________ kJ。
化学键 P—P P—O O==O P==O
键能/(kJ·mol-1) 198 360 498 x
585
819
随堂测试
环节三:课堂小结
中和反应反应热的测定
测量
选择性必修一 化学反应原理
感谢聆听!
