第四章 第二节 第1课时 电解原理 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第四章 第二节 第1课时 电解原理 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 425.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-30 17:13:23 | ||
图片预览




文档简介
第二节 电解池
第1课时 电解原理
[核心素养发展目标] 1.从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。2.建立电解过程的思维模型,理解电解的规律,判断电解的产物,书写电解的电极反应式和总反应式。
一、电解原理
1.实验探究:电解CuCl2溶液
(1)按如图所示装置完成实验,并填写下表。
实验现象 实验结论
电流表指针发生偏转 说明电解质溶液导电,形成____________
与负极相连的b极上逐渐覆盖了一层____________
与正极相连的a极上有刺激性气味的气体产生,能使湿润的淀粉碘化钾试纸______
(2)实验原理分析
①氯化铜溶液中存在的离子有__________________________,通电前这些离子在溶液中作自由运动。
②通电时在电场的作用下,溶液中的离子作定向运动,即Cl-、OH-移向a极,Cu2+、H+移向b极。
③a极电极反应式是_______________________________________________________,
b极电极反应式是_________________________________________________________,
总反应式是CuCl2Cu+Cl2↑。
④结论:电解质溶液的导电过程,就是电解质溶液的________过程。
2.电解和电解池
(1)电解:使电流通过_____________________而在阳极、阴极引起____________反应的过程。
(2)电解池(也称电解槽):在外接电源的作用下,将________转化为________的装置。
(3)电解池的电极名称。
阴极:与直流电源的________相连的电极,发生________反应;
阳极:与直流电源的________相连的电极,发生________反应。
(4)电解池的构成条件。
3.电解池的工作原理
接通电路后,电源、金属导线、阴极和阳极与电解质溶液形成闭合回路(如图所示)。
(1)电流方向:电源正极―→金属导线―→阳极―→电解质溶液―→阴极―→金属导线―→电源负极。
(2)电子、离子移动方向:在电解质溶液中,阳离子向阴极移动,阴离子向阳极移动;在外电路中,电子由阳极―→正极,负极―→阴极。
特别提醒 ①电解质溶液导电实际上是电解过程,发生氧化还原反应,是化学变化。②金属导电是因为在电场作用下,自由电子发生定向移动,是物理变化。
(1)电解池的两个电极必须是两个活动性不同的电极( )
(2)在电解池中与直流电源负极相连的电极是阴极( )
(3)在电解池中,电子从阳极流入电源正极( )
(4)电解质溶液的导电实验发生化学变化( )
(5)电解池的阳极发生还原反应( )
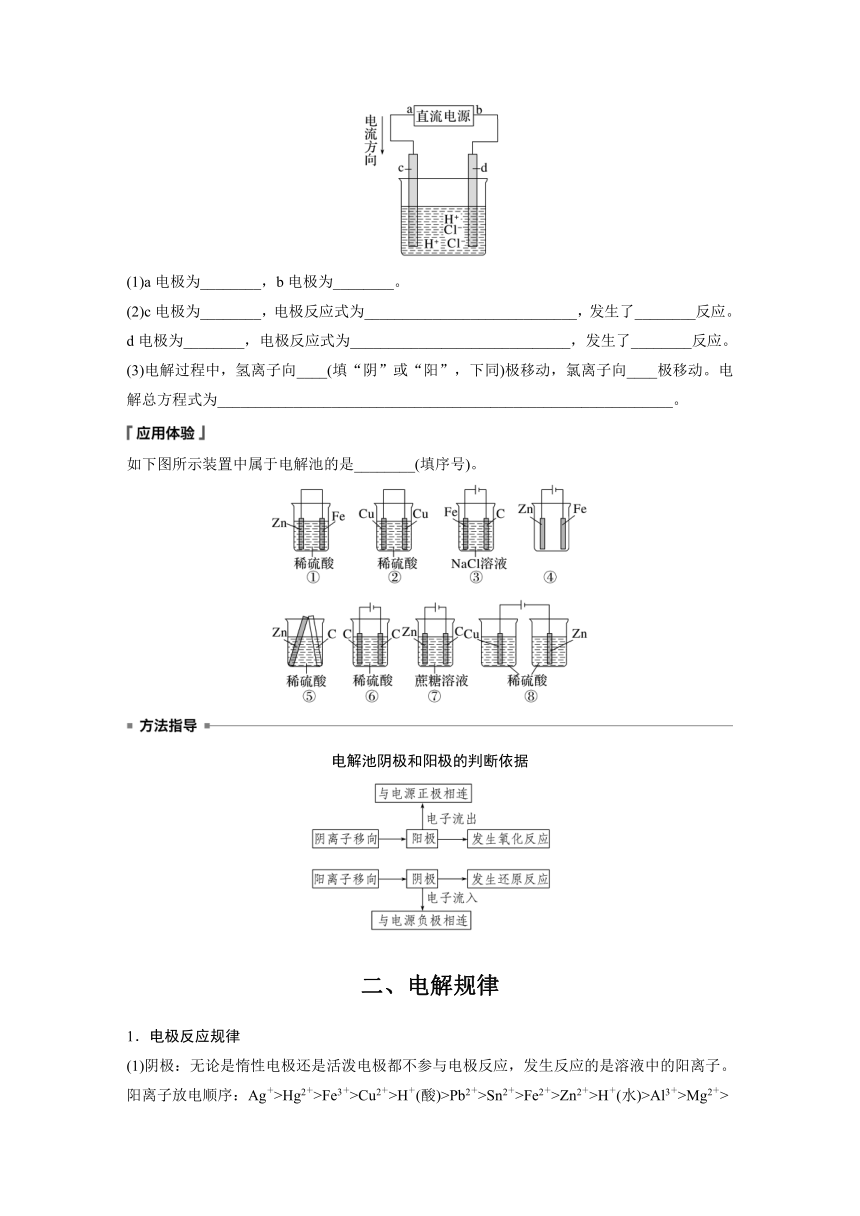
如图所示是电解稀盐酸的装置,其中c、d为石墨电极。试回答下列问题:
(1)a电极为________,b电极为________。
(2)c电极为________,电极反应式为____________________________,发生了________反应。
d电极为________,电极反应式为_____________________________,发生了________反应。
(3)电解过程中,氢离子向____(填“阴”或“阳”,下同)极移动,氯离子向____极移动。电解总方程式为____________________________________________________________。
如下图所示装置中属于电解池的是________(填序号)。
电解池阴极和阳极的判断依据
二、电解规律
1.电极反应规律
(1)阴极:无论是惰性电极还是活泼电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>
Na+>Ca2+>K+。
(2)阳极:溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中,其放电顺序:活泼金属阳极>S2->I->Br->Cl->OH->含氧酸根离子>F-。
特别提醒 ①活性电极一般指Pt、Au以外的金属电极。②电解的离子方程式中,若参与电极反应的H+或OH-是由水电离出来的,用H2O作为反应物。
2.电解后溶液的复原规律
用惰性电极电解下列酸、碱、盐溶液,请填写下表:
(1)电解H2O型
电解质 H2SO4 NaOH Na2SO4
阳极反应式 2H2O-4e-===O2↑+4H+ 2H2O-4e-=== O2↑+4H+
阴极反应式 4H2O+4e-===2H2↑+4OH-
pH变化
复原加入物质 加入
(2)电解电解质型
电解质 HCl CuCl2
阳极反应式
阴极反应式
pH变化
复原加入物质
(3)电解质和水都发生电解型
电解质 NaCl CuSO4
阳极反应式
阴极反应式
pH变化
复原加入物质
特别提醒 电解后溶液的复原,从溶液中放出的气体和生成的沉淀,按照原子个数比组成具体物质再加入溶液即可。遵循“少什么加什么,少多少加多少”的原则。
3.电解池中的守恒规律
(1)基本原理
根据电子转移守恒,同一电路中各电极转移的电子数相等。
(2)解题方法
①书写出各极的电极反应式(多种物质放电,按照放电顺序书写各个电极反应式)。
②同一电路中转移的电子数是相等的,利用电子守恒使各电极得失电子数均相等,在各极反应式中建立联系。
(1)用石墨作电极电解氯化钠和硫酸铜的混合液,最初一段时间阴极和阳极生成的物质分别是铜和氯气( )
(2)用石墨作电极电解熔融氯化钠的阴极反应式为Na++e-===Na( )
(3)用石墨作阴极、铜作阳极电解硫酸铜溶液的阳极反应式为2H2O-4e-===O2↑+4H+( )
(4)用石墨作电极电解硝酸银溶液的离子方程式为4Ag++2H2O4Ag+4H++O2↑( )
(5)铜作阳极电解盐酸的化学方程式为Cu+2HClCuCl2+H2↑( )
(6)电解任何物质,阳极失电子总数与阴极得电子总数相等( )
(7)用惰性电极电解盐酸、稀硫酸,H+放电,溶液的pH逐渐增大( )
为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、SO、Cl-
5种离子中两两组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________________。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________________。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________________。
1.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A.HCl、CuCl2、Ba(OH)2
B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2
D.NaBr、H2SO4、Ba(OH)2
2.用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
组号 X Y Z W
A C Fe NaCl H2O
B Pt Cu CuSO4 CuSO4溶液
C C C H2SO4 H2O
D Ag Fe AgNO3 AgNO3晶体
3.在标准状况下,用铂电极电解硫酸铜溶液,当阴极产生12.8 g铜时,阳极放出的气体是( )
A.1.12 L H2 B.1.12 L O2
C.2.24 L H2 D.2.24 L O2
第二节 电解池
第1课时 电解原理
[核心素养发展目标] 1.从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。2.建立电解过程的思维模型,理解电解的规律,判断电解的产物,书写电解的电极反应式和总反应式。
一、电解原理
1.实验探究:电解CuCl2溶液
(1)按如图所示装置完成实验,并填写下表。
实验现象 实验结论
电流表指针发生偏转 说明电解质溶液导电,形成闭合回路
与负极相连的b极上逐渐覆盖了一层红色物质 析出金属铜
与正极相连的a极上有刺激性气味的气体产生,能使湿润的淀粉碘化钾试纸变蓝 产生了氯气
(2)实验原理分析
①氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,通电前这些离子在溶液中作自由运动。
②通电时在电场的作用下,溶液中的离子作定向运动,即Cl-、OH-移向a极,Cu2+、H+移向b极。
③a极电极反应式是2Cl--2e-===Cl2↑,
b极电极反应式是Cu2++2e-===Cu,
总反应式是CuCl2Cu+Cl2↑。
④结论:电解质溶液的导电过程,就是电解质溶液的电解过程。
2.电解和电解池
(1)电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
(2)电解池(也称电解槽):在外接电源的作用下,将电能转化为化学能的装置。
(3)电解池的电极名称。
阴极:与直流电源的负极相连的电极,发生还原反应;
阳极:与直流电源的正极相连的电极,发生氧化反应。
(4)电解池的构成条件。
3.电解池的工作原理
接通电路后,电源、金属导线、阴极和阳极与电解质溶液形成闭合回路(如图所示)。
(1)电流方向:电源正极―→金属导线―→阳极―→电解质溶液―→阴极―→金属导线―→电源负极。
(2)电子、离子移动方向:在电解质溶液中,阳离子向阴极移动,阴离子向阳极移动;在外电路中,电子由阳极―→正极,负极―→阴极。
特别提醒 ①电解质溶液导电实际上是电解过程,发生氧化还原反应,是化学变化。②金属导电是因为在电场作用下,自由电子发生定向移动,是物理变化。
(1)电解池的两个电极必须是两个活动性不同的电极( )
(2)在电解池中与直流电源负极相连的电极是阴极( )
(3)在电解池中,电子从阳极流入电源正极( )
(4)电解质溶液的导电实验发生化学变化( )
(5)电解池的阳极发生还原反应( )
答案 (1)× (2)√ (3)√ (4)√ (5)×
如图所示是电解稀盐酸的装置,其中c、d为石墨电极。试回答下列问题:
(1)a电极为________,b电极为________。
(2)c电极为________,电极反应式为____________________________________,发生了________反应。
d电极为________,电极反应式为_______________________________,发生了________反应。
(3)电解过程中,氢离子向____(填“阴”或“阳”,下同)极移动,氯离子向____极移动。电解总方程式为____________________________________________________________。
答案 (1)正极 负极
(2)阳极 2Cl--2e-===Cl2↑ 氧化 阴极 2H++2e-===H2↑ 还原
(3)阴 阳 2HClH2↑+Cl2↑
如下图所示装置中属于电解池的是________(填序号)。
答案 ③⑥
解析 根据电解池的构成条件逐个判断。①②⑤无外接直流电源,不能构成电解池;④无电解质溶液或熔融电解质;⑦中蔗糖属于非电解质,不能构成电解池;⑧没有形成闭合回路,不能构成电解池。
电解池阴极和阳极的判断依据
二、电解规律
1.电极反应规律
(1)阴极:无论是惰性电极还是活泼电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>
Na+>Ca2+>K+。
(2)阳极:溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中,其放电顺序:活泼金属阳极>S2->I->Br->Cl->OH->含氧酸根离子>F-。
特别提醒 ①活性电极一般指Pt、Au以外的金属电极。②电解的离子方程式中,若参与电极反应的H+或OH-是由水电离出来的,用H2O作为反应物。
2.电解后溶液的复原规律
用惰性电极电解下列酸、碱、盐溶液,请填写下表:
(1)电解H2O型
电解质 H2SO4 NaOH Na2SO4
阳极反应式 2H2O-4e-===O2↑+4H+ 4OH--4e-=== O2↑+2H2O 2H2O-4e-=== O2↑+4H+
阴极反应式 4H++4e-===2H2↑ 4H2O+4e-===2H2↑+4OH-
pH变化 减小 增大 不变
复原加入物质 加入H2O
(2)电解电解质型
电解质 HCl CuCl2
阳极反应式 2Cl--2e-===Cl2↑
阴极反应式 2H++2e-===H2↑ Cu2++2e-===Cu
pH变化 增大
复原加入物质 HCl CuCl2
(3)电解质和水都发生电解型
电解质 NaCl CuSO4
阳极反应式 2Cl--2e-===Cl2↑ 2H2O-4e-===O2↑+4H+
阴极反应式 2H2O+2e-===H2↑+2OH- 2Cu2++4e-===2Cu
pH变化 增大 减小
复原加入物质 HCl CuO或CuCO3
特别提醒 电解后溶液的复原,从溶液中放出的气体和生成的沉淀,按照原子个数比组成具体物质再加入溶液即可。遵循“少什么加什么,少多少加多少”的原则。
3.电解池中的守恒规律
(1)基本原理
根据电子转移守恒,同一电路中各电极转移的电子数相等。
(2)解题方法
①书写出各极的电极反应式(多种物质放电,按照放电顺序书写各个电极反应式)。
②同一电路中转移的电子数是相等的,利用电子守恒使各电极得失电子数均相等,在各极反应式中建立联系。
(1)用石墨作电极电解氯化钠和硫酸铜的混合液,最初一段时间阴极和阳极生成的物质分别是铜和氯气( )
(2)用石墨作电极电解熔融氯化钠的阴极反应式为Na++e-===Na( )
(3)用石墨作阴极、铜作阳极电解硫酸铜溶液的阳极反应式为2H2O-4e-===O2↑+4H+( )
(4)用石墨作电极电解硝酸银溶液的离子方程式为4Ag++2H2O4Ag+4H++O2↑( )
(5)铜作阳极电解盐酸的化学方程式为Cu+2HClCuCl2+H2↑( )
(6)电解任何物质,阳极失电子总数与阴极得电子总数相等( )
(7)用惰性电极电解盐酸、稀硫酸,H+放电,溶液的pH逐渐增大( )
答案 (1)√ (2)√ (3)× (4)√ (5)√ (6)√ (7)×
为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、SO、Cl-5种离子中两两组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是___________________________________。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________。
答案 (1)HCl、CuCl2 HCl、CuCl2
(2)Na2SO4、H2SO4 H2O
(3)CuSO4、NaCl CuO或CuCO3、HCl
解析 (1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则阳离子只能为H+、Cu2+,阴离子只能是Cl-,其电解质分别是HCl、CuCl2。
(2)实质上是电解水,H+、OH-分别在两极上放电,其电解质是Na2SO4、H2SO4。
(3)若电解质是CuSO4,2CuSO4+2H2O2H2SO4+2Cu+O2↑,若恢复到原状态,可加入CuO,也可加入CuCO3;若电解质是NaCl,2NaCl+2H2O2NaOH+H2↑+Cl2↑,要恢复到原状态可通入HCl。
1.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A.HCl、CuCl2、Ba(OH)2
B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2
D.NaBr、H2SO4、Ba(OH)2
答案 C
解析 电解HCl、CuCl2溶液就是电解电解质本身,电解NaBr、CuSO4溶液时,电解质、水均被电解,分别属于放氢生碱型、放氧生酸型。
2.用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
组号 X Y Z W
A C Fe NaCl H2O
B Pt Cu CuSO4 CuSO4溶液
C C C H2SO4 H2O
D Ag Fe AgNO3 AgNO3晶体
答案 C
解析 复原溶液,A应通HCl,B应加CuO或CuCO3,C应加H2O,D不需加任何物质。
3.在标准状况下,用铂电极电解硫酸铜溶液,当阴极产生12.8 g铜时,阳极放出的气体是( )
A.1.12 L H2 B.1.12 L O2
C.2.24 L H2 D.2.24 L O2
答案 D
解析 溶液中有Cu2+、H+、SO、OH-四种离子,得电子能力:Cu2+>H+,失电子能力:OH->SO,阴极反应为2Cu2++4e-===2Cu,阳极反应为2H2O-4e-===O2↑+4H+,总反应为2CuSO4+2H2O2Cu+2H2SO4+O2↑。n(Cu)==0.2 mol,n(O2)=0.1 mol,在标准状况下其体积为2.24 L,D正确。
第1课时 电解原理
[核心素养发展目标] 1.从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。2.建立电解过程的思维模型,理解电解的规律,判断电解的产物,书写电解的电极反应式和总反应式。
一、电解原理
1.实验探究:电解CuCl2溶液
(1)按如图所示装置完成实验,并填写下表。
实验现象 实验结论
电流表指针发生偏转 说明电解质溶液导电,形成____________
与负极相连的b极上逐渐覆盖了一层____________
与正极相连的a极上有刺激性气味的气体产生,能使湿润的淀粉碘化钾试纸______
(2)实验原理分析
①氯化铜溶液中存在的离子有__________________________,通电前这些离子在溶液中作自由运动。
②通电时在电场的作用下,溶液中的离子作定向运动,即Cl-、OH-移向a极,Cu2+、H+移向b极。
③a极电极反应式是_______________________________________________________,
b极电极反应式是_________________________________________________________,
总反应式是CuCl2Cu+Cl2↑。
④结论:电解质溶液的导电过程,就是电解质溶液的________过程。
2.电解和电解池
(1)电解:使电流通过_____________________而在阳极、阴极引起____________反应的过程。
(2)电解池(也称电解槽):在外接电源的作用下,将________转化为________的装置。
(3)电解池的电极名称。
阴极:与直流电源的________相连的电极,发生________反应;
阳极:与直流电源的________相连的电极,发生________反应。
(4)电解池的构成条件。
3.电解池的工作原理
接通电路后,电源、金属导线、阴极和阳极与电解质溶液形成闭合回路(如图所示)。
(1)电流方向:电源正极―→金属导线―→阳极―→电解质溶液―→阴极―→金属导线―→电源负极。
(2)电子、离子移动方向:在电解质溶液中,阳离子向阴极移动,阴离子向阳极移动;在外电路中,电子由阳极―→正极,负极―→阴极。
特别提醒 ①电解质溶液导电实际上是电解过程,发生氧化还原反应,是化学变化。②金属导电是因为在电场作用下,自由电子发生定向移动,是物理变化。
(1)电解池的两个电极必须是两个活动性不同的电极( )
(2)在电解池中与直流电源负极相连的电极是阴极( )
(3)在电解池中,电子从阳极流入电源正极( )
(4)电解质溶液的导电实验发生化学变化( )
(5)电解池的阳极发生还原反应( )
如图所示是电解稀盐酸的装置,其中c、d为石墨电极。试回答下列问题:
(1)a电极为________,b电极为________。
(2)c电极为________,电极反应式为____________________________,发生了________反应。
d电极为________,电极反应式为_____________________________,发生了________反应。
(3)电解过程中,氢离子向____(填“阴”或“阳”,下同)极移动,氯离子向____极移动。电解总方程式为____________________________________________________________。
如下图所示装置中属于电解池的是________(填序号)。
电解池阴极和阳极的判断依据
二、电解规律
1.电极反应规律
(1)阴极:无论是惰性电极还是活泼电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>
Na+>Ca2+>K+。
(2)阳极:溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中,其放电顺序:活泼金属阳极>S2->I->Br->Cl->OH->含氧酸根离子>F-。
特别提醒 ①活性电极一般指Pt、Au以外的金属电极。②电解的离子方程式中,若参与电极反应的H+或OH-是由水电离出来的,用H2O作为反应物。
2.电解后溶液的复原规律
用惰性电极电解下列酸、碱、盐溶液,请填写下表:
(1)电解H2O型
电解质 H2SO4 NaOH Na2SO4
阳极反应式 2H2O-4e-===O2↑+4H+ 2H2O-4e-=== O2↑+4H+
阴极反应式 4H2O+4e-===2H2↑+4OH-
pH变化
复原加入物质 加入
(2)电解电解质型
电解质 HCl CuCl2
阳极反应式
阴极反应式
pH变化
复原加入物质
(3)电解质和水都发生电解型
电解质 NaCl CuSO4
阳极反应式
阴极反应式
pH变化
复原加入物质
特别提醒 电解后溶液的复原,从溶液中放出的气体和生成的沉淀,按照原子个数比组成具体物质再加入溶液即可。遵循“少什么加什么,少多少加多少”的原则。
3.电解池中的守恒规律
(1)基本原理
根据电子转移守恒,同一电路中各电极转移的电子数相等。
(2)解题方法
①书写出各极的电极反应式(多种物质放电,按照放电顺序书写各个电极反应式)。
②同一电路中转移的电子数是相等的,利用电子守恒使各电极得失电子数均相等,在各极反应式中建立联系。
(1)用石墨作电极电解氯化钠和硫酸铜的混合液,最初一段时间阴极和阳极生成的物质分别是铜和氯气( )
(2)用石墨作电极电解熔融氯化钠的阴极反应式为Na++e-===Na( )
(3)用石墨作阴极、铜作阳极电解硫酸铜溶液的阳极反应式为2H2O-4e-===O2↑+4H+( )
(4)用石墨作电极电解硝酸银溶液的离子方程式为4Ag++2H2O4Ag+4H++O2↑( )
(5)铜作阳极电解盐酸的化学方程式为Cu+2HClCuCl2+H2↑( )
(6)电解任何物质,阳极失电子总数与阴极得电子总数相等( )
(7)用惰性电极电解盐酸、稀硫酸,H+放电,溶液的pH逐渐增大( )
为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、SO、Cl-
5种离子中两两组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________________。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________________。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________________。
1.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A.HCl、CuCl2、Ba(OH)2
B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2
D.NaBr、H2SO4、Ba(OH)2
2.用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
组号 X Y Z W
A C Fe NaCl H2O
B Pt Cu CuSO4 CuSO4溶液
C C C H2SO4 H2O
D Ag Fe AgNO3 AgNO3晶体
3.在标准状况下,用铂电极电解硫酸铜溶液,当阴极产生12.8 g铜时,阳极放出的气体是( )
A.1.12 L H2 B.1.12 L O2
C.2.24 L H2 D.2.24 L O2
第二节 电解池
第1课时 电解原理
[核心素养发展目标] 1.从宏观和微观的角度理解电解池中电子的移动、阴阳离子的移动、阴阳两极上的反应及其变化、电流形成的过程和原理。2.建立电解过程的思维模型,理解电解的规律,判断电解的产物,书写电解的电极反应式和总反应式。
一、电解原理
1.实验探究:电解CuCl2溶液
(1)按如图所示装置完成实验,并填写下表。
实验现象 实验结论
电流表指针发生偏转 说明电解质溶液导电,形成闭合回路
与负极相连的b极上逐渐覆盖了一层红色物质 析出金属铜
与正极相连的a极上有刺激性气味的气体产生,能使湿润的淀粉碘化钾试纸变蓝 产生了氯气
(2)实验原理分析
①氯化铜溶液中存在的离子有Cu2+、Cl-、H+、OH-,通电前这些离子在溶液中作自由运动。
②通电时在电场的作用下,溶液中的离子作定向运动,即Cl-、OH-移向a极,Cu2+、H+移向b极。
③a极电极反应式是2Cl--2e-===Cl2↑,
b极电极反应式是Cu2++2e-===Cu,
总反应式是CuCl2Cu+Cl2↑。
④结论:电解质溶液的导电过程,就是电解质溶液的电解过程。
2.电解和电解池
(1)电解:使电流通过电解质溶液(或熔融电解质)而在阳极、阴极引起氧化还原反应的过程。
(2)电解池(也称电解槽):在外接电源的作用下,将电能转化为化学能的装置。
(3)电解池的电极名称。
阴极:与直流电源的负极相连的电极,发生还原反应;
阳极:与直流电源的正极相连的电极,发生氧化反应。
(4)电解池的构成条件。
3.电解池的工作原理
接通电路后,电源、金属导线、阴极和阳极与电解质溶液形成闭合回路(如图所示)。
(1)电流方向:电源正极―→金属导线―→阳极―→电解质溶液―→阴极―→金属导线―→电源负极。
(2)电子、离子移动方向:在电解质溶液中,阳离子向阴极移动,阴离子向阳极移动;在外电路中,电子由阳极―→正极,负极―→阴极。
特别提醒 ①电解质溶液导电实际上是电解过程,发生氧化还原反应,是化学变化。②金属导电是因为在电场作用下,自由电子发生定向移动,是物理变化。
(1)电解池的两个电极必须是两个活动性不同的电极( )
(2)在电解池中与直流电源负极相连的电极是阴极( )
(3)在电解池中,电子从阳极流入电源正极( )
(4)电解质溶液的导电实验发生化学变化( )
(5)电解池的阳极发生还原反应( )
答案 (1)× (2)√ (3)√ (4)√ (5)×
如图所示是电解稀盐酸的装置,其中c、d为石墨电极。试回答下列问题:
(1)a电极为________,b电极为________。
(2)c电极为________,电极反应式为____________________________________,发生了________反应。
d电极为________,电极反应式为_______________________________,发生了________反应。
(3)电解过程中,氢离子向____(填“阴”或“阳”,下同)极移动,氯离子向____极移动。电解总方程式为____________________________________________________________。
答案 (1)正极 负极
(2)阳极 2Cl--2e-===Cl2↑ 氧化 阴极 2H++2e-===H2↑ 还原
(3)阴 阳 2HClH2↑+Cl2↑
如下图所示装置中属于电解池的是________(填序号)。
答案 ③⑥
解析 根据电解池的构成条件逐个判断。①②⑤无外接直流电源,不能构成电解池;④无电解质溶液或熔融电解质;⑦中蔗糖属于非电解质,不能构成电解池;⑧没有形成闭合回路,不能构成电解池。
电解池阴极和阳极的判断依据
二、电解规律
1.电极反应规律
(1)阴极:无论是惰性电极还是活泼电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>
Na+>Ca2+>K+。
(2)阳极:溶液中还原性强的阴离子失去电子被氧化,或者电极材料本身失去电子被氧化而溶入溶液中,其放电顺序:活泼金属阳极>S2->I->Br->Cl->OH->含氧酸根离子>F-。
特别提醒 ①活性电极一般指Pt、Au以外的金属电极。②电解的离子方程式中,若参与电极反应的H+或OH-是由水电离出来的,用H2O作为反应物。
2.电解后溶液的复原规律
用惰性电极电解下列酸、碱、盐溶液,请填写下表:
(1)电解H2O型
电解质 H2SO4 NaOH Na2SO4
阳极反应式 2H2O-4e-===O2↑+4H+ 4OH--4e-=== O2↑+2H2O 2H2O-4e-=== O2↑+4H+
阴极反应式 4H++4e-===2H2↑ 4H2O+4e-===2H2↑+4OH-
pH变化 减小 增大 不变
复原加入物质 加入H2O
(2)电解电解质型
电解质 HCl CuCl2
阳极反应式 2Cl--2e-===Cl2↑
阴极反应式 2H++2e-===H2↑ Cu2++2e-===Cu
pH变化 增大
复原加入物质 HCl CuCl2
(3)电解质和水都发生电解型
电解质 NaCl CuSO4
阳极反应式 2Cl--2e-===Cl2↑ 2H2O-4e-===O2↑+4H+
阴极反应式 2H2O+2e-===H2↑+2OH- 2Cu2++4e-===2Cu
pH变化 增大 减小
复原加入物质 HCl CuO或CuCO3
特别提醒 电解后溶液的复原,从溶液中放出的气体和生成的沉淀,按照原子个数比组成具体物质再加入溶液即可。遵循“少什么加什么,少多少加多少”的原则。
3.电解池中的守恒规律
(1)基本原理
根据电子转移守恒,同一电路中各电极转移的电子数相等。
(2)解题方法
①书写出各极的电极反应式(多种物质放电,按照放电顺序书写各个电极反应式)。
②同一电路中转移的电子数是相等的,利用电子守恒使各电极得失电子数均相等,在各极反应式中建立联系。
(1)用石墨作电极电解氯化钠和硫酸铜的混合液,最初一段时间阴极和阳极生成的物质分别是铜和氯气( )
(2)用石墨作电极电解熔融氯化钠的阴极反应式为Na++e-===Na( )
(3)用石墨作阴极、铜作阳极电解硫酸铜溶液的阳极反应式为2H2O-4e-===O2↑+4H+( )
(4)用石墨作电极电解硝酸银溶液的离子方程式为4Ag++2H2O4Ag+4H++O2↑( )
(5)铜作阳极电解盐酸的化学方程式为Cu+2HClCuCl2+H2↑( )
(6)电解任何物质,阳极失电子总数与阴极得电子总数相等( )
(7)用惰性电极电解盐酸、稀硫酸,H+放电,溶液的pH逐渐增大( )
答案 (1)√ (2)√ (3)× (4)√ (5)√ (6)√ (7)×
为了加深对电解规律的理解,某同学做了以下探究,要求从H+、Cu2+、Na+、SO、Cl-5种离子中两两组成电解质,按下列要求进行电解:
(1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________。
(2)以碳棒为电极,电解过程中电解质质量不变,水量减少,则采用的电解质是____________。若要恢复到电解前的状态,应加入的物质是___________________________________。
(3)以碳棒为阳极,铁棒为阴极,电解过程中电解质和水量都减少,则电解质是____________。若要恢复到电解前的状态,应加入的物质是__________________________________。
答案 (1)HCl、CuCl2 HCl、CuCl2
(2)Na2SO4、H2SO4 H2O
(3)CuSO4、NaCl CuO或CuCO3、HCl
解析 (1)以碳棒为电极,电解过程中电解质质量减少,水量不变,则阳离子只能为H+、Cu2+,阴离子只能是Cl-,其电解质分别是HCl、CuCl2。
(2)实质上是电解水,H+、OH-分别在两极上放电,其电解质是Na2SO4、H2SO4。
(3)若电解质是CuSO4,2CuSO4+2H2O2H2SO4+2Cu+O2↑,若恢复到原状态,可加入CuO,也可加入CuCO3;若电解质是NaCl,2NaCl+2H2O2NaOH+H2↑+Cl2↑,要恢复到原状态可通入HCl。
1.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A.HCl、CuCl2、Ba(OH)2
B.NaOH、CuSO4、H2SO4
C.NaOH、H2SO4、Ba(OH)2
D.NaBr、H2SO4、Ba(OH)2
答案 C
解析 电解HCl、CuCl2溶液就是电解电解质本身,电解NaBr、CuSO4溶液时,电解质、水均被电解,分别属于放氢生碱型、放氧生酸型。
2.用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是( )
组号 X Y Z W
A C Fe NaCl H2O
B Pt Cu CuSO4 CuSO4溶液
C C C H2SO4 H2O
D Ag Fe AgNO3 AgNO3晶体
答案 C
解析 复原溶液,A应通HCl,B应加CuO或CuCO3,C应加H2O,D不需加任何物质。
3.在标准状况下,用铂电极电解硫酸铜溶液,当阴极产生12.8 g铜时,阳极放出的气体是( )
A.1.12 L H2 B.1.12 L O2
C.2.24 L H2 D.2.24 L O2
答案 D
解析 溶液中有Cu2+、H+、SO、OH-四种离子,得电子能力:Cu2+>H+,失电子能力:OH->SO,阴极反应为2Cu2++4e-===2Cu,阳极反应为2H2O-4e-===O2↑+4H+,总反应为2CuSO4+2H2O2Cu+2H2SO4+O2↑。n(Cu)==0.2 mol,n(O2)=0.1 mol,在标准状况下其体积为2.24 L,D正确。
