第四章 第二节 第4课时 电化学原理的综合应用 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第四章 第二节 第4课时 电化学原理的综合应用 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 518.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-30 17:17:50 | ||
图片预览



文档简介
第4课时 电化学原理的综合应用
[核心素养发展目标] 1.利用电化学原理制备物质、处理污水和有害物质。2.能够书写新情景下的电极反应式。
一、电解原理在物质制备中的应用
1.电解原理常用于物质的制备,具有反应条件温和、反应试剂纯净和生产效率高等优点,电解原理能使许多不能自发的反应得以实现。工业上常用多室电解池制备物质,多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到浓缩、净化、提纯及电化学合成的目的。
2.多室电解池的分析思路
1.一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
A.a为直流电源的正极
B.阴极反应式为2H++2e-===H2↑
C.工作时,乙池中溶液的pH不变
D.若有1 mol离子通过A膜,理论上阳极生成0.25 mol气体
2.NaClO2(亚氯酸钠)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是( )
A.若直流电源为铅酸蓄电池,则b极为Pb
B.阳极反应式为ClO2+e-===ClO
C.交换膜左侧NaOH的物质的量不变,气体X为Cl2
D.制备18.1 g NaClO2时理论上有0.2 mol Na+由交换膜左侧向右侧迁移
3.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
(1)写出阳极的电极反应式:________________________________________________。
(2)分析产品室可得到H3PO2的原因:_______________________________________
________________________________________________________________________。
(3)早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________
________________________________________________________________________。
二、电化学原理在环境保护中的应用
利用电化学原理把污染物去除或把有毒物质变为无毒或低毒物质,具有易于控制、无污染或少污染、高度灵活性和经济性等优点。
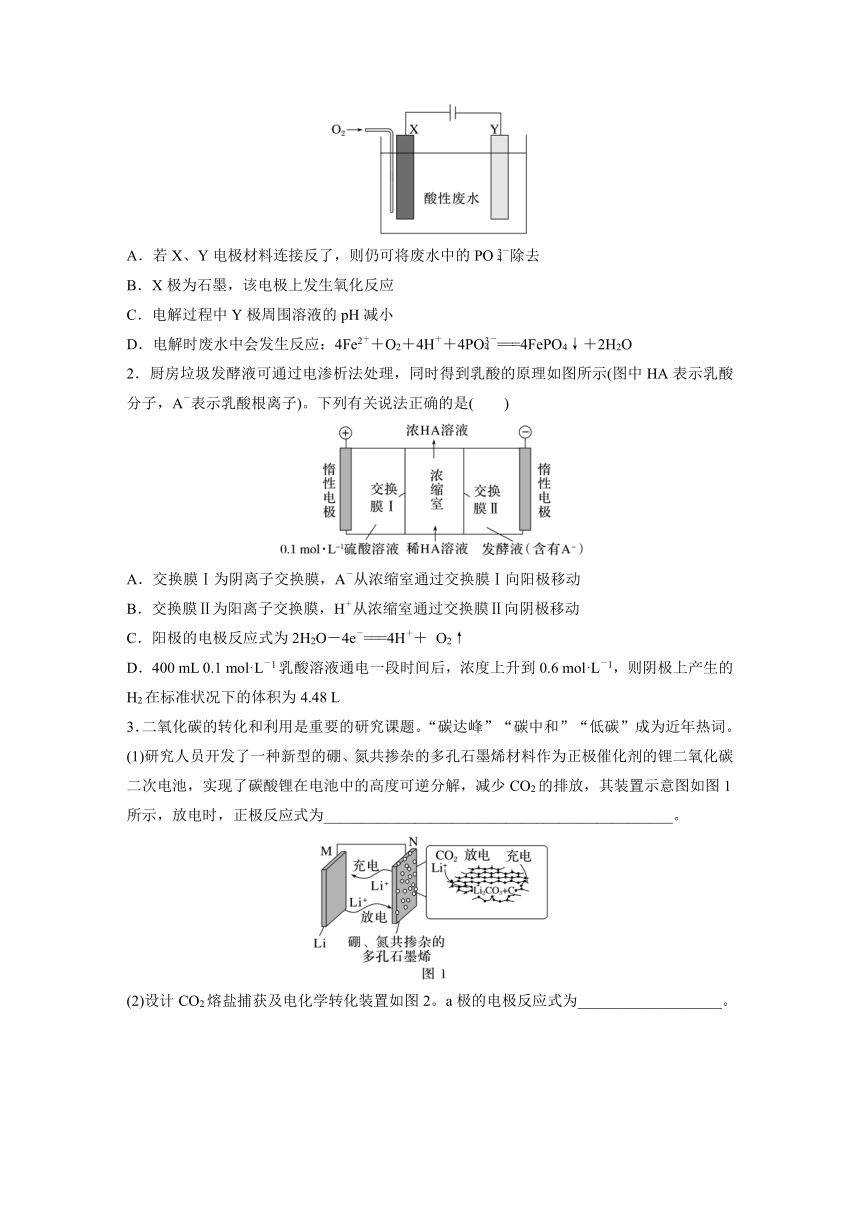
1.用铁和石墨作电极电解酸性废水,可将废水中的PO以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是( )
A.若X、Y电极材料连接反了,则仍可将废水中的PO除去
B.X极为石墨,该电极上发生氧化反应
C.电解过程中Y极周围溶液的pH减小
D.电解时废水中会发生反应:4Fe2++O2+4H++4PO===4FePO4↓+2H2O
2.厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。下列有关说法正确的是( )
A.交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过交换膜Ⅰ向阳极移动
B.交换膜Ⅱ为阳离子交换膜,H+从浓缩室通过交换膜Ⅱ向阴极移动
C.阳极的电极反应式为2H2O-4e-===4H++ O2↑
D.400 mL 0.1 mol·L-1乳酸溶液通电一段时间后,浓度上升到0.6 mol·L-1,则阴极上产生的H2在标准状况下的体积为4.48 L
3.二氧化碳的转化和利用是重要的研究课题。“碳达峰”“碳中和”“低碳”成为近年热词。
(1)研究人员开发了一种新型的硼、氮共掺杂的多孔石墨烯材料作为正极催化剂的锂二氧化碳二次电池,实现了碳酸锂在电池中的高度可逆分解,减少CO2的排放,其装置示意图如图1所示,放电时,正极反应式为______________________________________________。
(2)设计CO2熔盐捕获及电化学转化装置如图2。a极的电极反应式为___________________。
第4课时 电化学原理的综合应用
[核心素养发展目标] 1.利用电化学原理制备物质、处理污水和有害物质。2.能够书写新情景下的电极反应式。
一、电解原理在物质制备中的应用
1.电解原理常用于物质的制备,具有反应条件温和、反应试剂纯净和生产效率高等优点,电解原理能使许多不能自发的反应得以实现。工业上常用多室电解池制备物质,多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到浓缩、净化、提纯及电化学合成的目的。
2.多室电解池的分析思路
1.一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
A.a为直流电源的正极
B.阴极反应式为2H++2e-===H2↑
C.工作时,乙池中溶液的pH不变
D.若有1 mol离子通过A膜,理论上阳极生成0.25 mol气体
答案 D
解析 A项,电解法制备铬,则Cr电极应该是阴极,即a为直流电源的负极,错误;B项,阴极反应式为Cr3++3e-===Cr,错误;C项,工作时,甲池中硫酸根离子移向乙池,丙池中氢离子移向乙池,乙池中硫酸浓度增大,溶液的pH减小,错误;D项,若有1 mol离子通过A膜,即丙池产生1 mol氢离子,则理论上阳极生成0.25 mol氧气,正确。
2.NaClO2(亚氯酸钠)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是( )
A.若直流电源为铅酸蓄电池,则b极为Pb
B.阳极反应式为ClO2+e-===ClO
C.交换膜左侧NaOH的物质的量不变,气体X为Cl2
D.制备18.1 g NaClO2时理论上有0.2 mol Na+由交换膜左侧向右侧迁移
答案 C
解析 二氧化氯转化为NaClO2(亚氯酸钠)的过程发生了还原反应,应该发生在阴极,所以a是负极,b是正极,若直流电源为铅酸蓄电池,则b极为正极,应该是PbO2,故A错误;由总反应式2ClO2+2NaCl===2NaClO2+Cl2知,交换膜左边NaOH的物质的量不变,在阳极上氯离子失电子,发生氧化反应,产生氯气,气体X为Cl2,故B错误、C正确;Na+由交换膜右侧向左侧迁移,故D错误。
3.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
(1)写出阳极的电极反应式:________________________________________________。
(2)分析产品室可得到H3PO2的原因:_______________________________________。
(3)早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
答案 (1)2H2O-4e-===O2↑+4H+
(2)阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2
(3)PO H2PO或H3PO2被氧化
二、电化学原理在环境保护中的应用
利用电化学原理把污染物去除或把有毒物质变为无毒或低毒物质,具有易于控制、无污染或少污染、高度灵活性和经济性等优点。
1.用铁和石墨作电极电解酸性废水,可将废水中的PO以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是( )
A.若X、Y电极材料连接反了,则仍可将废水中的PO除去
B.X极为石墨,该电极上发生氧化反应
C.电解过程中Y极周围溶液的pH减小
D.电解时废水中会发生反应:4Fe2++O2+4H++4PO===4FePO4↓+2H2O
答案 D
解析 根据题意分析可知,X电极材料为铁,Y电极材料为石墨。若X、Y电极材料连接反了,铁就不能失电子变为离子,也就不能生成FePO4,A错误;Y极为石墨,该电极上发生还原反应,B错误;电解过程中Y极发生反应:2H++2e-===H2↑,氢离子浓度减小,溶液的pH增大,C错误;铁在阳极失电子变为Fe2+,通入的氧气把Fe2+氧化为Fe3+,Fe3+与PO反应生成FePO4,D正确。
2.厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。下列有关说法正确的是( )
A.交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过交换膜Ⅰ向阳极移动
B.交换膜Ⅱ为阳离子交换膜,H+从浓缩室通过交换膜Ⅱ向阴极移动
C.阳极的电极反应式为2H2O-4e-===4H++O2↑
D.400 mL 0.1 mol·L-1乳酸溶液通电一段时间后,浓度上升到0.6 mol·L-1,则阴极上产生的H2在标准状况下的体积为4.48 L
答案 C
解析 阳极电极反应式为2H2O-4e-===4H++O2↑,生成的H+通过交换膜Ⅰ进入浓缩室,所以交换膜Ⅰ为阳离子交换膜,A-从阴极通过交换膜Ⅱ向浓缩室移动,所以Ⅱ为阴离子交换膜,A、B错误,C正确;生成的乳酸物质的量为0.4 L×(0.6-0.1)mol·L-1=0.2 mol,转移的n(H+)等于生成的n(HA)为0.2 mol,同时转移电子物质的量为0.2 mol,根据2H2O+2e-===
2OH-+H2↑知,生成氢气的物质的量为0.1 mol,在标准状况下的体积是2.24 L,D错误。
3.二氧化碳的转化和利用是重要的研究课题。“碳达峰”“碳中和”“低碳”成为近年热词。
(1)研究人员开发了一种新型的硼、氮共掺杂的多孔石墨烯材料作为正极催化剂的锂二氧化碳二次电池,实现了碳酸锂在电池中的高度可逆分解,减少CO2的排放,其装置示意图如图1所示,放电时,正极反应式为______________________。
(2)设计CO2熔盐捕获及电化学转化装置如图2。a极的电极反应式为____________________。
答案 (1)3CO2+4e-+4Li+===2Li2CO3+C
(2)2C2O-4e-===4CO2↑+O2↑
[核心素养发展目标] 1.利用电化学原理制备物质、处理污水和有害物质。2.能够书写新情景下的电极反应式。
一、电解原理在物质制备中的应用
1.电解原理常用于物质的制备,具有反应条件温和、反应试剂纯净和生产效率高等优点,电解原理能使许多不能自发的反应得以实现。工业上常用多室电解池制备物质,多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到浓缩、净化、提纯及电化学合成的目的。
2.多室电解池的分析思路
1.一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
A.a为直流电源的正极
B.阴极反应式为2H++2e-===H2↑
C.工作时,乙池中溶液的pH不变
D.若有1 mol离子通过A膜,理论上阳极生成0.25 mol气体
2.NaClO2(亚氯酸钠)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是( )
A.若直流电源为铅酸蓄电池,则b极为Pb
B.阳极反应式为ClO2+e-===ClO
C.交换膜左侧NaOH的物质的量不变,气体X为Cl2
D.制备18.1 g NaClO2时理论上有0.2 mol Na+由交换膜左侧向右侧迁移
3.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
(1)写出阳极的电极反应式:________________________________________________。
(2)分析产品室可得到H3PO2的原因:_______________________________________
________________________________________________________________________。
(3)早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________
________________________________________________________________________。
二、电化学原理在环境保护中的应用
利用电化学原理把污染物去除或把有毒物质变为无毒或低毒物质,具有易于控制、无污染或少污染、高度灵活性和经济性等优点。
1.用铁和石墨作电极电解酸性废水,可将废水中的PO以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是( )
A.若X、Y电极材料连接反了,则仍可将废水中的PO除去
B.X极为石墨,该电极上发生氧化反应
C.电解过程中Y极周围溶液的pH减小
D.电解时废水中会发生反应:4Fe2++O2+4H++4PO===4FePO4↓+2H2O
2.厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。下列有关说法正确的是( )
A.交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过交换膜Ⅰ向阳极移动
B.交换膜Ⅱ为阳离子交换膜,H+从浓缩室通过交换膜Ⅱ向阴极移动
C.阳极的电极反应式为2H2O-4e-===4H++ O2↑
D.400 mL 0.1 mol·L-1乳酸溶液通电一段时间后,浓度上升到0.6 mol·L-1,则阴极上产生的H2在标准状况下的体积为4.48 L
3.二氧化碳的转化和利用是重要的研究课题。“碳达峰”“碳中和”“低碳”成为近年热词。
(1)研究人员开发了一种新型的硼、氮共掺杂的多孔石墨烯材料作为正极催化剂的锂二氧化碳二次电池,实现了碳酸锂在电池中的高度可逆分解,减少CO2的排放,其装置示意图如图1所示,放电时,正极反应式为______________________________________________。
(2)设计CO2熔盐捕获及电化学转化装置如图2。a极的电极反应式为___________________。
第4课时 电化学原理的综合应用
[核心素养发展目标] 1.利用电化学原理制备物质、处理污水和有害物质。2.能够书写新情景下的电极反应式。
一、电解原理在物质制备中的应用
1.电解原理常用于物质的制备,具有反应条件温和、反应试剂纯净和生产效率高等优点,电解原理能使许多不能自发的反应得以实现。工业上常用多室电解池制备物质,多室电解池是利用离子交换膜的选择透过性,即允许带某种电荷的离子通过而限制带相反电荷的离子通过,将电解池分为两室、三室、多室等,以达到浓缩、净化、提纯及电化学合成的目的。
2.多室电解池的分析思路
1.一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
A.a为直流电源的正极
B.阴极反应式为2H++2e-===H2↑
C.工作时,乙池中溶液的pH不变
D.若有1 mol离子通过A膜,理论上阳极生成0.25 mol气体
答案 D
解析 A项,电解法制备铬,则Cr电极应该是阴极,即a为直流电源的负极,错误;B项,阴极反应式为Cr3++3e-===Cr,错误;C项,工作时,甲池中硫酸根离子移向乙池,丙池中氢离子移向乙池,乙池中硫酸浓度增大,溶液的pH减小,错误;D项,若有1 mol离子通过A膜,即丙池产生1 mol氢离子,则理论上阳极生成0.25 mol氧气,正确。
2.NaClO2(亚氯酸钠)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是( )
A.若直流电源为铅酸蓄电池,则b极为Pb
B.阳极反应式为ClO2+e-===ClO
C.交换膜左侧NaOH的物质的量不变,气体X为Cl2
D.制备18.1 g NaClO2时理论上有0.2 mol Na+由交换膜左侧向右侧迁移
答案 C
解析 二氧化氯转化为NaClO2(亚氯酸钠)的过程发生了还原反应,应该发生在阴极,所以a是负极,b是正极,若直流电源为铅酸蓄电池,则b极为正极,应该是PbO2,故A错误;由总反应式2ClO2+2NaCl===2NaClO2+Cl2知,交换膜左边NaOH的物质的量不变,在阳极上氯离子失电子,发生氧化反应,产生氯气,气体X为Cl2,故B错误、C正确;Na+由交换膜右侧向左侧迁移,故D错误。
3.H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
(1)写出阳极的电极反应式:________________________________________________。
(2)分析产品室可得到H3PO2的原因:_______________________________________。
(3)早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________________________________。
答案 (1)2H2O-4e-===O2↑+4H+
(2)阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO穿过阴膜扩散至产品室,二者反应生成H3PO2
(3)PO H2PO或H3PO2被氧化
二、电化学原理在环境保护中的应用
利用电化学原理把污染物去除或把有毒物质变为无毒或低毒物质,具有易于控制、无污染或少污染、高度灵活性和经济性等优点。
1.用铁和石墨作电极电解酸性废水,可将废水中的PO以FePO4(不溶于水)的形式除去,其装置如图所示。下列说法正确的是( )
A.若X、Y电极材料连接反了,则仍可将废水中的PO除去
B.X极为石墨,该电极上发生氧化反应
C.电解过程中Y极周围溶液的pH减小
D.电解时废水中会发生反应:4Fe2++O2+4H++4PO===4FePO4↓+2H2O
答案 D
解析 根据题意分析可知,X电极材料为铁,Y电极材料为石墨。若X、Y电极材料连接反了,铁就不能失电子变为离子,也就不能生成FePO4,A错误;Y极为石墨,该电极上发生还原反应,B错误;电解过程中Y极发生反应:2H++2e-===H2↑,氢离子浓度减小,溶液的pH增大,C错误;铁在阳极失电子变为Fe2+,通入的氧气把Fe2+氧化为Fe3+,Fe3+与PO反应生成FePO4,D正确。
2.厨房垃圾发酵液可通过电渗析法处理,同时得到乳酸的原理如图所示(图中HA表示乳酸分子,A-表示乳酸根离子)。下列有关说法正确的是( )
A.交换膜Ⅰ为阴离子交换膜,A-从浓缩室通过交换膜Ⅰ向阳极移动
B.交换膜Ⅱ为阳离子交换膜,H+从浓缩室通过交换膜Ⅱ向阴极移动
C.阳极的电极反应式为2H2O-4e-===4H++O2↑
D.400 mL 0.1 mol·L-1乳酸溶液通电一段时间后,浓度上升到0.6 mol·L-1,则阴极上产生的H2在标准状况下的体积为4.48 L
答案 C
解析 阳极电极反应式为2H2O-4e-===4H++O2↑,生成的H+通过交换膜Ⅰ进入浓缩室,所以交换膜Ⅰ为阳离子交换膜,A-从阴极通过交换膜Ⅱ向浓缩室移动,所以Ⅱ为阴离子交换膜,A、B错误,C正确;生成的乳酸物质的量为0.4 L×(0.6-0.1)mol·L-1=0.2 mol,转移的n(H+)等于生成的n(HA)为0.2 mol,同时转移电子物质的量为0.2 mol,根据2H2O+2e-===
2OH-+H2↑知,生成氢气的物质的量为0.1 mol,在标准状况下的体积是2.24 L,D错误。
3.二氧化碳的转化和利用是重要的研究课题。“碳达峰”“碳中和”“低碳”成为近年热词。
(1)研究人员开发了一种新型的硼、氮共掺杂的多孔石墨烯材料作为正极催化剂的锂二氧化碳二次电池,实现了碳酸锂在电池中的高度可逆分解,减少CO2的排放,其装置示意图如图1所示,放电时,正极反应式为______________________。
(2)设计CO2熔盐捕获及电化学转化装置如图2。a极的电极反应式为____________________。
答案 (1)3CO2+4e-+4Li+===2Li2CO3+C
(2)2C2O-4e-===4CO2↑+O2↑
