第四章 第一节 第3课时 新型化学电源 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第四章 第一节 第3课时 新型化学电源 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 443.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-30 17:24:00 | ||
图片预览


文档简介
第3课时 新型化学电源
[核心素养发展目标]
1.建立原电池工作的思维模型,能解决新型化学电源在新情境下的放电问题。
2.感悟研制新型化学电源的重要性以及可能会引起的环境问题,形成较为客观且正确的能源观,提高开发洁净清洁燃料的意识。
1.常见考查方向
①电极的判断,②电子或电流的流向,③溶液中离子的移向,④电极的反应类型,⑤pH的变化,⑥电子的转移数目,⑦电极反应式的书写。
2.新型电池中正、负极的判断方法
特别提醒 判断一个原电池中的正、负极,最根本的方法是失电子(发生氧化反应)的一极是负极,得电子(发生还原反应)的一极是正极。如果给出一个化学方程式判断正、负极,可以直接根据化合价的升降来判断,化合价升高、发生氧化反应的一极为负极,化合价降低、发生还原反应的一极为正极。
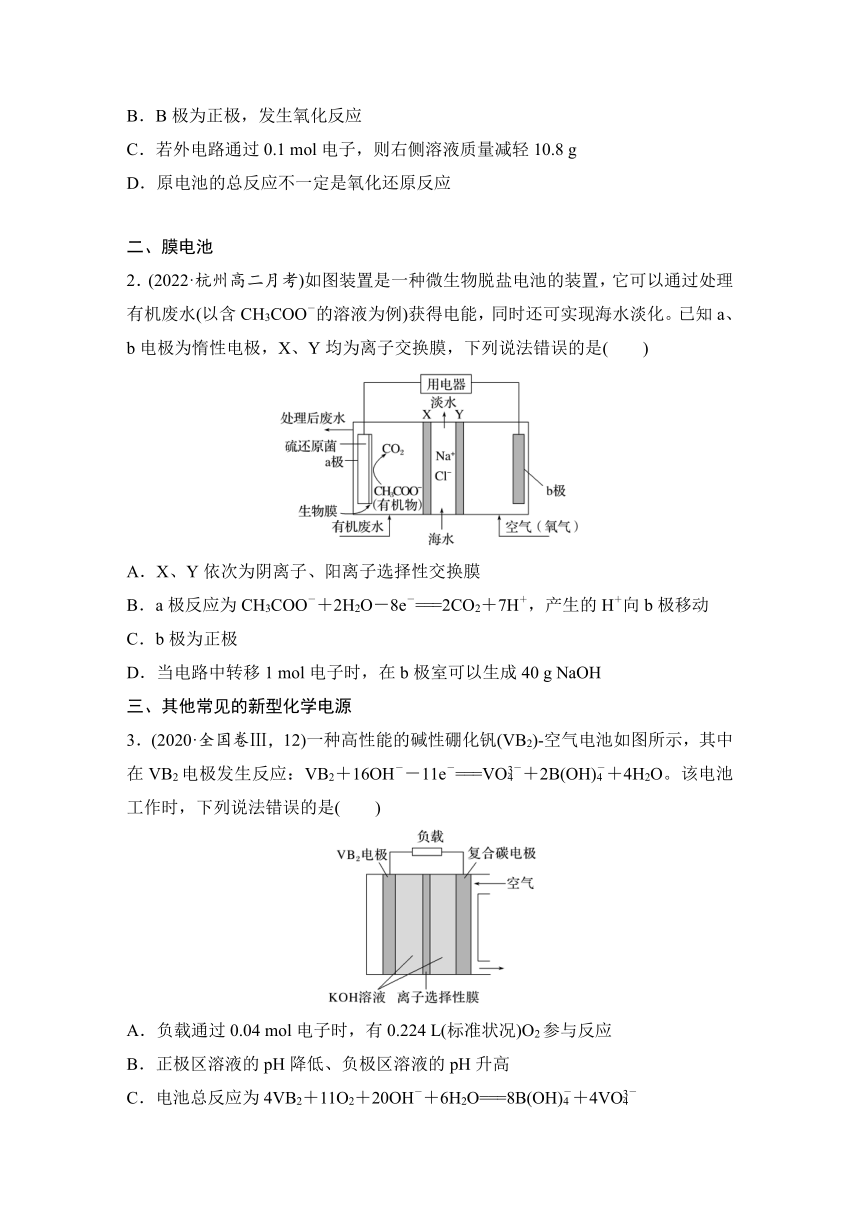
一、浓差电池
1.(2022·广州高二期末)溶质由高浓度向低浓度扩散而引发的一类电池称为浓差电池。如图是由Ag电极和硝酸银溶液组成的电池(c1A.此处应该用阳离子交换膜
B.B极为正极,发生氧化反应
C.若外电路通过0.1 mol电子,则右侧溶液质量减轻10.8 g
D.原电池的总反应不一定是氧化还原反应
二、膜电池
2.(2022·杭州高二月考)如图装置是一种微生物脱盐电池的装置,它可以通过处理有机废水(以含CH3COO-的溶液为例)获得电能,同时还可实现海水淡化。已知a、b电极为惰性电极,X、Y均为离子交换膜,下列说法错误的是( )
A.X、Y依次为阴离子、阳离子选择性交换膜
B.a极反应为CH3COO-+2H2O-8e-===2CO2+7H+,产生的H+向b极移动
C.b极为正极
D.当电路中转移1 mol电子时,在b极室可以生成40 g NaOH
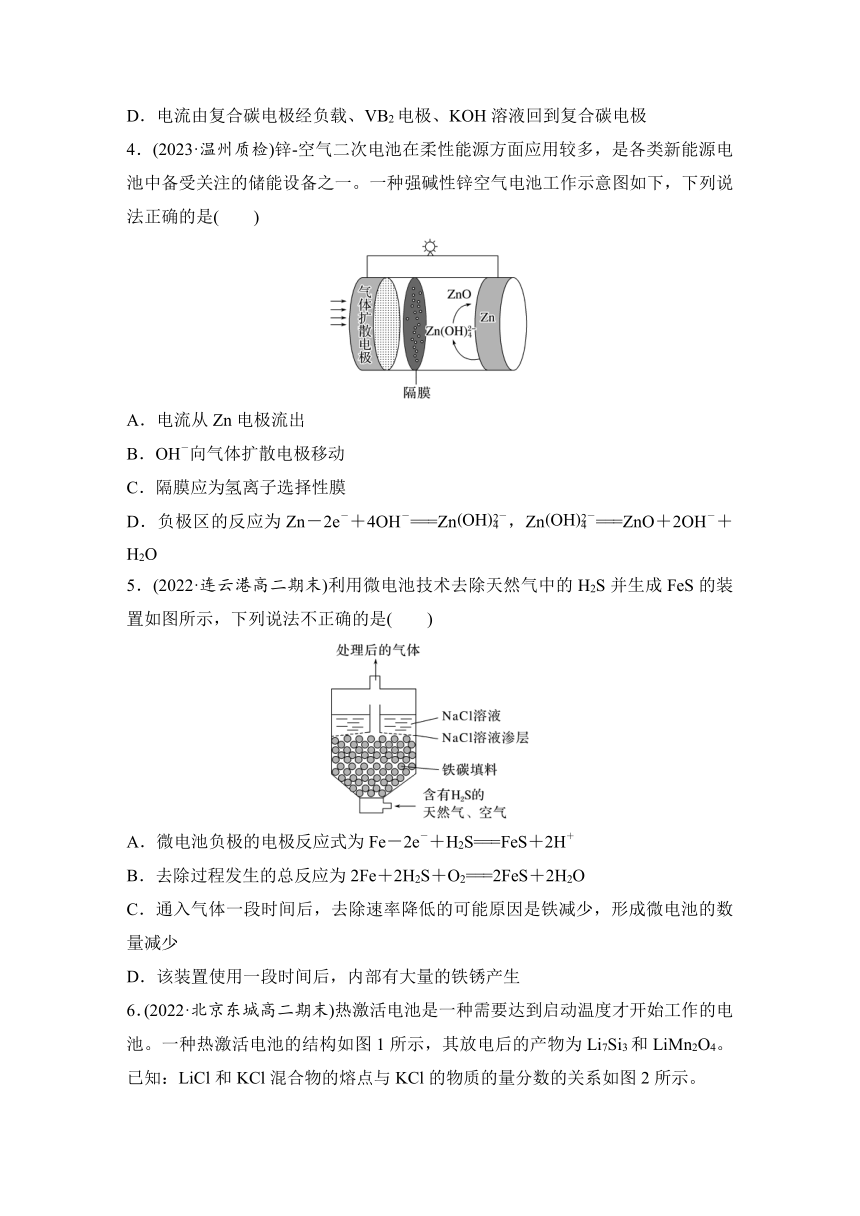
三、其他常见的新型化学电源
3.(2020·全国卷Ⅲ,12)一种高性能的碱性硼化钒(VB2) 空气电池如图所示,其中在VB2电极发生反应:VB2+16OH--11e-===VO+2B(OH)+4H2O。该电池工作时,下列说法错误的是( )
A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为4VB2+11O2+20OH-+6H2O===8B(OH)+4VO
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
4.(2023·温州质检)锌 空气二次电池在柔性能源方面应用较多,是各类新能源电池中备受关注的储能设备之一。一种强碱性锌空气电池工作示意图如下,下列说法正确的是( )
A.电流从Zn电极流出
B.OH-向气体扩散电极移动
C.隔膜应为氢离子选择性膜
D.负极区的反应为Zn-2e-+4OH-===Zn,Zn===ZnO+2OH-+H2O
5.(2022·连云港高二期末)利用微电池技术去除天然气中的H2S并生成FeS的装置如图所示,下列说法不正确的是( )
A.微电池负极的电极反应式为Fe-2e-+H2S===FeS+2H+
B.去除过程发生的总反应为2Fe+2H2S+O2===2FeS+2H2O
C.通入气体一段时间后,去除速率降低的可能原因是铁减少,形成微电池的数量减少
D.该装置使用一段时间后,内部有大量的铁锈产生
6.(2022·北京东城高二期末)热激活电池是一种需要达到启动温度才开始工作的电池。一种热激活电池的结构如图1所示,其放电后的产物为Li7Si3和LiMn2O4。已知:LiCl和KCl混合物的熔点与KCl的物质的量分数的关系如图2所示。
下列说法不正确的是( )
A.放电时,Li+向b极区移动
B.放电时,a极的电极反应是3Li13Si4-11e-===4Li7Si3+11Li+
C.该电池中火药燃烧产生的热能转化为电能
D.调节混合物中KCl的物质的量分数可以改变电池的启动温度
第3课时 新型化学电源
[核心素养发展目标] 1.建立原电池工作的思维模型,能解决新型化学电源在新情境下的放电问题。2.感悟研制新型化学电源的重要性以及可能会引起的环境问题,形成较为客观且正确的能源观,提高开发洁净清洁燃料的意识。
1.常见考查方向
①电极的判断,②电子或电流的流向,③溶液中离子的移向,④电极的反应类型,⑤pH的变化,⑥电子的转移数目,⑦电极反应式的书写。
2.新型电池中正、负极的判断方法
特别提醒 判断一个原电池中的正、负极,最根本的方法是失电子(发生氧化反应)的一极是负极,得电子(发生还原反应)的一极是正极。如果给出一个化学方程式判断正、负极,可以直接根据化合价的升降来判断,化合价升高、发生氧化反应的一极为负极,化合价降低、发生还原反应的一极为正极。
一、浓差电池
1.(2022·广州高二期末)溶质由高浓度向低浓度扩散而引发的一类电池称为浓差电池。如图是由Ag电极和硝酸银溶液组成的电池(c1A.此处应该用阳离子交换膜
B.B极为正极,发生氧化反应
C.若外电路通过0.1 mol电子,则右侧溶液质量减轻10.8 g
D.原电池的总反应不一定是氧化还原反应
答案 D
解析 由题意知,A电极质量不断减轻,故发生反应:Ag-e-===Ag+,则A极为负极,B极为正极,负极区Ag+浓度增大,正极区Ag+得电子生成Ag,电极反应为Ag++e-===Ag,正极区Ag+浓度减小,浓差电池中溶质由高浓度向低浓度扩散,故正极区NO经过离子交换膜移向负极,此处离子交换膜为阴离子交换膜,A、B错误;正极发生反应:Ag++e-===Ag,当转移0.1 mol电子时,溶液中减少0.1 mol Ag+,同时正极有0.1 mol NO移向负极区,故右侧溶液减少质量为0.1 mol×108 g·mol-1+0.1 mol×62 g·mol-1=17 g,C错误;负极的电极反应式为Ag-e-===Ag+,正极的电极反应式为Ag++e-===Ag,总反应属于非氧化还原反应,D正确。
二、膜电池
2.(2022·杭州高二月考)如图装置是一种微生物脱盐电池的装置,它可以通过处理有机废水(以含CH3COO-的溶液为例)获得电能,同时还可实现海水淡化。已知a、b电极为惰性电极,X、Y均为离子交换膜,下列说法错误的是( )
A.X、Y依次为阴离子、阳离子选择性交换膜
B.a极反应为CH3COO-+2H2O-8e-===2CO2+7H+,产生的H+向b极移动
C.b极为正极
D.当电路中转移1 mol电子时,在b极室可以生成40 g NaOH
答案 B
解析 根据图示可知,在a极上CH3COO-失去电子被氧化生成CO2和H+,碳元素化合价升高,被氧化,所以a极为该原电池的负极,则b极为正极。为了实现海水的淡化,海水中的氯离子需要移向负极,即a极,则隔膜X为阴离子交换膜,钠离子需要移向正极,即b极,则隔膜Y为阳离子交换膜,A正确;a极为负极,C失去电子被氧化生成CO2,同时产生H+,则结合电荷守恒可得电极反应式为CH3COO-+2H2O-8e-===2CO2+7H+,由于隔膜X是阴离子交换膜,所以阻碍生成的H+向正极移动,B错误;当电路中转移1 mol电子时,会有1 mol Na+进入b极室形成1 mol NaOH,其质量是40 g,D正确。
三、其他常见的新型化学电源
3.(2020·全国卷Ⅲ,12)一种高性能的碱性硼化钒(VB2)-空气电池如图所示,其中在VB2电极发生反应:VB2+16OH--11e-===VO+2B(OH)+4H2O。该电池工作时,下列说法错误的是( )
A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为4VB2+11O2+20OH-+6H2O===8B(OH)+4VO
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
答案 B
解析 根据VB2电极发生的反应:VB2+16OH--11e-===VO+2B(OH)+4H2O,判断得出VB2电极为负极,复合碳电极为正极,电极反应式为O2+4e-+2H2O===4OH-,所以电池总反应为4VB2+11O2+20OH-+6H2O===8B(OH)+4VO,C正确;负载通过0.04 mol电子时,有0.01 mol氧气参与反应,即标准状况下有0.224 L氧气参与反应,A正确;负极区消耗OH-,溶液的pH降低,正极区生成OH-,溶液的pH升高,B错误。
4.(2023·温州质检)锌-空气二次电池在柔性能源方面应用较多,是各类新能源电池中备受关注的储能设备之一。一种强碱性锌空气电池工作示意图如下,下列说法正确的是( )
A.电流从Zn电极流出
B.OH-向气体扩散电极移动
C.隔膜应为氢离子选择性膜
D.负极区的反应为Zn-2e-+4OH-===Zn,Zn===ZnO+2OH-+H2O
答案 D
解析 该装置为原电池装置,右边电极中Zn元素的化合价升高,为负极,气体扩散电极为正极,电流从气体扩散电极流出,A错误;根据原电池工作原理,OH-向负极移动,即向Zn电极移动,B错误;负极反应式为Zn-2e-+4OH-===Zn(OH),正极反应式为O2+4e-+2H2O===4OH-,隔膜应为氢氧根离子选择性膜,C错误;负极反应式:Zn-2e-+4OH-===Zn(OH),Zn(OH)再分解成ZnO,离子方程式为Zn===ZnO+2OH-+H2O,D正确。
5.(2022·连云港高二期末)利用微电池技术去除天然气中的H2S并生成FeS的装置如图所示,下列说法不正确的是( )
A.微电池负极的电极反应式为Fe-2e-+H2S===FeS+2H+
B.去除过程发生的总反应为2Fe+2H2S+O2===2FeS+2H2O
C.通入气体一段时间后,去除速率降低的可能原因是铁减少,形成微电池的数量减少
D.该装置使用一段时间后,内部有大量的铁锈产生
答案 D
解析 根据题中信息可知,铁生成FeS,铁元素的化合价升高,铁作负极,其电极反应式为Fe-2e-+H2S===FeS+2H+,A正确;氧气在正极上发生反应,电极反应式为O2+4e-+4H+===2H2O,总反应为2Fe+2H2S+O2===2FeS+2H2O,B正确;通入气体一段时间后,去除速率降低,可能原因是产生的FeS附着在铁表面,阻碍反应进行,也可能是铁减少,形成微电池的数量减少,C正确;铁锈主要成分为Fe2O3,根据此装置的总反应可知,铁主要被氧化成FeS,D错误。
6.(2022·北京东城高二期末)热激活电池是一种需要达到启动温度才开始工作的电池。一种热激活电池的结构如图1所示,其放电后的产物为Li7Si3和LiMn2O4。已知:LiCl和KCl混合物的熔点与KCl的物质的量分数的关系如图2所示。
下列说法不正确的是( )
A.放电时,Li+向b极区移动
B.放电时,a极的电极反应是3Li13Si4-11e-===4Li7Si3+11Li+
C.该电池中火药燃烧产生的热能转化为电能
D.调节混合物中KCl的物质的量分数可以改变电池的启动温度
答案 C
解析 放电时,Li+向正极移动,即向b极区移动,A正确;放电时,a极的Li13Si4失电子发生氧化反应,电极反应是3Li13Si4-11e-===4Li7Si3+11Li+,B正确;由图2可知,调节混合物中KCl的物质的量分数为0.6时,400 ℃时就可以启动电池,D正确。
[核心素养发展目标]
1.建立原电池工作的思维模型,能解决新型化学电源在新情境下的放电问题。
2.感悟研制新型化学电源的重要性以及可能会引起的环境问题,形成较为客观且正确的能源观,提高开发洁净清洁燃料的意识。
1.常见考查方向
①电极的判断,②电子或电流的流向,③溶液中离子的移向,④电极的反应类型,⑤pH的变化,⑥电子的转移数目,⑦电极反应式的书写。
2.新型电池中正、负极的判断方法
特别提醒 判断一个原电池中的正、负极,最根本的方法是失电子(发生氧化反应)的一极是负极,得电子(发生还原反应)的一极是正极。如果给出一个化学方程式判断正、负极,可以直接根据化合价的升降来判断,化合价升高、发生氧化反应的一极为负极,化合价降低、发生还原反应的一极为正极。
一、浓差电池
1.(2022·广州高二期末)溶质由高浓度向低浓度扩散而引发的一类电池称为浓差电池。如图是由Ag电极和硝酸银溶液组成的电池(c1
B.B极为正极,发生氧化反应
C.若外电路通过0.1 mol电子,则右侧溶液质量减轻10.8 g
D.原电池的总反应不一定是氧化还原反应
二、膜电池
2.(2022·杭州高二月考)如图装置是一种微生物脱盐电池的装置,它可以通过处理有机废水(以含CH3COO-的溶液为例)获得电能,同时还可实现海水淡化。已知a、b电极为惰性电极,X、Y均为离子交换膜,下列说法错误的是( )
A.X、Y依次为阴离子、阳离子选择性交换膜
B.a极反应为CH3COO-+2H2O-8e-===2CO2+7H+,产生的H+向b极移动
C.b极为正极
D.当电路中转移1 mol电子时,在b极室可以生成40 g NaOH
三、其他常见的新型化学电源
3.(2020·全国卷Ⅲ,12)一种高性能的碱性硼化钒(VB2) 空气电池如图所示,其中在VB2电极发生反应:VB2+16OH--11e-===VO+2B(OH)+4H2O。该电池工作时,下列说法错误的是( )
A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为4VB2+11O2+20OH-+6H2O===8B(OH)+4VO
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
4.(2023·温州质检)锌 空气二次电池在柔性能源方面应用较多,是各类新能源电池中备受关注的储能设备之一。一种强碱性锌空气电池工作示意图如下,下列说法正确的是( )
A.电流从Zn电极流出
B.OH-向气体扩散电极移动
C.隔膜应为氢离子选择性膜
D.负极区的反应为Zn-2e-+4OH-===Zn,Zn===ZnO+2OH-+H2O
5.(2022·连云港高二期末)利用微电池技术去除天然气中的H2S并生成FeS的装置如图所示,下列说法不正确的是( )
A.微电池负极的电极反应式为Fe-2e-+H2S===FeS+2H+
B.去除过程发生的总反应为2Fe+2H2S+O2===2FeS+2H2O
C.通入气体一段时间后,去除速率降低的可能原因是铁减少,形成微电池的数量减少
D.该装置使用一段时间后,内部有大量的铁锈产生
6.(2022·北京东城高二期末)热激活电池是一种需要达到启动温度才开始工作的电池。一种热激活电池的结构如图1所示,其放电后的产物为Li7Si3和LiMn2O4。已知:LiCl和KCl混合物的熔点与KCl的物质的量分数的关系如图2所示。
下列说法不正确的是( )
A.放电时,Li+向b极区移动
B.放电时,a极的电极反应是3Li13Si4-11e-===4Li7Si3+11Li+
C.该电池中火药燃烧产生的热能转化为电能
D.调节混合物中KCl的物质的量分数可以改变电池的启动温度
第3课时 新型化学电源
[核心素养发展目标] 1.建立原电池工作的思维模型,能解决新型化学电源在新情境下的放电问题。2.感悟研制新型化学电源的重要性以及可能会引起的环境问题,形成较为客观且正确的能源观,提高开发洁净清洁燃料的意识。
1.常见考查方向
①电极的判断,②电子或电流的流向,③溶液中离子的移向,④电极的反应类型,⑤pH的变化,⑥电子的转移数目,⑦电极反应式的书写。
2.新型电池中正、负极的判断方法
特别提醒 判断一个原电池中的正、负极,最根本的方法是失电子(发生氧化反应)的一极是负极,得电子(发生还原反应)的一极是正极。如果给出一个化学方程式判断正、负极,可以直接根据化合价的升降来判断,化合价升高、发生氧化反应的一极为负极,化合价降低、发生还原反应的一极为正极。
一、浓差电池
1.(2022·广州高二期末)溶质由高浓度向低浓度扩散而引发的一类电池称为浓差电池。如图是由Ag电极和硝酸银溶液组成的电池(c1
B.B极为正极,发生氧化反应
C.若外电路通过0.1 mol电子,则右侧溶液质量减轻10.8 g
D.原电池的总反应不一定是氧化还原反应
答案 D
解析 由题意知,A电极质量不断减轻,故发生反应:Ag-e-===Ag+,则A极为负极,B极为正极,负极区Ag+浓度增大,正极区Ag+得电子生成Ag,电极反应为Ag++e-===Ag,正极区Ag+浓度减小,浓差电池中溶质由高浓度向低浓度扩散,故正极区NO经过离子交换膜移向负极,此处离子交换膜为阴离子交换膜,A、B错误;正极发生反应:Ag++e-===Ag,当转移0.1 mol电子时,溶液中减少0.1 mol Ag+,同时正极有0.1 mol NO移向负极区,故右侧溶液减少质量为0.1 mol×108 g·mol-1+0.1 mol×62 g·mol-1=17 g,C错误;负极的电极反应式为Ag-e-===Ag+,正极的电极反应式为Ag++e-===Ag,总反应属于非氧化还原反应,D正确。
二、膜电池
2.(2022·杭州高二月考)如图装置是一种微生物脱盐电池的装置,它可以通过处理有机废水(以含CH3COO-的溶液为例)获得电能,同时还可实现海水淡化。已知a、b电极为惰性电极,X、Y均为离子交换膜,下列说法错误的是( )
A.X、Y依次为阴离子、阳离子选择性交换膜
B.a极反应为CH3COO-+2H2O-8e-===2CO2+7H+,产生的H+向b极移动
C.b极为正极
D.当电路中转移1 mol电子时,在b极室可以生成40 g NaOH
答案 B
解析 根据图示可知,在a极上CH3COO-失去电子被氧化生成CO2和H+,碳元素化合价升高,被氧化,所以a极为该原电池的负极,则b极为正极。为了实现海水的淡化,海水中的氯离子需要移向负极,即a极,则隔膜X为阴离子交换膜,钠离子需要移向正极,即b极,则隔膜Y为阳离子交换膜,A正确;a极为负极,C失去电子被氧化生成CO2,同时产生H+,则结合电荷守恒可得电极反应式为CH3COO-+2H2O-8e-===2CO2+7H+,由于隔膜X是阴离子交换膜,所以阻碍生成的H+向正极移动,B错误;当电路中转移1 mol电子时,会有1 mol Na+进入b极室形成1 mol NaOH,其质量是40 g,D正确。
三、其他常见的新型化学电源
3.(2020·全国卷Ⅲ,12)一种高性能的碱性硼化钒(VB2)-空气电池如图所示,其中在VB2电极发生反应:VB2+16OH--11e-===VO+2B(OH)+4H2O。该电池工作时,下列说法错误的是( )
A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
C.电池总反应为4VB2+11O2+20OH-+6H2O===8B(OH)+4VO
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
答案 B
解析 根据VB2电极发生的反应:VB2+16OH--11e-===VO+2B(OH)+4H2O,判断得出VB2电极为负极,复合碳电极为正极,电极反应式为O2+4e-+2H2O===4OH-,所以电池总反应为4VB2+11O2+20OH-+6H2O===8B(OH)+4VO,C正确;负载通过0.04 mol电子时,有0.01 mol氧气参与反应,即标准状况下有0.224 L氧气参与反应,A正确;负极区消耗OH-,溶液的pH降低,正极区生成OH-,溶液的pH升高,B错误。
4.(2023·温州质检)锌-空气二次电池在柔性能源方面应用较多,是各类新能源电池中备受关注的储能设备之一。一种强碱性锌空气电池工作示意图如下,下列说法正确的是( )
A.电流从Zn电极流出
B.OH-向气体扩散电极移动
C.隔膜应为氢离子选择性膜
D.负极区的反应为Zn-2e-+4OH-===Zn,Zn===ZnO+2OH-+H2O
答案 D
解析 该装置为原电池装置,右边电极中Zn元素的化合价升高,为负极,气体扩散电极为正极,电流从气体扩散电极流出,A错误;根据原电池工作原理,OH-向负极移动,即向Zn电极移动,B错误;负极反应式为Zn-2e-+4OH-===Zn(OH),正极反应式为O2+4e-+2H2O===4OH-,隔膜应为氢氧根离子选择性膜,C错误;负极反应式:Zn-2e-+4OH-===Zn(OH),Zn(OH)再分解成ZnO,离子方程式为Zn===ZnO+2OH-+H2O,D正确。
5.(2022·连云港高二期末)利用微电池技术去除天然气中的H2S并生成FeS的装置如图所示,下列说法不正确的是( )
A.微电池负极的电极反应式为Fe-2e-+H2S===FeS+2H+
B.去除过程发生的总反应为2Fe+2H2S+O2===2FeS+2H2O
C.通入气体一段时间后,去除速率降低的可能原因是铁减少,形成微电池的数量减少
D.该装置使用一段时间后,内部有大量的铁锈产生
答案 D
解析 根据题中信息可知,铁生成FeS,铁元素的化合价升高,铁作负极,其电极反应式为Fe-2e-+H2S===FeS+2H+,A正确;氧气在正极上发生反应,电极反应式为O2+4e-+4H+===2H2O,总反应为2Fe+2H2S+O2===2FeS+2H2O,B正确;通入气体一段时间后,去除速率降低,可能原因是产生的FeS附着在铁表面,阻碍反应进行,也可能是铁减少,形成微电池的数量减少,C正确;铁锈主要成分为Fe2O3,根据此装置的总反应可知,铁主要被氧化成FeS,D错误。
6.(2022·北京东城高二期末)热激活电池是一种需要达到启动温度才开始工作的电池。一种热激活电池的结构如图1所示,其放电后的产物为Li7Si3和LiMn2O4。已知:LiCl和KCl混合物的熔点与KCl的物质的量分数的关系如图2所示。
下列说法不正确的是( )
A.放电时,Li+向b极区移动
B.放电时,a极的电极反应是3Li13Si4-11e-===4Li7Si3+11Li+
C.该电池中火药燃烧产生的热能转化为电能
D.调节混合物中KCl的物质的量分数可以改变电池的启动温度
答案 C
解析 放电时,Li+向正极移动,即向b极区移动,A正确;放电时,a极的Li13Si4失电子发生氧化反应,电极反应是3Li13Si4-11e-===4Li7Si3+11Li+,B正确;由图2可知,调节混合物中KCl的物质的量分数为0.6时,400 ℃时就可以启动电池,D正确。
