第四章 化学反应与电能 体系构建 高考体验 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1
文档属性
| 名称 | 第四章 化学反应与电能 体系构建 高考体验 学案 (含答案)—2023-2024学年(人教版2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 891.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-30 17:25:26 | ||
图片预览




文档简介
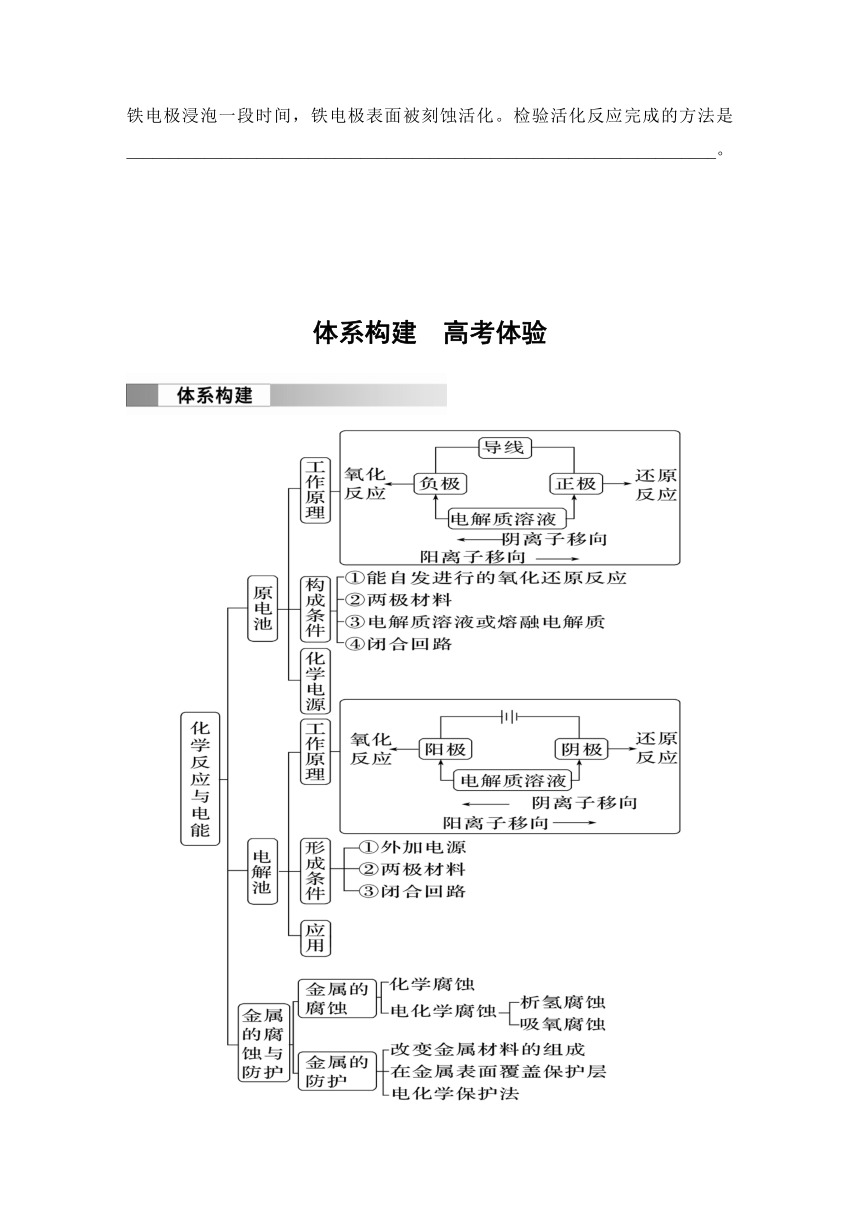
第四章 化学反应与电能 体系构建 高考体验
考向一 新型燃料电池
例1 (2021·山东,10)以KOH溶液为离子导体,分别组成CH3OH O2、N2H4 O2、(CH3)2NNH2 O2清洁燃料电池,下列说法正确的是( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2 O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4 O2燃料电池气体产物的体积在标准状况下为11.2 L
考向二 新型化学电源(二次电池)
例2 (2022·广东,16)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
例3 (2020·全国卷Ⅰ,12)科学家近年发明了一种新型Zn CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为Zn-2e-+4OH-===Zn(OH)
B.放电时,1 mol CO2转化为HCOOH,转移的电子数为2 mol
C.充电时,电池总反应为2Zn(OH)===2Zn+O2↑+4OH-+2H2O
D.充电时,正极溶液中OH-浓度升高
考向三 金属的腐蚀与防护
例4 (2022·广东,11)为检验牺牲阳极法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
例5 (2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是( )
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
考向四 电化学实验
例6 (2020·全国卷Ⅰ,27)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、________________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择_______作为电解质。
阳离子 u∞×108/(m2·s-1·V-1) 阴离子 u∞×108/(m2·s-1·V-1)
Li+ 4.07 HCO 4.61
Na+ 5.19 NO 7.40
Ca2+ 6.59 Cl- 7.91
K+ 7.62 SO 8.27
(3)检流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=____________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______________________________,
铁电极的电极反应式为__________________。因此,验证了Fe2+氧化性小于________,还原性小于________________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是____________________________________________________________________。
体系构建 高考体验
考向一 新型燃料电池
例1 (2021·山东,10)以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
答案 C
解析 放电过程为原电池工作原理,所以钾离子均向正极移动,A错误;碱性环境下,N2H4-O2清洁燃料电池总反应为N2H4+O2===N2+2H2O,其总反应中未消耗KOH,所以KOH的物质的量不变,其他两种燃料电池根据总反应可知,KOH的物质的量均减小,B错误;理论放电量与燃料的物质的量和转移电子数有关,设消耗燃料的质量均为m g,则甲醇、N2H4和(CH3)2NNH2放电量(物质的量表达式)分别是×6、×4、×16,通过比较可知(CH3)2NNH2理论放电量最大,C正确;根据转移电子数守恒和总反应式可知,消耗1 mol O2生成的氮气的物质的量为1 mol,在标准状况下体积为22.4 L,D错误。
考向二 新型化学电源(二次电池)
例2 (2022·广东,16)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
答案 C
解析 由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;放电时负极反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,正极反应为Cl2+2e-===2Cl-,反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,pH不变,故B错误、C正确;充电时阳极反应为2Cl--2e-===Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3,由得失电子守恒可知,每生成1 mol Cl2,电极a质量理论上增加23 g·mol-1×2 mol=46 g,故D错误。
例3 (2020·全国卷Ⅰ,12)科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为Zn-2e-+4OH-===Zn(OH)
B.放电时,1 mol CO2转化为HCOOH,转移的电子数为2 mol
C.充电时,电池总反应为2Zn(OH)===2Zn+O2↑+4OH-+2H2O
D.充电时,正极溶液中OH-浓度升高
答案 D
解析 由装置示意图可知,放电时负极反应为Zn-2e-+4OH-===Zn(OH),A项正确;放电时CO2转化为HCOOH,C元素化合价降低2,则1 mol CO2转化为HCOOH时,转移电子数为2 mol,B项正确;由装置示意图可知充电时正极(阳极)产生O2,负极(阴极)产生Zn,C项正确;充电时正极(阳极)上发生反应2H2O-4e-===4H++O2↑,OH-浓度降低,D项错误。
考向三 金属的腐蚀与防护
例4 (2022·广东,11)为检验牺牲阳极法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
答案 D
解析 将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中,会构成原电池,由于锌比铁活泼,锌作原电池的负极,铁片作正极,溶液中破损的位置会变大,铁也会继续和酸化的氯化钠溶液反应产生氢气,溶液中会有亚铁离子生成。氯化钠溶液中始终存在氯离子,所以加入硝酸银溶液后,不管铁片是否被腐蚀,均会出现白色沉淀,故A不符合题意;淀粉碘化钾溶液可检测氧化性物质,但不论铁片是否被腐蚀,均无氧化性物质生成,故B不符合题意;KSCN溶液可检测铁离子的存在,上述过程中不会出现铁离子,所以无论铁片是否被腐蚀,加入KSCN溶液后,均无红色出现,故C不符合题意;K3[Fe(CN)6]溶液是用于检测Fe2+的试剂,若铁片没有被腐蚀,则溶液中不会生成亚铁离子,则加入K3[Fe(CN)6]溶液就不会出现蓝色沉淀,故D符合题意。
例5 (2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是( )
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
答案 C
解析 阴极得电子,A错误;金属M失电子,其活动性应比铁强,B错误;M失去的电子流入钢铁设施表面,钢铁设施不易失去电子而被保护,C正确;海水所含电解质的浓度远大于河水,因此钢铁设施在海水中被腐蚀的速率快,D错误。
考向四 电化学实验
例6 (2020·全国卷Ⅰ,27)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、________________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择_______作为电解质。
阳离子 u∞×108/(m2·s-1·V-1) 阴离子 u∞×108/(m2·s-1·V-1)
Li+ 4.07 HCO 4.61
Na+ 5.19 NO 7.40
Ca2+ 6.59 Cl- 7.91
K+ 7.62 SO 8.27
(3)检流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______________________,铁电极的电极反应式为________________。因此,验证了Fe2+氧化性小于________,还原性小于________________________________________________________________________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_________________________
_____________________________________________________________________________。
答案 (1)烧杯、量筒、托盘天平 (2)KCl (3)石墨
(4)0.09 mol·L-1 (5)Fe3++e-===Fe2+ Fe-2e-===Fe2+ Fe3+ Fe
(6)取活化后溶液少许于试管中,加入KSCN溶液,溶液不出现红色
解析 (1)根据用固体物质配制一定物质的量浓度溶液的方法可知,题图给出的仪器中还需要烧杯、量筒和托盘天平。(2)盐桥中阴、阳离子不与溶液中的物质发生反应,两烧杯溶液中含有Fe2+、Fe3+和SO,Ca2+与SO生成微溶于水的CaSO4,Fe2+、Fe3+均与HCO反应,酸性条件下NO与Fe2+发生反应,故盐桥中不能含有Ca2+、HCO和NO。盐桥中阴、阳离子的电迁移率u∞尽可能相近,分析表中阳离子和阴离子的u∞数据,K+和Cl-的u∞相差较小,故盐桥中应选择KCl作为电解质。
(3)检流表显示电子由铁电极流向石墨电极,则铁电极是负极,石墨电极是正极,盐桥中阳离子向正极移动,故阳离子进入石墨电极溶液中。
(4)假设两个烧杯中溶液体积均为V L,铁电极反应式为Fe-2e-===Fe2+,一段时间后,铁电极溶液中c(Fe2+)增加0.02 mol·L-1,则电路中通过电子的物质的量为0.02 mol·L-1×V L×2=0.04V mol。石墨电极上未见Fe析出,则石墨电极反应式为Fe3++e-===Fe2+,据得失电子守恒可知,石墨电极生成Fe2+的物质的量为0.04V mol,故石墨电极溶液中c(Fe2+)==0.09 mol·L-1。
(5)由(4)分析可知,石墨电极反应式为Fe3++e-===Fe2+,据此得出Fe2+的氧化性小于Fe3+;铁电极反应式为Fe-2e-===Fe2+,据此得出Fe2+的还原性小于Fe。
(6)铁电极表面被刻蚀活化,Fe与Fe2(SO4)3溶液发生反应:Fe+Fe2(SO4)3===3FeSO4,活化反应完成后,溶液中不含Fe3+,可向FeSO4溶液中滴加KSCN溶液,若溶液不变红色,证明活化反应完成。
考向一 新型燃料电池
例1 (2021·山东,10)以KOH溶液为离子导体,分别组成CH3OH O2、N2H4 O2、(CH3)2NNH2 O2清洁燃料电池,下列说法正确的是( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2 O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4 O2燃料电池气体产物的体积在标准状况下为11.2 L
考向二 新型化学电源(二次电池)
例2 (2022·广东,16)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
例3 (2020·全国卷Ⅰ,12)科学家近年发明了一种新型Zn CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为Zn-2e-+4OH-===Zn(OH)
B.放电时,1 mol CO2转化为HCOOH,转移的电子数为2 mol
C.充电时,电池总反应为2Zn(OH)===2Zn+O2↑+4OH-+2H2O
D.充电时,正极溶液中OH-浓度升高
考向三 金属的腐蚀与防护
例4 (2022·广东,11)为检验牺牲阳极法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
例5 (2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是( )
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
考向四 电化学实验
例6 (2020·全国卷Ⅰ,27)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、________________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择_______作为电解质。
阳离子 u∞×108/(m2·s-1·V-1) 阴离子 u∞×108/(m2·s-1·V-1)
Li+ 4.07 HCO 4.61
Na+ 5.19 NO 7.40
Ca2+ 6.59 Cl- 7.91
K+ 7.62 SO 8.27
(3)检流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=____________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______________________________,
铁电极的电极反应式为__________________。因此,验证了Fe2+氧化性小于________,还原性小于________________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是____________________________________________________________________。
体系构建 高考体验
考向一 新型燃料电池
例1 (2021·山东,10)以KOH溶液为离子导体,分别组成CH3OH-O2、N2H4-O2、(CH3)2NNH2-O2清洁燃料电池,下列说法正确的是( )
A.放电过程中,K+均向负极移动
B.放电过程中,KOH物质的量均减小
C.消耗等质量燃料,(CH3)2NNH2-O2燃料电池的理论放电量最大
D.消耗1 mol O2时,理论上N2H4-O2燃料电池气体产物的体积在标准状况下为11.2 L
答案 C
解析 放电过程为原电池工作原理,所以钾离子均向正极移动,A错误;碱性环境下,N2H4-O2清洁燃料电池总反应为N2H4+O2===N2+2H2O,其总反应中未消耗KOH,所以KOH的物质的量不变,其他两种燃料电池根据总反应可知,KOH的物质的量均减小,B错误;理论放电量与燃料的物质的量和转移电子数有关,设消耗燃料的质量均为m g,则甲醇、N2H4和(CH3)2NNH2放电量(物质的量表达式)分别是×6、×4、×16,通过比较可知(CH3)2NNH2理论放电量最大,C正确;根据转移电子数守恒和总反应式可知,消耗1 mol O2生成的氮气的物质的量为1 mol,在标准状况下体积为22.4 L,D错误。
考向二 新型化学电源(二次电池)
例2 (2022·广东,16)科学家基于Cl2易溶于CCl4的性质,发展了一种无需离子交换膜的新型氯流电池,可作储能设备(如图)。充电时电极a的反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3。下列说法正确的是( )
A.充电时电极b是阴极
B.放电时NaCl溶液的pH减小
C.放电时NaCl溶液的浓度增大
D.每生成1 mol Cl2,电极a质量理论上增加23 g
答案 C
解析 由充电时电极a的反应可知,充电时电极a发生还原反应,所以电极a是阴极,则电极b是阳极,故A错误;放电时负极反应为Na3Ti2(PO4)3-2e-===NaTi2(PO4)3+2Na+,正极反应为Cl2+2e-===2Cl-,反应后Na+和Cl-浓度都增大,则放电时NaCl溶液的浓度增大,pH不变,故B错误、C正确;充电时阳极反应为2Cl--2e-===Cl2↑,阴极反应为NaTi2(PO4)3+2Na++2e-===Na3Ti2(PO4)3,由得失电子守恒可知,每生成1 mol Cl2,电极a质量理论上增加23 g·mol-1×2 mol=46 g,故D错误。
例3 (2020·全国卷Ⅰ,12)科学家近年发明了一种新型Zn-CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为Zn-2e-+4OH-===Zn(OH)
B.放电时,1 mol CO2转化为HCOOH,转移的电子数为2 mol
C.充电时,电池总反应为2Zn(OH)===2Zn+O2↑+4OH-+2H2O
D.充电时,正极溶液中OH-浓度升高
答案 D
解析 由装置示意图可知,放电时负极反应为Zn-2e-+4OH-===Zn(OH),A项正确;放电时CO2转化为HCOOH,C元素化合价降低2,则1 mol CO2转化为HCOOH时,转移电子数为2 mol,B项正确;由装置示意图可知充电时正极(阳极)产生O2,负极(阴极)产生Zn,C项正确;充电时正极(阳极)上发生反应2H2O-4e-===4H++O2↑,OH-浓度降低,D项错误。
考向三 金属的腐蚀与防护
例4 (2022·广东,11)为检验牺牲阳极法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
答案 D
解析 将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中,会构成原电池,由于锌比铁活泼,锌作原电池的负极,铁片作正极,溶液中破损的位置会变大,铁也会继续和酸化的氯化钠溶液反应产生氢气,溶液中会有亚铁离子生成。氯化钠溶液中始终存在氯离子,所以加入硝酸银溶液后,不管铁片是否被腐蚀,均会出现白色沉淀,故A不符合题意;淀粉碘化钾溶液可检测氧化性物质,但不论铁片是否被腐蚀,均无氧化性物质生成,故B不符合题意;KSCN溶液可检测铁离子的存在,上述过程中不会出现铁离子,所以无论铁片是否被腐蚀,加入KSCN溶液后,均无红色出现,故C不符合题意;K3[Fe(CN)6]溶液是用于检测Fe2+的试剂,若铁片没有被腐蚀,则溶液中不会生成亚铁离子,则加入K3[Fe(CN)6]溶液就不会出现蓝色沉淀,故D符合题意。
例5 (2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是( )
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
答案 C
解析 阴极得电子,A错误;金属M失电子,其活动性应比铁强,B错误;M失去的电子流入钢铁设施表面,钢铁设施不易失去电子而被保护,C正确;海水所含电解质的浓度远大于河水,因此钢铁设施在海水中被腐蚀的速率快,D错误。
考向四 电化学实验
例6 (2020·全国卷Ⅰ,27)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、________________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择_______作为电解质。
阳离子 u∞×108/(m2·s-1·V-1) 阴离子 u∞×108/(m2·s-1·V-1)
Li+ 4.07 HCO 4.61
Na+ 5.19 NO 7.40
Ca2+ 6.59 Cl- 7.91
K+ 7.62 SO 8.27
(3)检流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______________________,铁电极的电极反应式为________________。因此,验证了Fe2+氧化性小于________,还原性小于________________________________________________________________________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_________________________
_____________________________________________________________________________。
答案 (1)烧杯、量筒、托盘天平 (2)KCl (3)石墨
(4)0.09 mol·L-1 (5)Fe3++e-===Fe2+ Fe-2e-===Fe2+ Fe3+ Fe
(6)取活化后溶液少许于试管中,加入KSCN溶液,溶液不出现红色
解析 (1)根据用固体物质配制一定物质的量浓度溶液的方法可知,题图给出的仪器中还需要烧杯、量筒和托盘天平。(2)盐桥中阴、阳离子不与溶液中的物质发生反应,两烧杯溶液中含有Fe2+、Fe3+和SO,Ca2+与SO生成微溶于水的CaSO4,Fe2+、Fe3+均与HCO反应,酸性条件下NO与Fe2+发生反应,故盐桥中不能含有Ca2+、HCO和NO。盐桥中阴、阳离子的电迁移率u∞尽可能相近,分析表中阳离子和阴离子的u∞数据,K+和Cl-的u∞相差较小,故盐桥中应选择KCl作为电解质。
(3)检流表显示电子由铁电极流向石墨电极,则铁电极是负极,石墨电极是正极,盐桥中阳离子向正极移动,故阳离子进入石墨电极溶液中。
(4)假设两个烧杯中溶液体积均为V L,铁电极反应式为Fe-2e-===Fe2+,一段时间后,铁电极溶液中c(Fe2+)增加0.02 mol·L-1,则电路中通过电子的物质的量为0.02 mol·L-1×V L×2=0.04V mol。石墨电极上未见Fe析出,则石墨电极反应式为Fe3++e-===Fe2+,据得失电子守恒可知,石墨电极生成Fe2+的物质的量为0.04V mol,故石墨电极溶液中c(Fe2+)==0.09 mol·L-1。
(5)由(4)分析可知,石墨电极反应式为Fe3++e-===Fe2+,据此得出Fe2+的氧化性小于Fe3+;铁电极反应式为Fe-2e-===Fe2+,据此得出Fe2+的还原性小于Fe。
(6)铁电极表面被刻蚀活化,Fe与Fe2(SO4)3溶液发生反应:Fe+Fe2(SO4)3===3FeSO4,活化反应完成后,溶液中不含Fe3+,可向FeSO4溶液中滴加KSCN溶液,若溶液不变红色,证明活化反应完成。
