【人教版】高中化学 选择性必修一 第二章 第三节 化学反应的方向 课件(共16张PPT)
文档属性
| 名称 | 【人教版】高中化学 选择性必修一 第二章 第三节 化学反应的方向 课件(共16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 39.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 18:32:53 | ||
图片预览




文档简介
(共16张PPT)
吴 彦
化学反应的方向
第二章 化学反应速率与化学平衡
第3节 化学反应的方向
一、创设情境,引入新课
《千字文》选文:天地玄黄,宇宙洪荒。日月盈昃,辰宿列张。寒来暑往,秋收冬藏。
如果一个化学反应已经发生,方向也就确定了;如果还没发生,就需要依据科学理论,对其能否发生,以及什么条件下发生做出判断。
一、创设情境,引入新课
汽车是我们日常生活的助手,而汽车尾气中含有CO和NO等大气污染物。人们曾设计出这样的反应,设想使CO和NO相互作用,生成能参与大气循环的气体:
2CO(g)+2NO(g)=N2(g)+2CO2(g)
该反应常温下能够自发进行吗?
如何判断化学反应的方向?
什么是自发过程和自发反应呢?
二、感受过程,提升认识
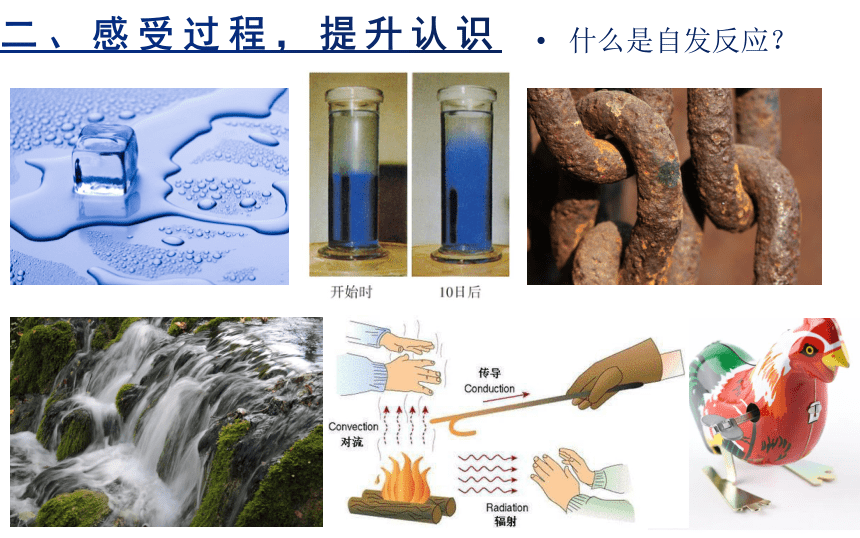
什么是自发反应?
二、感受过程,提升认识
什么是自发反应?
(1)对自发(非自发)过程的认识:无需持续的外力作用即可自动发生的过程为自发过程;没有持续的外力作用就不会发生的过程为非自发过程。
(2)自发反应举例:酸碱中和反应,如NaOH与HCl的反应:Zn与H2SO4、Na与H2O等置换反应;Fe与CuSO4等较活泼金属置换不活泼金属的反应。
2H2+O2=2H2O
点燃
Na+Cl2=2NaCl
C6H12O6+6O2=6CO2+6H2O
酶
这些能自发的反应与上述讨论的自发反应有何不同?
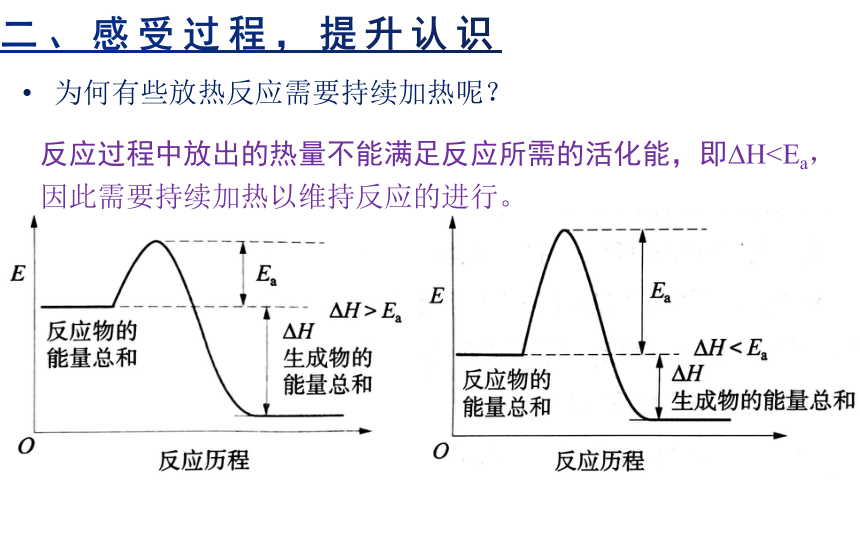
自发反应需要点燃、加热或使用催化剂的原因:引发反应,提供最初反应的驱动力,克服反应过程中的活化能(Ea)。同时,反应过程中放出的热量大于反应所需活化能,即 H>Ea,因此反应一经引发,就可以持续进行。
二、感受过程,提升认识
反应过程中放出的热量不能满足反应所需的活化能,即 H为何有些放热反应需要持续加热呢?
二、感受过程,提升认识
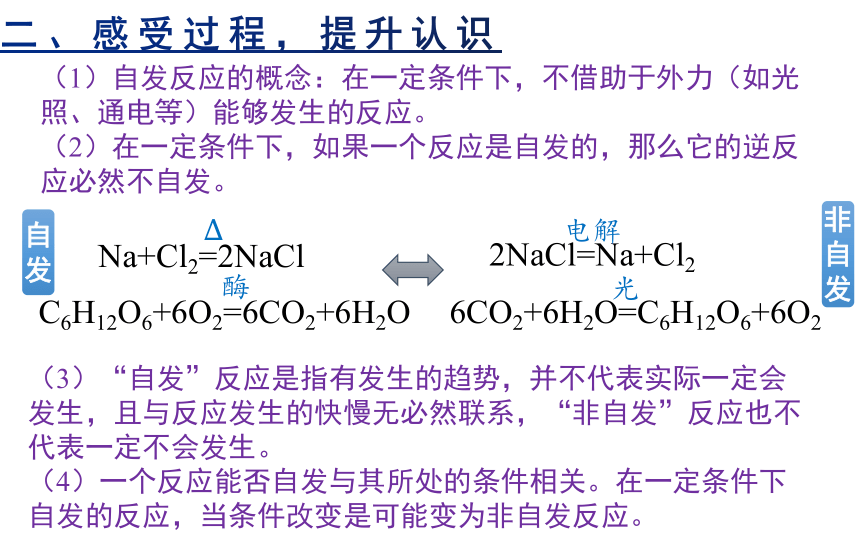
(1)自发反应的概念:在一定条件下,不借助于外力(如光照、通电等)能够发生的反应。
(2)在一定条件下,如果一个反应是自发的,那么它的逆反应必然不自发。
Na+Cl2=2NaCl
C6H12O6+6O2=6CO2+6H2O
酶
自发
2NaCl=Na+Cl2
电解
6CO2+6H2O=C6H12O6+6O2
光
非自发
(3)“自发”反应是指有发生的趋势,并不代表实际一定会发生,且与反应发生的快慢无必然联系,“非自发”反应也不代表一定不会发生。
(4)一个反应能否自发与其所处的条件相关。在一定条件下自发的反应,当条件改变是可能变为非自发反应。
三、理性分析,获得方法
(1)H+(aq)+OH-(aq)=H2O(l) H=-57.3kJ/mol
(2)Cu(OH)2(s) +2H+(aq)=Cu2+(aq)+2H2O(l) H=-56.8kJ/mol
(3)Ba2+(aq)+SO42-(aq)=BaSO4(s) H=-26.3kJ/mol
(4)C(s)+O2(g)=CO2(g) H=-393.5kJ/mol
(5)4Na(s)+O2(g)=2Na2O(s) H=-828.4kJ/mol
以上反应在一定条件下均能自发进行。
这些反应有哪些共同特点?为何能够自发进行?
能量降低(即焓减)的反应有自发进行的倾向。
能自发进行的反应都是焓减的吗?
Ba(OH)2·8H2O晶体与NH4Cl晶体的反应。
三、理性分析,获得方法
下列吸热反应也能自发进行:
多数能自发进行的反应为放热反应,
有些吸热反应也能自发进行。
不能仅仅依靠反应的焓变来判断反应能否自发进行。
(1)2N2O5(g)=4NO2(g)+O2(g) H=+109.8kJ/mol
(2)NaHCO3(s) +HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) H=+31.4kJ/mol
为什么这些吸热反应也能自发进行?
三、理性分析,获得方法
上述自发过程有哪些共同特点?
熵(S)
体系混乱度量度
单位:J·mol-1·K-1
体系越混乱,
熵值就越大。
三、理性分析,获得方法
下列过程在通常情况下均导致体系熵增:
①由固体物质变为纯液体或液体溶液;
②由固体或液体变为气体;
③气体分子总数增加的化学反应;
④物质温度升高
熵增原理:在孤立体系或绝热体系中,自发过程将导致体系的熵值增大,即熵变大于零( S>0)有利于自发进行。
(1)Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) S>0
(2)2KClO3(s)=2KCl(s)+O2(g) S>0
三、理性分析,获得方法
对于熵减反应,是否都不能自发进行呢?
在等温、等压条件下的封闭体系中,自由能(符号为 G,单位为mol/L)的变化综合反映了体系的焓变和熵变对自发过程的影响: G= H-T S。化学反应总是向着自由能减小的方向进行,直至体系达到平衡:
当G>0时,反应能自发进行
当G=0时,反应处于平衡状态
当G>0时,反应不能自发进行
2H2(g)+O2(g)=2H2O(l) H<0, S<0
该如何判断反应的自发性呢?
三、理性分析,获得方法
序号 实例 H S 反应进行的方向
① Mg+2HCl=MgCl2+H2↑ <0 >0 一定能自发进行
② 2CO=C+O2 >0 <0 一定不能自发进行
③ CaCO3=CaO+CO2↑ >0 >0 不能确定(与温度有关,高温下自发进行)
④ N2+3H2=2NH3 <0 <0 不能确定(与温度有关,低温下自发进行)
焓变和熵变对化学反应过程的影响
当G>0时,反应能自发进行
当G=0时,反应处于平衡状态
当G>0时,反应不能自发进行
四、归纳整合,迁移应用
金属钾的制备:Na(l)+KCl(l)=K(g)+NaCl(l) H<0, S<0
依据金属活动性反应不能发生,为何反应能够发生?
K的沸点(759℃)低于Na的沸点(883℃)。实际反应中,适当控制温度,使K汽化并保持Na呈液态,增大反应过程中的熵值变化。
上述反应的趋势很强,但实际反应速率极小,如何解决?
寻找合适的催化剂。
课堂小结
化学反应的方向
化学反应进行的方向
( H、 S)
速率、限度
继续研究
自发反应:在一定条件下,不借助与外力(如光照、通电等)能够发生的反应
H<0
S>0
非自发反应
提供外力:光能、电能等
改变反应历程
今日作业
1.梳理课堂笔记。
吴 彦
化学反应的方向
第二章 化学反应速率与化学平衡
第3节 化学反应的方向
一、创设情境,引入新课
《千字文》选文:天地玄黄,宇宙洪荒。日月盈昃,辰宿列张。寒来暑往,秋收冬藏。
如果一个化学反应已经发生,方向也就确定了;如果还没发生,就需要依据科学理论,对其能否发生,以及什么条件下发生做出判断。
一、创设情境,引入新课
汽车是我们日常生活的助手,而汽车尾气中含有CO和NO等大气污染物。人们曾设计出这样的反应,设想使CO和NO相互作用,生成能参与大气循环的气体:
2CO(g)+2NO(g)=N2(g)+2CO2(g)
该反应常温下能够自发进行吗?
如何判断化学反应的方向?
什么是自发过程和自发反应呢?
二、感受过程,提升认识
什么是自发反应?
二、感受过程,提升认识
什么是自发反应?
(1)对自发(非自发)过程的认识:无需持续的外力作用即可自动发生的过程为自发过程;没有持续的外力作用就不会发生的过程为非自发过程。
(2)自发反应举例:酸碱中和反应,如NaOH与HCl的反应:Zn与H2SO4、Na与H2O等置换反应;Fe与CuSO4等较活泼金属置换不活泼金属的反应。
2H2+O2=2H2O
点燃
Na+Cl2=2NaCl
C6H12O6+6O2=6CO2+6H2O
酶
这些能自发的反应与上述讨论的自发反应有何不同?
自发反应需要点燃、加热或使用催化剂的原因:引发反应,提供最初反应的驱动力,克服反应过程中的活化能(Ea)。同时,反应过程中放出的热量大于反应所需活化能,即 H>Ea,因此反应一经引发,就可以持续进行。
二、感受过程,提升认识
反应过程中放出的热量不能满足反应所需的活化能,即 H
二、感受过程,提升认识
(1)自发反应的概念:在一定条件下,不借助于外力(如光照、通电等)能够发生的反应。
(2)在一定条件下,如果一个反应是自发的,那么它的逆反应必然不自发。
Na+Cl2=2NaCl
C6H12O6+6O2=6CO2+6H2O
酶
自发
2NaCl=Na+Cl2
电解
6CO2+6H2O=C6H12O6+6O2
光
非自发
(3)“自发”反应是指有发生的趋势,并不代表实际一定会发生,且与反应发生的快慢无必然联系,“非自发”反应也不代表一定不会发生。
(4)一个反应能否自发与其所处的条件相关。在一定条件下自发的反应,当条件改变是可能变为非自发反应。
三、理性分析,获得方法
(1)H+(aq)+OH-(aq)=H2O(l) H=-57.3kJ/mol
(2)Cu(OH)2(s) +2H+(aq)=Cu2+(aq)+2H2O(l) H=-56.8kJ/mol
(3)Ba2+(aq)+SO42-(aq)=BaSO4(s) H=-26.3kJ/mol
(4)C(s)+O2(g)=CO2(g) H=-393.5kJ/mol
(5)4Na(s)+O2(g)=2Na2O(s) H=-828.4kJ/mol
以上反应在一定条件下均能自发进行。
这些反应有哪些共同特点?为何能够自发进行?
能量降低(即焓减)的反应有自发进行的倾向。
能自发进行的反应都是焓减的吗?
Ba(OH)2·8H2O晶体与NH4Cl晶体的反应。
三、理性分析,获得方法
下列吸热反应也能自发进行:
多数能自发进行的反应为放热反应,
有些吸热反应也能自发进行。
不能仅仅依靠反应的焓变来判断反应能否自发进行。
(1)2N2O5(g)=4NO2(g)+O2(g) H=+109.8kJ/mol
(2)NaHCO3(s) +HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) H=+31.4kJ/mol
为什么这些吸热反应也能自发进行?
三、理性分析,获得方法
上述自发过程有哪些共同特点?
熵(S)
体系混乱度量度
单位:J·mol-1·K-1
体系越混乱,
熵值就越大。
三、理性分析,获得方法
下列过程在通常情况下均导致体系熵增:
①由固体物质变为纯液体或液体溶液;
②由固体或液体变为气体;
③气体分子总数增加的化学反应;
④物质温度升高
熵增原理:在孤立体系或绝热体系中,自发过程将导致体系的熵值增大,即熵变大于零( S>0)有利于自发进行。
(1)Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) S>0
(2)2KClO3(s)=2KCl(s)+O2(g) S>0
三、理性分析,获得方法
对于熵减反应,是否都不能自发进行呢?
在等温、等压条件下的封闭体系中,自由能(符号为 G,单位为mol/L)的变化综合反映了体系的焓变和熵变对自发过程的影响: G= H-T S。化学反应总是向着自由能减小的方向进行,直至体系达到平衡:
当G>0时,反应能自发进行
当G=0时,反应处于平衡状态
当G>0时,反应不能自发进行
2H2(g)+O2(g)=2H2O(l) H<0, S<0
该如何判断反应的自发性呢?
三、理性分析,获得方法
序号 实例 H S 反应进行的方向
① Mg+2HCl=MgCl2+H2↑ <0 >0 一定能自发进行
② 2CO=C+O2 >0 <0 一定不能自发进行
③ CaCO3=CaO+CO2↑ >0 >0 不能确定(与温度有关,高温下自发进行)
④ N2+3H2=2NH3 <0 <0 不能确定(与温度有关,低温下自发进行)
焓变和熵变对化学反应过程的影响
当G>0时,反应能自发进行
当G=0时,反应处于平衡状态
当G>0时,反应不能自发进行
四、归纳整合,迁移应用
金属钾的制备:Na(l)+KCl(l)=K(g)+NaCl(l) H<0, S<0
依据金属活动性反应不能发生,为何反应能够发生?
K的沸点(759℃)低于Na的沸点(883℃)。实际反应中,适当控制温度,使K汽化并保持Na呈液态,增大反应过程中的熵值变化。
上述反应的趋势很强,但实际反应速率极小,如何解决?
寻找合适的催化剂。
课堂小结
化学反应的方向
化学反应进行的方向
( H、 S)
速率、限度
继续研究
自发反应:在一定条件下,不借助与外力(如光照、通电等)能够发生的反应
H<0
S>0
非自发反应
提供外力:光能、电能等
改变反应历程
今日作业
1.梳理课堂笔记。
