【人教版】高中化学 选择性必修一 第四章 第一节 原电池 第二课时 原电池的工作原理 课件
文档属性
| 名称 | 【人教版】高中化学 选择性必修一 第四章 第一节 原电池 第二课时 原电池的工作原理 课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 30.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 14:25:45 | ||
图片预览


文档简介
(共22张PPT)
原电池的工作原理
第四章 化学反应与电能
第1节 原电池
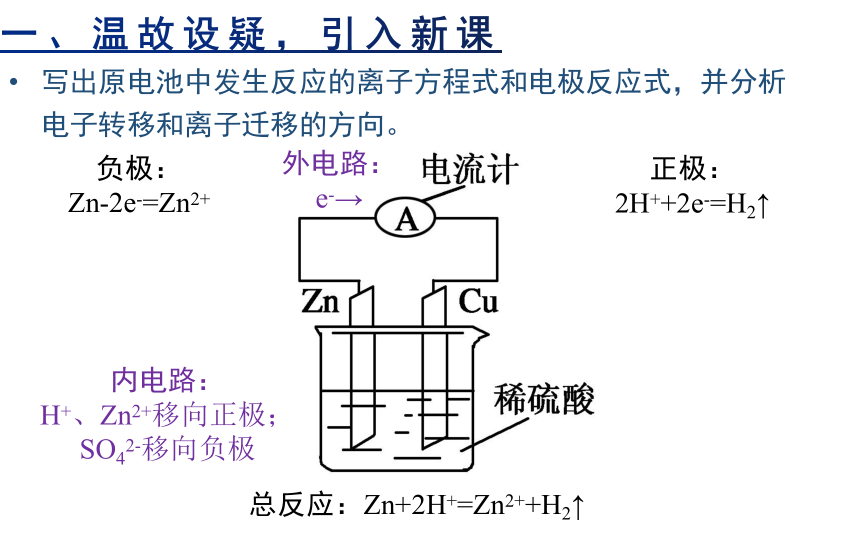
一、温故设疑,引入新课
写出原电池中发生反应的离子方程式和电极反应式,并分析电子转移和离子迁移的方向。
总反应:Zn+2H+=Zn2++H2↑
负极:
Zn-2e-=Zn2+
正极:
2H++2e-=H2↑
外电路:e-→
内电路:
H+、Zn2+移向正极;
SO42-移向负极
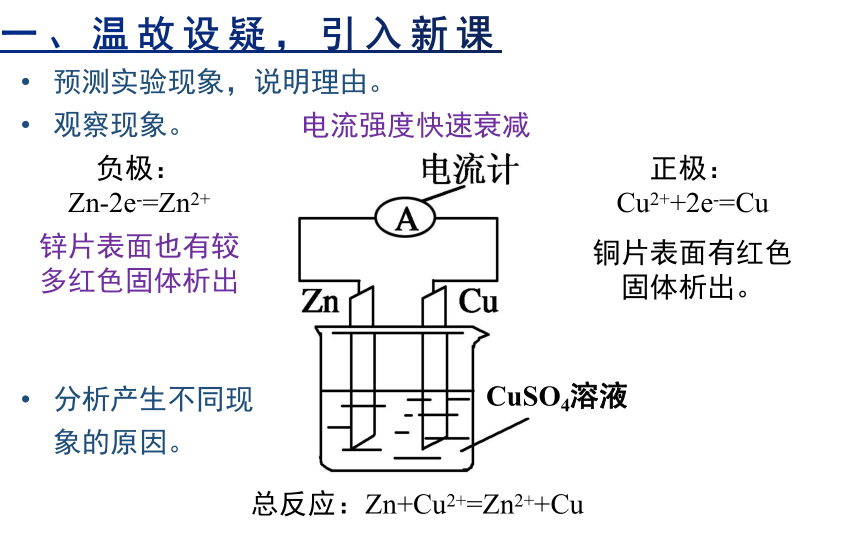
一、温故设疑,引入新课
预测实验现象,说明理由。
观察现象。
CuSO4溶液
负极:
Zn-2e-=Zn2+
正极:
Cu2++2e-=Cu
总反应:Zn+Cu2+=Zn2++Cu
铜片表面有红色固体析出。
锌片表面也有较多红色固体析出
电流强度快速衰减
分析产生不同现象的原因。
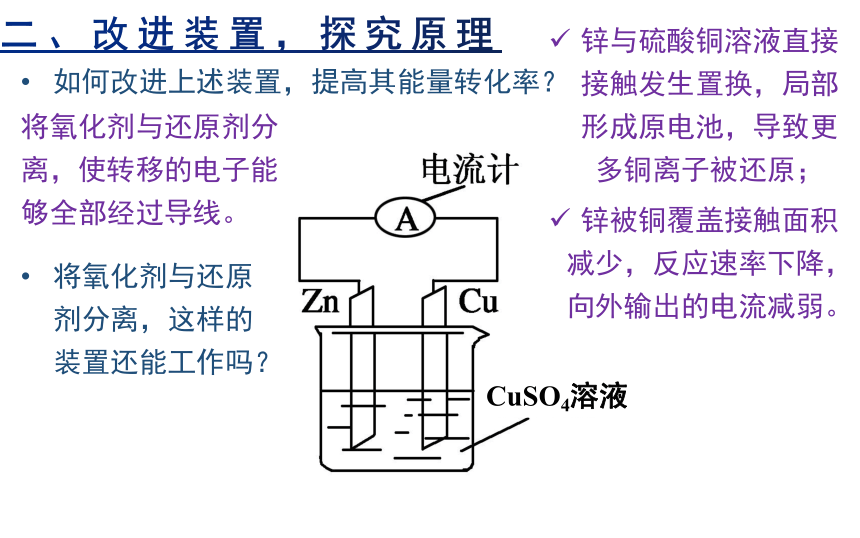
二、改进装置,探究原理
CuSO4溶液
锌与硫酸铜溶液直接接触发生置换,局部形成原电池,导致更多铜离子被还原;
锌被铜覆盖接触面积减少,反应速率下降,向外输出的电流减弱。
如何改进上述装置,提高其能量转化率?
将氧化剂与还原剂分离,使转移的电子能够全部经过导线。
将氧化剂与还原剂分离,这样的装置还能工作吗?
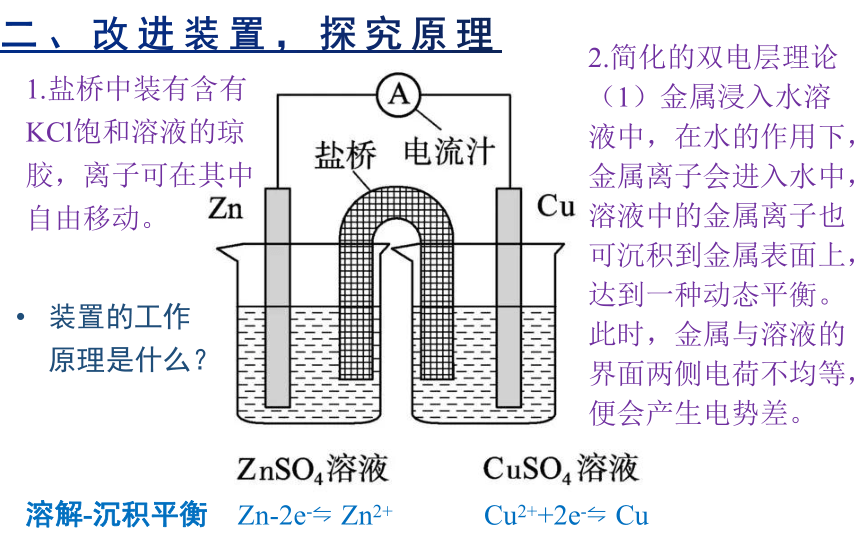
二、改进装置,探究原理
2.简化的双电层理论
(1)金属浸入水溶液中,在水的作用下,金属离子会进入水中,溶液中的金属离子也可沉积到金属表面上,达到一种动态平衡。此时,金属与溶液的界面两侧电荷不均等,便会产生电势差。
1.盐桥中装有含有KCl饱和溶液的琼胶,离子可在其中自由移动。
装置的工作原理是什么?
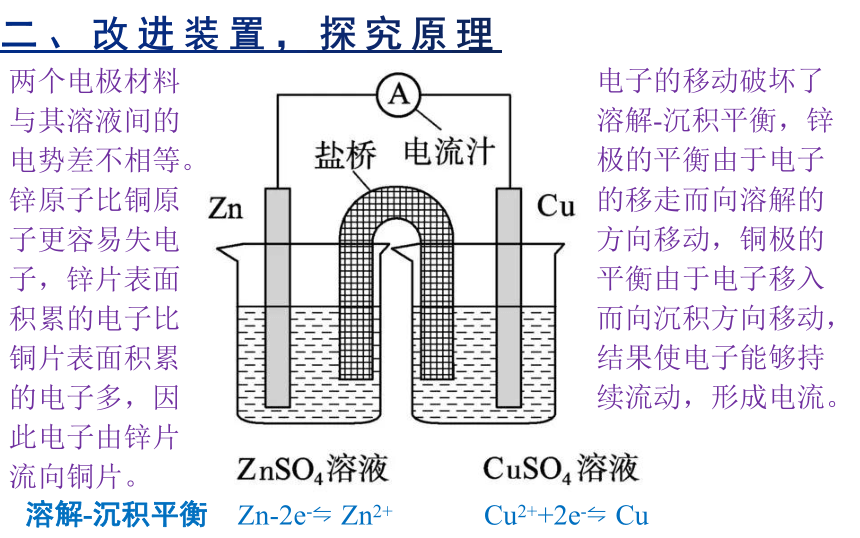
Zn-2e- Zn2+
Cu2++2e- Cu
溶解-沉积平衡
二、改进装置,探究原理
两个电极材料与其溶液间的电势差不相等。锌原子比铜原子更容易失电子,锌片表面积累的电子比铜片表面积累的电子多,因此电子由锌片流向铜片。
Zn-2e- Zn2+
Cu2++2e- Cu
溶解-沉积平衡
电子的移动破坏了溶解-沉积平衡,锌极的平衡由于电子的移走而向溶解的方向移动,铜极的平衡由于电子移入而向沉积方向移动,结果使电子能够持续流动,形成电流。
二、改进装置,探究原理
Zn-2e- Zn2+
Cu2++2e- Cu
溶解-沉积平衡
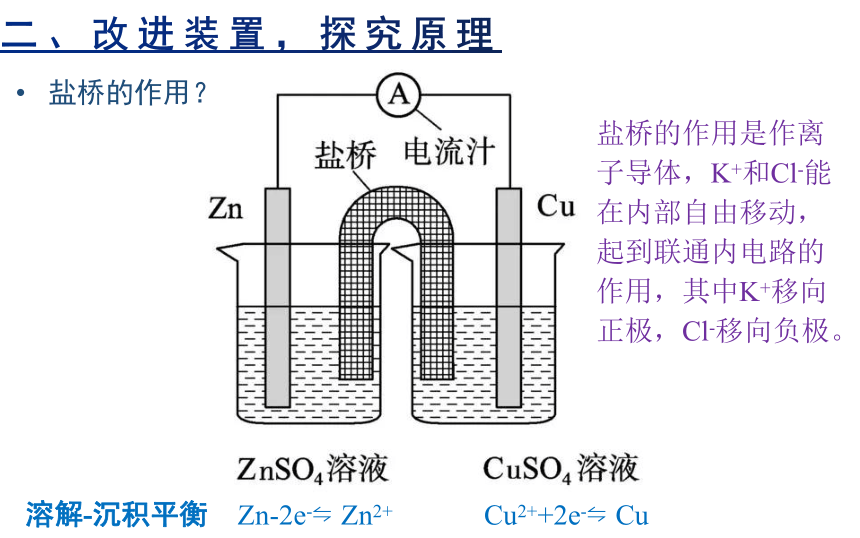
盐桥的作用是作离子导体,K+和Cl-能在内部自由移动,起到联通内电路的作用,其中K+移向正极,Cl-移向负极。
盐桥的作用?
二、改进装置,探究原理
还原产物
氧化剂
得电子
氧化产物
还原剂
失电子
原理维度
电极产物
过程
电极反应物
失电子场所
电子导体
得电子场所
装置维度
阳离子移向
阴离子移向
电子移动方向
离子导体
现象
归纳原电池的工作原理,分析原电池的基本构成要素,并图示。
二、改进装置,探究原理
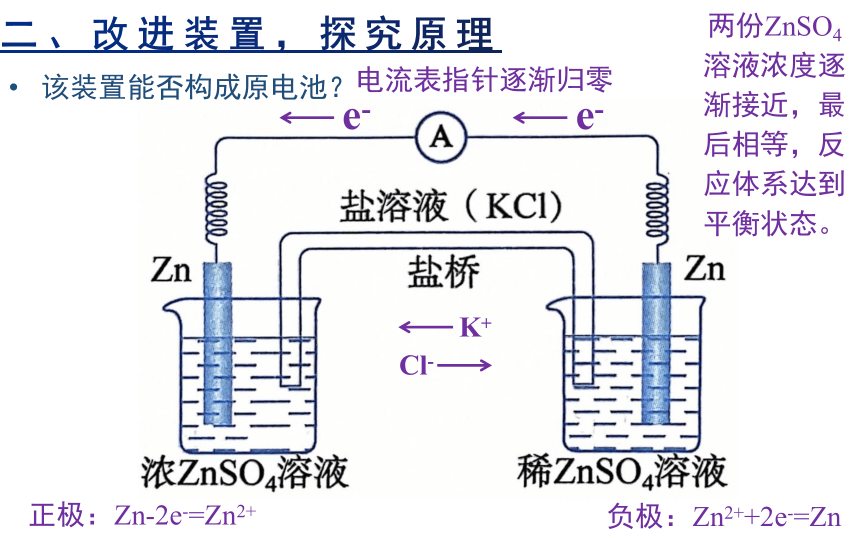
该装置能否构成原电池?
正极:Zn-2e-=Zn2+
负极:Zn2++2e-=Zn
K+
e-
Cl-
e-
两份ZnSO4溶液浓度逐渐接近,最后相等,反应体系达到平衡状态。
电流表指针逐渐归零
对于任一电池反应:aA+bB=cC+dD
E=E(标准)-(RT)/(nF)ln(([C]c·[D]d)/([A]a·[B]b)。这个方程就叫做能斯特(Nernst,W.H.1864~1941)方程。它指出了电池的电动势与电池本性(E)和电解质浓度之间的定量关系。
当温度为298K时,能斯特方程为:
E=E(标准)-(0.0257/n)ln(([C]c·[D]d)/([A]a·[B]b)。当温度为298K时,Cu-Zn原电池反应的能斯特方程为:
E=E(标准)-(0.0592/n)ln([Zn2+]/[Cu2+])
能斯特方程简介
二、改进装置,探究原理
根据测量电极与参比电极组成的工作电池在溶液中测得的电位差,并利用待测溶液的pH值与工作电池的电势大小之间的线性关系,再通过电流计转换成pH单位数值来实现测定。
浓差电池的应用简介(pH计原理)
二、改进装置,探究原理
三、应用模型,设计电池
真人模拟离子,乒乓球模拟电子,发生氧化还原反应
以反应2KI+2FeCl3=I2+2FeCl2+2KCl为切入点,分析反应本质,设计一个可持续供电的装置。
2I-+2Fe3+=I2+2Fe2+
2e-
I-
Fe3+
Cu丝
教师
学生
乒乓球
乒乓球
e-
e-
三、应用模型,设计电池
(1)选电子导体(铜丝导线和电极材料)
G
Cu
Cu
C
C
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
KI溶液
FeCl3溶液
三、应用模型,设计电池
(2)选离子导体:从微观角度分析上面实验的失败原因
Cu
Cu
C
C
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
KI溶液
FeCl3溶液
三、应用模型,设计电池
(2)选离子导体:从微观角度分析上面实验的失败原因
Cu
Cu
C
C
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
Cl-
K+
KI溶液
FeCl3溶液
高架“盐桥”
三、应用模型,设计电池
(2)选离子导体:从微观角度分析上面实验的失败原因
Cu
Cu
C
C
KI溶液
FeCl3溶液
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
Cl-
K+
地铁“盐桥”
三、应用模型,设计电池
(2)选离子导体:从微观角度分析上面实验的失败原因
Cu
Cu
C
C
KI溶液
FeCl3溶液
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
Cl-
K+
离子选择性透过膜
三、应用模型,设计电池
(3)实验验证
Cu
Cu
C
C
KI溶液
FeCl3溶液
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
Cl-
K+
负极
正极
离子选择性透过膜
溶液颜色变黄,取部分溶液滴入淀粉溶液,变为蓝色
取出部分溶液,滴入K3[Fe(CN)6]溶液,有特征蓝色沉淀产生
三、应用模型,设计电池
(1)拆分自发的氧化还原反应
负极:还原剂-ne-→氧化产物(氧化反应)
正极:氧化剂+ne-→还原产物(还原产物)
(2)确定两极的电极反应物和电极材料
(3)连接闭合回路
外电路(导线连接)电子:负极→正极
内电路(盐桥联通)阳离子→正极/阴离子→负极
原电池的设计思路及其形成条件
三、应用模型,设计电池
原电池工作原理
自发的氧化还原反应
氧化反应
氧化反应
电极反应
电极材料
离子导体
电子导体
化学能
电能
课堂小结
原电池的工作原理
(1)拆分自发的氧化还原反应
负极:还原剂-ne-→氧化产物(氧化反应)
正极:氧化剂+ne-→还原产物(还原产物)
(2)确定两极的电极反应物和电极材料
(3)连接闭合回路
外电路(导线连接)电子:负极→正极
内电路(盐桥联通)阳离子→正极/阴离子→负极
原电池的设计思路及其形成条件
课堂小结
原电池的工作原理
原电池工作原理
自发的氧化还原反应
氧化反应
氧化反应
电极反应
电极材料
离子导体
电子导体
化学能
电能
原电池的工作原理
第四章 化学反应与电能
第1节 原电池
一、温故设疑,引入新课
写出原电池中发生反应的离子方程式和电极反应式,并分析电子转移和离子迁移的方向。
总反应:Zn+2H+=Zn2++H2↑
负极:
Zn-2e-=Zn2+
正极:
2H++2e-=H2↑
外电路:e-→
内电路:
H+、Zn2+移向正极;
SO42-移向负极
一、温故设疑,引入新课
预测实验现象,说明理由。
观察现象。
CuSO4溶液
负极:
Zn-2e-=Zn2+
正极:
Cu2++2e-=Cu
总反应:Zn+Cu2+=Zn2++Cu
铜片表面有红色固体析出。
锌片表面也有较多红色固体析出
电流强度快速衰减
分析产生不同现象的原因。
二、改进装置,探究原理
CuSO4溶液
锌与硫酸铜溶液直接接触发生置换,局部形成原电池,导致更多铜离子被还原;
锌被铜覆盖接触面积减少,反应速率下降,向外输出的电流减弱。
如何改进上述装置,提高其能量转化率?
将氧化剂与还原剂分离,使转移的电子能够全部经过导线。
将氧化剂与还原剂分离,这样的装置还能工作吗?
二、改进装置,探究原理
2.简化的双电层理论
(1)金属浸入水溶液中,在水的作用下,金属离子会进入水中,溶液中的金属离子也可沉积到金属表面上,达到一种动态平衡。此时,金属与溶液的界面两侧电荷不均等,便会产生电势差。
1.盐桥中装有含有KCl饱和溶液的琼胶,离子可在其中自由移动。
装置的工作原理是什么?
Zn-2e- Zn2+
Cu2++2e- Cu
溶解-沉积平衡
二、改进装置,探究原理
两个电极材料与其溶液间的电势差不相等。锌原子比铜原子更容易失电子,锌片表面积累的电子比铜片表面积累的电子多,因此电子由锌片流向铜片。
Zn-2e- Zn2+
Cu2++2e- Cu
溶解-沉积平衡
电子的移动破坏了溶解-沉积平衡,锌极的平衡由于电子的移走而向溶解的方向移动,铜极的平衡由于电子移入而向沉积方向移动,结果使电子能够持续流动,形成电流。
二、改进装置,探究原理
Zn-2e- Zn2+
Cu2++2e- Cu
溶解-沉积平衡
盐桥的作用是作离子导体,K+和Cl-能在内部自由移动,起到联通内电路的作用,其中K+移向正极,Cl-移向负极。
盐桥的作用?
二、改进装置,探究原理
还原产物
氧化剂
得电子
氧化产物
还原剂
失电子
原理维度
电极产物
过程
电极反应物
失电子场所
电子导体
得电子场所
装置维度
阳离子移向
阴离子移向
电子移动方向
离子导体
现象
归纳原电池的工作原理,分析原电池的基本构成要素,并图示。
二、改进装置,探究原理
该装置能否构成原电池?
正极:Zn-2e-=Zn2+
负极:Zn2++2e-=Zn
K+
e-
Cl-
e-
两份ZnSO4溶液浓度逐渐接近,最后相等,反应体系达到平衡状态。
电流表指针逐渐归零
对于任一电池反应:aA+bB=cC+dD
E=E(标准)-(RT)/(nF)ln(([C]c·[D]d)/([A]a·[B]b)。这个方程就叫做能斯特(Nernst,W.H.1864~1941)方程。它指出了电池的电动势与电池本性(E)和电解质浓度之间的定量关系。
当温度为298K时,能斯特方程为:
E=E(标准)-(0.0257/n)ln(([C]c·[D]d)/([A]a·[B]b)。当温度为298K时,Cu-Zn原电池反应的能斯特方程为:
E=E(标准)-(0.0592/n)ln([Zn2+]/[Cu2+])
能斯特方程简介
二、改进装置,探究原理
根据测量电极与参比电极组成的工作电池在溶液中测得的电位差,并利用待测溶液的pH值与工作电池的电势大小之间的线性关系,再通过电流计转换成pH单位数值来实现测定。
浓差电池的应用简介(pH计原理)
二、改进装置,探究原理
三、应用模型,设计电池
真人模拟离子,乒乓球模拟电子,发生氧化还原反应
以反应2KI+2FeCl3=I2+2FeCl2+2KCl为切入点,分析反应本质,设计一个可持续供电的装置。
2I-+2Fe3+=I2+2Fe2+
2e-
I-
Fe3+
Cu丝
教师
学生
乒乓球
乒乓球
e-
e-
三、应用模型,设计电池
(1)选电子导体(铜丝导线和电极材料)
G
Cu
Cu
C
C
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
KI溶液
FeCl3溶液
三、应用模型,设计电池
(2)选离子导体:从微观角度分析上面实验的失败原因
Cu
Cu
C
C
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
KI溶液
FeCl3溶液
三、应用模型,设计电池
(2)选离子导体:从微观角度分析上面实验的失败原因
Cu
Cu
C
C
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
Cl-
K+
KI溶液
FeCl3溶液
高架“盐桥”
三、应用模型,设计电池
(2)选离子导体:从微观角度分析上面实验的失败原因
Cu
Cu
C
C
KI溶液
FeCl3溶液
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
Cl-
K+
地铁“盐桥”
三、应用模型,设计电池
(2)选离子导体:从微观角度分析上面实验的失败原因
Cu
Cu
C
C
KI溶液
FeCl3溶液
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
Cl-
K+
离子选择性透过膜
三、应用模型,设计电池
(3)实验验证
Cu
Cu
C
C
KI溶液
FeCl3溶液
I-
I-
I-
K+
K+
K+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Fe3+
Fe3+
—
—
—
—
G
Cl-
K+
负极
正极
离子选择性透过膜
溶液颜色变黄,取部分溶液滴入淀粉溶液,变为蓝色
取出部分溶液,滴入K3[Fe(CN)6]溶液,有特征蓝色沉淀产生
三、应用模型,设计电池
(1)拆分自发的氧化还原反应
负极:还原剂-ne-→氧化产物(氧化反应)
正极:氧化剂+ne-→还原产物(还原产物)
(2)确定两极的电极反应物和电极材料
(3)连接闭合回路
外电路(导线连接)电子:负极→正极
内电路(盐桥联通)阳离子→正极/阴离子→负极
原电池的设计思路及其形成条件
三、应用模型,设计电池
原电池工作原理
自发的氧化还原反应
氧化反应
氧化反应
电极反应
电极材料
离子导体
电子导体
化学能
电能
课堂小结
原电池的工作原理
(1)拆分自发的氧化还原反应
负极:还原剂-ne-→氧化产物(氧化反应)
正极:氧化剂+ne-→还原产物(还原产物)
(2)确定两极的电极反应物和电极材料
(3)连接闭合回路
外电路(导线连接)电子:负极→正极
内电路(盐桥联通)阳离子→正极/阴离子→负极
原电池的设计思路及其形成条件
课堂小结
原电池的工作原理
原电池工作原理
自发的氧化还原反应
氧化反应
氧化反应
电极反应
电极材料
离子导体
电子导体
化学能
电能
