化学人教版(2019)必修第一册 第四章复习(1)课件(共25张PPT)
文档属性
| 名称 | 化学人教版(2019)必修第一册 第四章复习(1)课件(共25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 806.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 12:20:35 | ||
图片预览






文档简介
(共25张PPT)
第四章· 原子结构 元素周期律
复 习 课
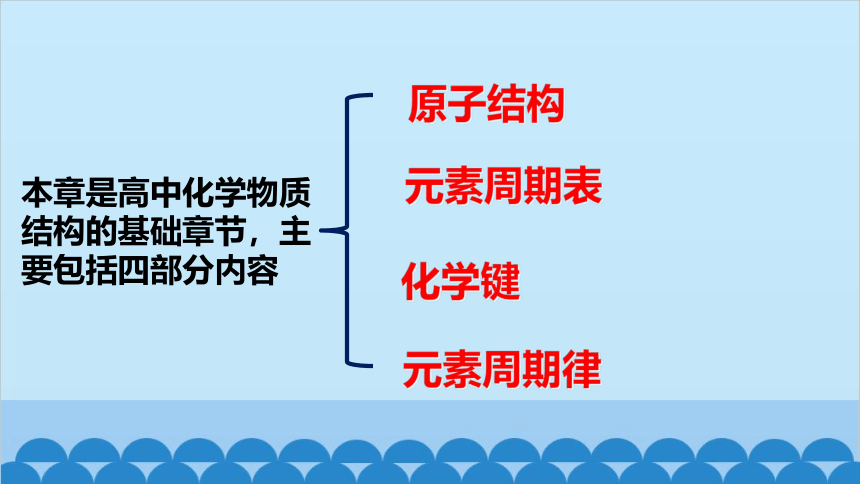
本章是高中化学物质结构的基础章节,主要包括四部分内容
原子结构
元素周期表
元素周期律
化学键
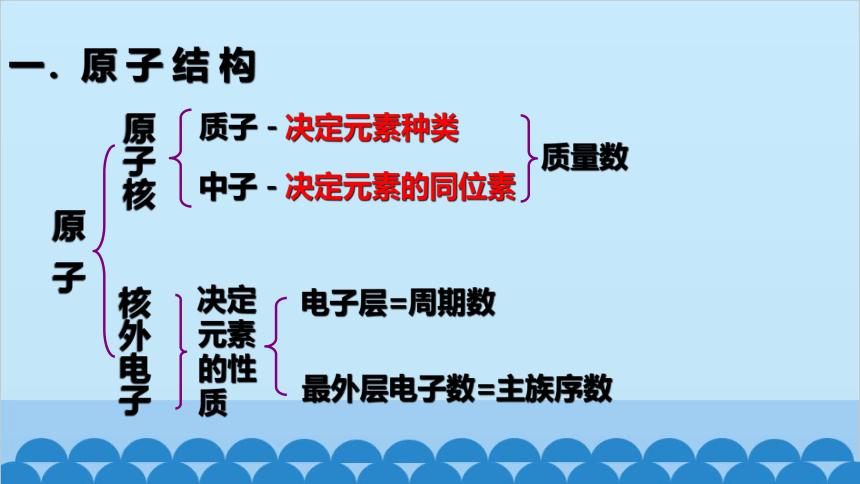
一.原 子 结 构
原 子
原子核
核外电子
电子层=周期数
中子-决定元素的同位素
质量数
决定元素的性质
质子-决定元素种类
最外层电子数=主族序数
原子组成表示式
质子有 个,中子有 个,核外电子有 个。
Z
A-Z
Z
质子数+中子数
核电荷数=核外电子数
相互关系:
(1) 质量数=
(2) 原子中:质子数=
(3) 阳离子中:
质子数=
(4) 阴离子中:
质子数=
核电荷数=离子的核外电子数+离子电荷数
A
Z X
核电荷数=离子的核外电子数-离子电荷数
符号:
电子层数:
能量:
离核距离:
1)每个电子层最多排2n2个电子
2)最外层 8个电子,次外层 18个电子
3)先排能量低的电子层,后排能量高的电子层
K L M N O P Q
1 2 3 4 5 6 7
低—————————高
近—————————远
核外电子排布规律
核外电子排布规律
理解元素、核素、同位素的概念:
具有相同核电荷数(质子数)的同一类原子
具有一定数目的质子和一定数目的中子的原子
质子数相同而中子数不同的同一元素的不同原子互称为同位素,也就是说,同一元素的不同核素之间互称为同位素。
元素:
核素:
同位素:
1、电荷数分别为16和6的元素的原子相比较,前者的下列数据是后者的4倍的是( )
A、电子数 B、最外层电子数
C、电子层数 D、次外层电子数
2、 11Na+中的质子数是 ,中子数是 ,核外电子数是 ,质量数是 。
3、 16S2-中的质子数是 ,中子数是 ,核外电子数是 ,质量数是 。
D
11
12
10
16 16
18
32
23
23
32
B
4、Se是人体必需微量元素,
下列有关 Se和 Se的说法正确的是
A、 Se和 Se互为同素异形体
B、 Se和 Se互为同位素
C、 Se和 Se 分别含有44和46个质子
D、 Se和 Se都含有34个中子
7834
8034
7834
8034
7834
8034
7834
8034
7834
8034
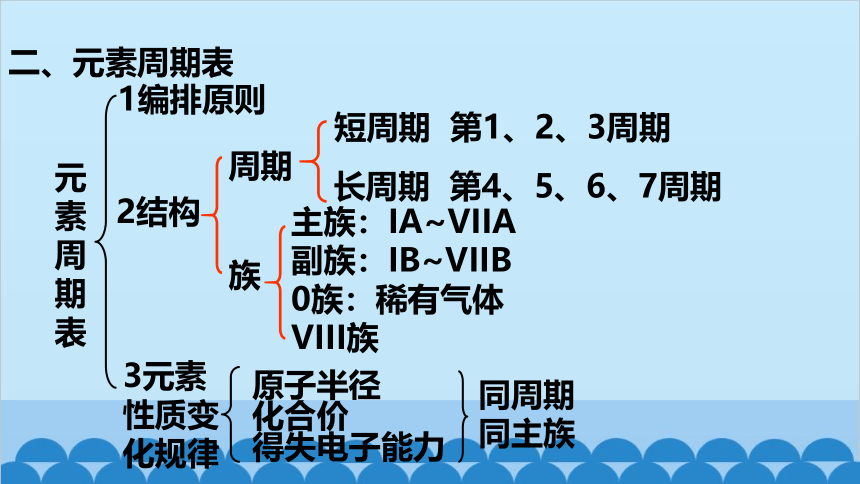
1编排原则
2结构
3元素性质变化规律
原子半径
化合价
得失电子能力
同周期
同主族
元素周期表
周期
族
短周期 第1、2、3周期
长周期 第4、5、6、7周期
主族:IA~VIIA
副族:IB~VIIB
0族:稀有气体
VIII族
二、元素周期表
电子层数=周期序数
最外层电子数=主族序数=最高正价数
最高正价数+最低负价的绝对值=8
周期表与原子结构的关系:
某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX B. H2X C. XH3 D. XH4
B
碱金属元素在化学性质上的规律
(1)相似性:均能与氧气、与水反应,表现出较强的金属性
(2)递变性:与氧气、与水反应的剧烈程度有所不同;在同一族中,自上而下反应的剧烈程度逐渐增大;
4Li + O2 ==== 2Li2O
2Na + O2 ==== Na2O2
2Na + 2H2O === 2NaOH + H2↑
2K + 2H2O === 2KOH + H2↑
△
△
碱金属元素在物理性质上的规律
结论:
(1)颜色、状态 ——
(2)密度 ——
(3)熔沸点 ——
大部分均为银白色固体,质软
逐渐增大(自上而下)
逐渐降低(自上而下)
Cs略带金黄色
K密度反常
卤族元素在化学性质上的规律
(1)相似性:均能与氢气反应,表现出非金属性,反应逐渐剧烈
(2)递变性:自上而下非金属性逐渐减弱
(1)颜色 ——
(2)状态 ——
(3)密度 ——
(4)熔沸点 ——
逐渐增大(自上而下)
逐渐升高(自上而下)
浅 深;
气 液 固;
F2到I2表现的物理性质:
三、元素周期律
1、概念:元素的性质随着原子序数的递增而呈周期性变化的规律
2、元素周期律的实质:元素原子结构周期性变化
3、变化规律:
(1)核外电子排布规律:
最外层电子数 。
1 →8
(2)原子半径变化规律:
同一周期从左到右,原子半径逐渐 。
同一主族从上到下,原子半径逐渐____ ___。
(不考虑稀有气体元素)
减小
增大
【练习】原子半径由大到小的是( )
A. Al,Mg,Na B. Li,Na,K
C. O2-,F-,Na+ D. H+,H,H-
【练习】某主族元素R的最高正化合价与负化合价代数和为6,下列叙述正确的是( )
A.R一定是第VIIA族元
B.R的最高价氧化物为RO3
C.R的气态氢化物能燃烧
D.R的气态氢化物易溶于水显碱性
C
A
金属性、非金属性强弱判断的事实依据
1.单质跟水或酸反应置换出氢气的难易程度;
2.最高价氧化物对应水化物(氢氧化物)的碱性强弱;
1.跟氢气反应的难易程度以及生成氢化物的稳定性;
2.最高价氧化物对应的水化物的酸性强弱;
金属性
非金属性
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
【练习】 A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A. A、B、C、D、E
B. E、C、D、B、A
C. B、A、D、C、E
D. C、D、A、B、E
C
四、化学键:
化学键
离子键 形成离子化合物
共价键
极性键
非极性键
物质中相邻的原子之间强烈的相互作用,称为化学键
离子键
带相反电荷的离子间形成的相互作用叫做离子键.
成键的微粒:
成键的本质(作用力):
静电作用(吸引和排斥)
阴离子、阳离子
离子化合物:
主要有活泼金属化合物和铵盐两大类
通过离子键而形成的化合物
离子化合物形成过程的表示—电子式
在元素符号周围用小黑点(或×)表示原子的最外层电子的式子
①原子的电子式
(原子的电子式) (化合物的电子式)
②阳离子的电子式
③阴离子的电子式
④离子化合物的电子式
非金属元素之间一般形成共价键。
原子间通过共用电子对而形成的化学键
共价键
极性键和非极性键:
据共用电子对是否发生偏移,把共价键分为极性共价键和非极性共价键。简称极性键和非极性键。
两个不同原子间的共价键都是极性键
两个相同的原子间的共价键都是非极性键
几种分子的电子式和结构式
H2
H2O
CH4
CO2
HCl
【练习】
⑴NaCl ⑵CO2 ⑶NaOH ⑷N2 ⑸NH3 ⑹MgO ⑺Na2O
⑻MgBr2 ⑼O2 ⑽Na2O2 ⑾H2O2 ⑿H2
判断以上微粒,只含离子键的是____________,只含极性共价键的是___________,只含非极性共价键的是_________,既含离子键又含极性共价键的是____,
既含离子键又含非极性共价键的是____.
⑴⑹⑺⑻
⑵⑸
⑷⑼⑿
⑶
⑽
人教版必修第一册
第四章· 原子结构 元素周期律
复 习 课
本章是高中化学物质结构的基础章节,主要包括四部分内容
原子结构
元素周期表
元素周期律
化学键
一.原 子 结 构
原 子
原子核
核外电子
电子层=周期数
中子-决定元素的同位素
质量数
决定元素的性质
质子-决定元素种类
最外层电子数=主族序数
原子组成表示式
质子有 个,中子有 个,核外电子有 个。
Z
A-Z
Z
质子数+中子数
核电荷数=核外电子数
相互关系:
(1) 质量数=
(2) 原子中:质子数=
(3) 阳离子中:
质子数=
(4) 阴离子中:
质子数=
核电荷数=离子的核外电子数+离子电荷数
A
Z X
核电荷数=离子的核外电子数-离子电荷数
符号:
电子层数:
能量:
离核距离:
1)每个电子层最多排2n2个电子
2)最外层 8个电子,次外层 18个电子
3)先排能量低的电子层,后排能量高的电子层
K L M N O P Q
1 2 3 4 5 6 7
低—————————高
近—————————远
核外电子排布规律
核外电子排布规律
理解元素、核素、同位素的概念:
具有相同核电荷数(质子数)的同一类原子
具有一定数目的质子和一定数目的中子的原子
质子数相同而中子数不同的同一元素的不同原子互称为同位素,也就是说,同一元素的不同核素之间互称为同位素。
元素:
核素:
同位素:
1、电荷数分别为16和6的元素的原子相比较,前者的下列数据是后者的4倍的是( )
A、电子数 B、最外层电子数
C、电子层数 D、次外层电子数
2、 11Na+中的质子数是 ,中子数是 ,核外电子数是 ,质量数是 。
3、 16S2-中的质子数是 ,中子数是 ,核外电子数是 ,质量数是 。
D
11
12
10
16 16
18
32
23
23
32
B
4、Se是人体必需微量元素,
下列有关 Se和 Se的说法正确的是
A、 Se和 Se互为同素异形体
B、 Se和 Se互为同位素
C、 Se和 Se 分别含有44和46个质子
D、 Se和 Se都含有34个中子
7834
8034
7834
8034
7834
8034
7834
8034
7834
8034
1编排原则
2结构
3元素性质变化规律
原子半径
化合价
得失电子能力
同周期
同主族
元素周期表
周期
族
短周期 第1、2、3周期
长周期 第4、5、6、7周期
主族:IA~VIIA
副族:IB~VIIB
0族:稀有气体
VIII族
二、元素周期表
电子层数=周期序数
最外层电子数=主族序数=最高正价数
最高正价数+最低负价的绝对值=8
周期表与原子结构的关系:
某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX B. H2X C. XH3 D. XH4
B
碱金属元素在化学性质上的规律
(1)相似性:均能与氧气、与水反应,表现出较强的金属性
(2)递变性:与氧气、与水反应的剧烈程度有所不同;在同一族中,自上而下反应的剧烈程度逐渐增大;
4Li + O2 ==== 2Li2O
2Na + O2 ==== Na2O2
2Na + 2H2O === 2NaOH + H2↑
2K + 2H2O === 2KOH + H2↑
△
△
碱金属元素在物理性质上的规律
结论:
(1)颜色、状态 ——
(2)密度 ——
(3)熔沸点 ——
大部分均为银白色固体,质软
逐渐增大(自上而下)
逐渐降低(自上而下)
Cs略带金黄色
K密度反常
卤族元素在化学性质上的规律
(1)相似性:均能与氢气反应,表现出非金属性,反应逐渐剧烈
(2)递变性:自上而下非金属性逐渐减弱
(1)颜色 ——
(2)状态 ——
(3)密度 ——
(4)熔沸点 ——
逐渐增大(自上而下)
逐渐升高(自上而下)
浅 深;
气 液 固;
F2到I2表现的物理性质:
三、元素周期律
1、概念:元素的性质随着原子序数的递增而呈周期性变化的规律
2、元素周期律的实质:元素原子结构周期性变化
3、变化规律:
(1)核外电子排布规律:
最外层电子数 。
1 →8
(2)原子半径变化规律:
同一周期从左到右,原子半径逐渐 。
同一主族从上到下,原子半径逐渐____ ___。
(不考虑稀有气体元素)
减小
增大
【练习】原子半径由大到小的是( )
A. Al,Mg,Na B. Li,Na,K
C. O2-,F-,Na+ D. H+,H,H-
【练习】某主族元素R的最高正化合价与负化合价代数和为6,下列叙述正确的是( )
A.R一定是第VIIA族元
B.R的最高价氧化物为RO3
C.R的气态氢化物能燃烧
D.R的气态氢化物易溶于水显碱性
C
A
金属性、非金属性强弱判断的事实依据
1.单质跟水或酸反应置换出氢气的难易程度;
2.最高价氧化物对应水化物(氢氧化物)的碱性强弱;
1.跟氢气反应的难易程度以及生成氢化物的稳定性;
2.最高价氧化物对应的水化物的酸性强弱;
金属性
非金属性
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
【练习】 A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )
A. A、B、C、D、E
B. E、C、D、B、A
C. B、A、D、C、E
D. C、D、A、B、E
C
四、化学键:
化学键
离子键 形成离子化合物
共价键
极性键
非极性键
物质中相邻的原子之间强烈的相互作用,称为化学键
离子键
带相反电荷的离子间形成的相互作用叫做离子键.
成键的微粒:
成键的本质(作用力):
静电作用(吸引和排斥)
阴离子、阳离子
离子化合物:
主要有活泼金属化合物和铵盐两大类
通过离子键而形成的化合物
离子化合物形成过程的表示—电子式
在元素符号周围用小黑点(或×)表示原子的最外层电子的式子
①原子的电子式
(原子的电子式) (化合物的电子式)
②阳离子的电子式
③阴离子的电子式
④离子化合物的电子式
非金属元素之间一般形成共价键。
原子间通过共用电子对而形成的化学键
共价键
极性键和非极性键:
据共用电子对是否发生偏移,把共价键分为极性共价键和非极性共价键。简称极性键和非极性键。
两个不同原子间的共价键都是极性键
两个相同的原子间的共价键都是非极性键
几种分子的电子式和结构式
H2
H2O
CH4
CO2
HCl
【练习】
⑴NaCl ⑵CO2 ⑶NaOH ⑷N2 ⑸NH3 ⑹MgO ⑺Na2O
⑻MgBr2 ⑼O2 ⑽Na2O2 ⑾H2O2 ⑿H2
判断以上微粒,只含离子键的是____________,只含极性共价键的是___________,只含非极性共价键的是_________,既含离子键又含极性共价键的是____,
既含离子键又含非极性共价键的是____.
⑴⑹⑺⑻
⑵⑸
⑷⑼⑿
⑶
⑽
人教版必修第一册
