1.3.1 认识氧化还原反应 课件(共30张PPT)-高一化学(人教版2019必修第一册)
文档属性
| 名称 | 1.3.1 认识氧化还原反应 课件(共30张PPT)-高一化学(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 14:25:23 | ||
图片预览







文档简介
(共30张PPT)
第一章 物质及其变化
第3节 氧化还原反应
第一课时 认识氧化还原反应
1.通过分析物质所含元素的化合价,认识氧化还原反应的特征,能够对常见的化学反应进行分类。
2.认识到氧化还原反应在生产生活中的普遍存在,能够运用氧化还原反应的有关理论解决有关问题。
3.能利用氧化还原反应概念判断物质的氧化性和还原性,归纳常见的氧化剂和还原剂。
学习目标
本节重难点
氧化还原反应的特征
氧化还原反应的本质
氧化剂和还原剂的概念
本节重点
本节难点
氧化还原反应的特征
氧化还原反应的本质
氧化还原反应相关概念之间的联系
用CO还原氧化铁的反应方程式?
如何利用这一物质来获得铁单质?
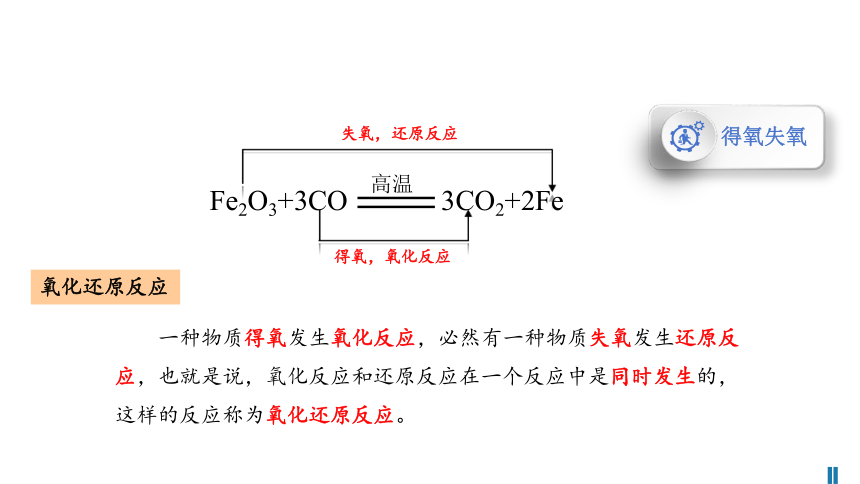
一种物质得氧发生氧化反应,必然有一种物质失氧发生还原反应,也就是说,氧化反应和还原反应在一个反应中是同时发生的,这样的反应称为氧化还原反应。
失氧,还原反应
得氧,氧化反应
Fe2O3+3CO 3CO2+2Fe
高温
氧化还原反应
得氧失氧
1774年
法国化学家拉瓦锡提出燃烧的氧化学说(即燃烧是物质与氧气的反应)后,人们把物质与氧结合的反应叫做氧化反应,把氧化物失去氧的反应叫做还原反应。
得氧失氧
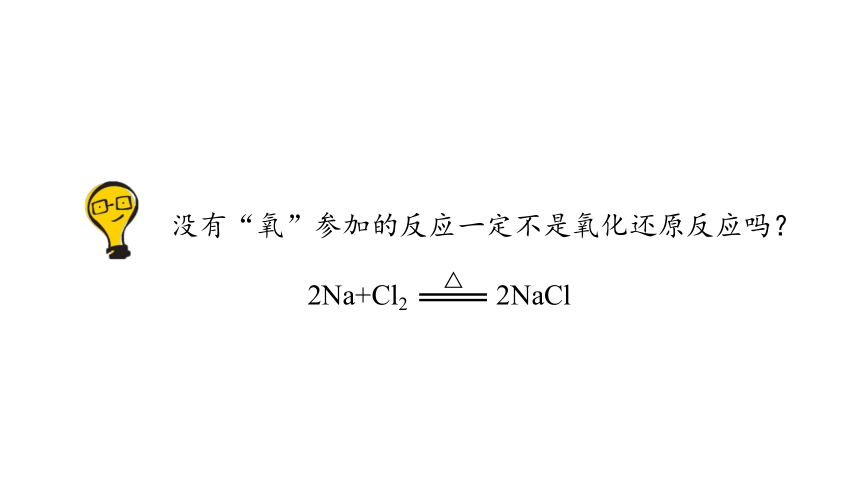
没有“氧”参加的反应一定不是氧化还原反应吗?
2Na+Cl2 2NaCl
△
一种物质得氧发生氧化反应,必然有一种物质失氧发生还原反应,也就是说,氧化反应和还原反应在一个反应中是同时发生的,这样的反应称为氧化还原反应。
氧化还原反应
从得氧失氧的角度认识氧化还原反应是片面的!
1852年
英国化学家弗兰克兰在研究金属有机化合物时提出化合价的概念,并逐步得到完善以后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
化合价升降
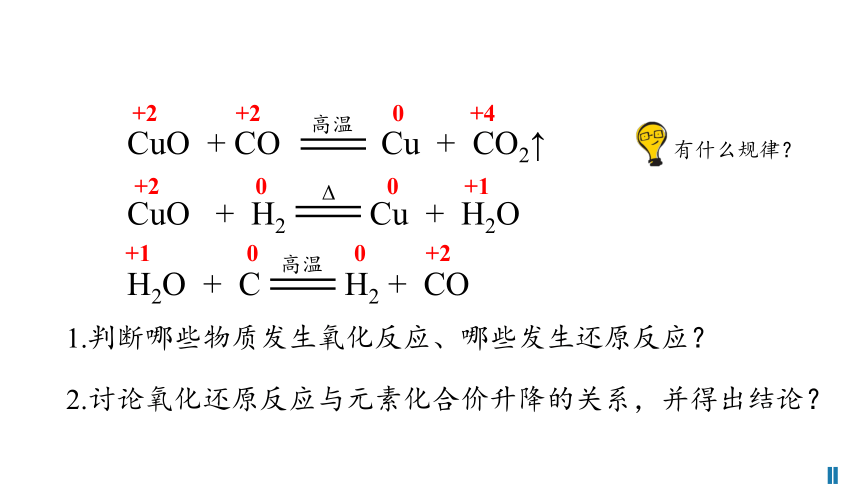
1.判断哪些物质发生氧化反应、哪些发生还原反应?
有什么规律?
CuO + H2 Cu + H2O
H2O + C H2 + CO
2.讨论氧化还原反应与元素化合价升降的关系,并得出结论?
CuO + CO Cu + CO2↑
高温
高温
Δ
+2 +2 0 +4
+2 0 0 +1
+1 0 0 +2
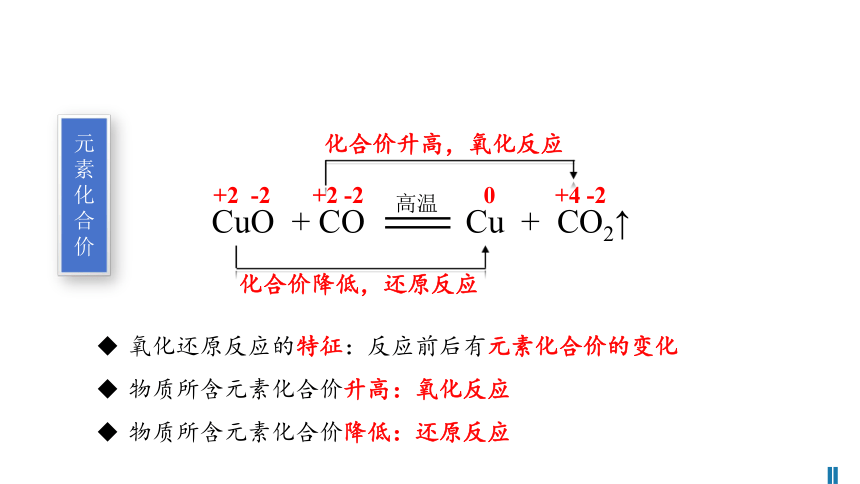
氧化还原反应的特征:反应前后有元素化合价的变化
物质所含元素化合价升高:氧化反应
物质所含元素化合价降低:还原反应
元素化合价
CuO + CO Cu + CO2↑
高温
+2 -2 +2 -2 0 +4 -2
化合价升高,氧化反应
化合价降低,还原反应
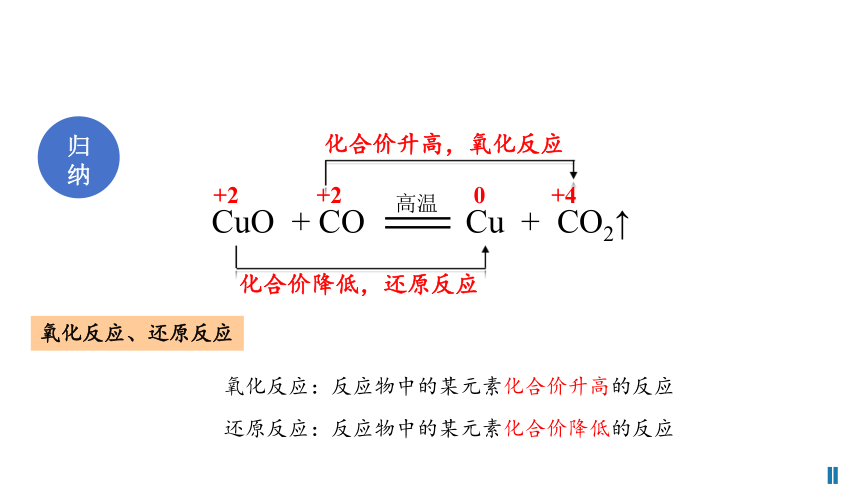
氧化反应、还原反应
氧化反应:反应物中的某元素化合价升高的反应
还原反应:反应物中的某元素化合价降低的反应
归纳
CuO + CO Cu + CO2↑
高温
+2 +2 0 +4
化合价升高,氧化反应
化合价降低,还原反应
氧化产物、还原产物
氧化产物:反应物中的某元素发生氧化反应所对应的生成物
还原产物:反应物中的某元素发生还原反应所对应的生成物
CuO + CO Cu + CO2↑
高温
+2 +2 0 +4
化合价升高,氧化反应
化合价降低,还原反应
氧化产物:CO2
还原产物:Cu
归纳
Fe + CuSO4 FeSO4 + Cu
0 +2 +2 0
下列反应是否为氧化还原反应?
Zn + 2HCl ZnCl2+ H2↑
0 +1 +2 0
哪些是氧化反应?哪些是还原反应?
哪些是氧化产物?哪些是还原产物?
归纳
氧化还原反应中有化合价变化的原因?
1897年
英国物理学家汤姆孙发现了电子,人们把化合价的升降与原子最外层电子的得失联系起来,将原子失去电子(或电子对偏离)的过程叫做氧化反应,把原子得到电子(或电子对偏向)的过程叫做还原反应。
电子转移
Na
Na+
-e-
Cl
Cl-
+e-
Na原子与Cl原子最外层电子如何变化?
电子得失
2Na+Cl2 2NaCl
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
△
共用电子对受到两个原子核的共同吸引,使双方最外电子层都达到稳定结构。由于氯原子对共用电子对的吸引力比氢原子的稍强一些,所以,共用电子对偏向于氯原子而偏离于氢原子。
H原子与Cl原子最外层电子如何变化?
电子偏移
H
Cl
H2+Cl2 2HCl
0
0
+1
-1
化合价升高,被氧化
化合价降低,被还原
点燃
氧化还原反应中一定存在着电子转移,有的是电子得失,有的是共用电子对偏移。
元素的原子失去电子(或电子对偏离),则元素的化合价升高,物质被氧化,发生氧化反应;
元素的原子得到电子(或电子对偏向),则元素的化合价降低,物质被还原,发生还原反应。
电子转移
本质
2Na+Cl2 2NaCl
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
△
H2+Cl2 2HCl
0
0
+1
-1
化合价升高,被氧化
化合价降低,被还原
点燃
结论
电子转移(得失或偏移)是元素化合价发生变化的原因,也是氧化还原反应的本质。
电子转移的表示方法——双线桥法、单线桥法
Fe + CuSO4 FeSO4 + Cu
失2e-,被氧化
得2e-,被还原
0
+2
+2
0
双线桥法
单线桥法
Fe + CuSO4 FeSO4 + Cu
0
+2
2e-
置换反应
复分解反应
分解反应
氧化还原反应
化合
反应
非氧化还原反应
氧化还原反应与四大基本反应类型的关系
所有置换反应均为氧化还原反应
所有复分解反应均为非氧化还原反应
?为什么
提示:氧化还原反应的特征是有元素化合价的变化
化合价升高
失去电子
(电子对偏离)
氧化反应
得到电子
(电子对偏向)
还原反应
反应物
化合价降低
被氧化
被还原
氧化产物
还原产物
生成物
升-失-氧-氧-氧
降-得-还-还-还
课堂小结
1774年
法国化学家拉瓦锡提出燃烧的氧化学说(即燃烧是物质与氧气的反应)后,人们把物质与氧结合的反应叫做氧化反应,把氧化物失去氧的反应叫做还原反应。
1852年
英国化学家弗兰克兰在研究金属有机化合物时提出化合价的概念,并逐步得到完善以后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
1897年
英国物理学家汤姆孙发现了电子,人们把化合价的升降与原子最外层电子的得失联系起来,将原子失去电子(或电子对偏离)的过程叫做氧化反应,把原子得到电子(或电子对偏向)的过程叫做还原反应。
得氧、失氧
化合价升降
电子转移
1.有关氧化还原反应的叙述中,正确的是( )
A. 反应中一定所有的元素化合价都发生变化
B. 失去电子的物质,所含元素化合价降低
C. 物质被氧化本身发生还原反应
D. 一定有电子的转移(得失或偏移)
D
课堂小练
2. 根据下列物质变化中化合价的情况,
判断属于还原反应的是 ( )
A. CuO → Cu B. NaCl → HCl
C. C → CO2 D. FeCl2 → FeCl3
A
课堂小练
C
课堂小练
3.古诗词是古人为我们留下的宝贵精神财富。下列诗句中不涉及氧化还原反应的( )
A.野火烧不尽,春风吹又生
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.明月松间照,清泉石上流
D.爆竹声中一岁除,春风送暖入屠苏
4. 下列化学反应中,不属于氧化还原反应的是( )
A.Na2O+CO2===Na2CO3
B.Fe+CuSO4===Cu+FeSO4
C.Fe2O3+3CO ====2Fe+3CO2
D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2O
A
课堂小练
高温
汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成N2和CO2。(教材p24)
Q1:书写化学方程式。
Q2:该反应是否为氧化还原反应?如果是,用双线桥法标出电子转移方向和数目。
探究活动
下节课见!
第一章 物质及其变化
第3节 氧化还原反应
第一课时 认识氧化还原反应
1.通过分析物质所含元素的化合价,认识氧化还原反应的特征,能够对常见的化学反应进行分类。
2.认识到氧化还原反应在生产生活中的普遍存在,能够运用氧化还原反应的有关理论解决有关问题。
3.能利用氧化还原反应概念判断物质的氧化性和还原性,归纳常见的氧化剂和还原剂。
学习目标
本节重难点
氧化还原反应的特征
氧化还原反应的本质
氧化剂和还原剂的概念
本节重点
本节难点
氧化还原反应的特征
氧化还原反应的本质
氧化还原反应相关概念之间的联系
用CO还原氧化铁的反应方程式?
如何利用这一物质来获得铁单质?
一种物质得氧发生氧化反应,必然有一种物质失氧发生还原反应,也就是说,氧化反应和还原反应在一个反应中是同时发生的,这样的反应称为氧化还原反应。
失氧,还原反应
得氧,氧化反应
Fe2O3+3CO 3CO2+2Fe
高温
氧化还原反应
得氧失氧
1774年
法国化学家拉瓦锡提出燃烧的氧化学说(即燃烧是物质与氧气的反应)后,人们把物质与氧结合的反应叫做氧化反应,把氧化物失去氧的反应叫做还原反应。
得氧失氧
没有“氧”参加的反应一定不是氧化还原反应吗?
2Na+Cl2 2NaCl
△
一种物质得氧发生氧化反应,必然有一种物质失氧发生还原反应,也就是说,氧化反应和还原反应在一个反应中是同时发生的,这样的反应称为氧化还原反应。
氧化还原反应
从得氧失氧的角度认识氧化还原反应是片面的!
1852年
英国化学家弗兰克兰在研究金属有机化合物时提出化合价的概念,并逐步得到完善以后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
化合价升降
1.判断哪些物质发生氧化反应、哪些发生还原反应?
有什么规律?
CuO + H2 Cu + H2O
H2O + C H2 + CO
2.讨论氧化还原反应与元素化合价升降的关系,并得出结论?
CuO + CO Cu + CO2↑
高温
高温
Δ
+2 +2 0 +4
+2 0 0 +1
+1 0 0 +2
氧化还原反应的特征:反应前后有元素化合价的变化
物质所含元素化合价升高:氧化反应
物质所含元素化合价降低:还原反应
元素化合价
CuO + CO Cu + CO2↑
高温
+2 -2 +2 -2 0 +4 -2
化合价升高,氧化反应
化合价降低,还原反应
氧化反应、还原反应
氧化反应:反应物中的某元素化合价升高的反应
还原反应:反应物中的某元素化合价降低的反应
归纳
CuO + CO Cu + CO2↑
高温
+2 +2 0 +4
化合价升高,氧化反应
化合价降低,还原反应
氧化产物、还原产物
氧化产物:反应物中的某元素发生氧化反应所对应的生成物
还原产物:反应物中的某元素发生还原反应所对应的生成物
CuO + CO Cu + CO2↑
高温
+2 +2 0 +4
化合价升高,氧化反应
化合价降低,还原反应
氧化产物:CO2
还原产物:Cu
归纳
Fe + CuSO4 FeSO4 + Cu
0 +2 +2 0
下列反应是否为氧化还原反应?
Zn + 2HCl ZnCl2+ H2↑
0 +1 +2 0
哪些是氧化反应?哪些是还原反应?
哪些是氧化产物?哪些是还原产物?
归纳
氧化还原反应中有化合价变化的原因?
1897年
英国物理学家汤姆孙发现了电子,人们把化合价的升降与原子最外层电子的得失联系起来,将原子失去电子(或电子对偏离)的过程叫做氧化反应,把原子得到电子(或电子对偏向)的过程叫做还原反应。
电子转移
Na
Na+
-e-
Cl
Cl-
+e-
Na原子与Cl原子最外层电子如何变化?
电子得失
2Na+Cl2 2NaCl
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
△
共用电子对受到两个原子核的共同吸引,使双方最外电子层都达到稳定结构。由于氯原子对共用电子对的吸引力比氢原子的稍强一些,所以,共用电子对偏向于氯原子而偏离于氢原子。
H原子与Cl原子最外层电子如何变化?
电子偏移
H
Cl
H2+Cl2 2HCl
0
0
+1
-1
化合价升高,被氧化
化合价降低,被还原
点燃
氧化还原反应中一定存在着电子转移,有的是电子得失,有的是共用电子对偏移。
元素的原子失去电子(或电子对偏离),则元素的化合价升高,物质被氧化,发生氧化反应;
元素的原子得到电子(或电子对偏向),则元素的化合价降低,物质被还原,发生还原反应。
电子转移
本质
2Na+Cl2 2NaCl
0
0
+1
-1
失去2e-,化合价升高,被氧化
得到2e-,化合价降低,被还原
△
H2+Cl2 2HCl
0
0
+1
-1
化合价升高,被氧化
化合价降低,被还原
点燃
结论
电子转移(得失或偏移)是元素化合价发生变化的原因,也是氧化还原反应的本质。
电子转移的表示方法——双线桥法、单线桥法
Fe + CuSO4 FeSO4 + Cu
失2e-,被氧化
得2e-,被还原
0
+2
+2
0
双线桥法
单线桥法
Fe + CuSO4 FeSO4 + Cu
0
+2
2e-
置换反应
复分解反应
分解反应
氧化还原反应
化合
反应
非氧化还原反应
氧化还原反应与四大基本反应类型的关系
所有置换反应均为氧化还原反应
所有复分解反应均为非氧化还原反应
?为什么
提示:氧化还原反应的特征是有元素化合价的变化
化合价升高
失去电子
(电子对偏离)
氧化反应
得到电子
(电子对偏向)
还原反应
反应物
化合价降低
被氧化
被还原
氧化产物
还原产物
生成物
升-失-氧-氧-氧
降-得-还-还-还
课堂小结
1774年
法国化学家拉瓦锡提出燃烧的氧化学说(即燃烧是物质与氧气的反应)后,人们把物质与氧结合的反应叫做氧化反应,把氧化物失去氧的反应叫做还原反应。
1852年
英国化学家弗兰克兰在研究金属有机化合物时提出化合价的概念,并逐步得到完善以后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应。
1897年
英国物理学家汤姆孙发现了电子,人们把化合价的升降与原子最外层电子的得失联系起来,将原子失去电子(或电子对偏离)的过程叫做氧化反应,把原子得到电子(或电子对偏向)的过程叫做还原反应。
得氧、失氧
化合价升降
电子转移
1.有关氧化还原反应的叙述中,正确的是( )
A. 反应中一定所有的元素化合价都发生变化
B. 失去电子的物质,所含元素化合价降低
C. 物质被氧化本身发生还原反应
D. 一定有电子的转移(得失或偏移)
D
课堂小练
2. 根据下列物质变化中化合价的情况,
判断属于还原反应的是 ( )
A. CuO → Cu B. NaCl → HCl
C. C → CO2 D. FeCl2 → FeCl3
A
课堂小练
C
课堂小练
3.古诗词是古人为我们留下的宝贵精神财富。下列诗句中不涉及氧化还原反应的( )
A.野火烧不尽,春风吹又生
B.春蚕到死丝方尽,蜡炬成灰泪始干
C.明月松间照,清泉石上流
D.爆竹声中一岁除,春风送暖入屠苏
4. 下列化学反应中,不属于氧化还原反应的是( )
A.Na2O+CO2===Na2CO3
B.Fe+CuSO4===Cu+FeSO4
C.Fe2O3+3CO ====2Fe+3CO2
D.2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2O
A
课堂小练
高温
汽车尾气系统中均安装了催化转化器。在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成N2和CO2。(教材p24)
Q1:书写化学方程式。
Q2:该反应是否为氧化还原反应?如果是,用双线桥法标出电子转移方向和数目。
探究活动
下节课见!
