2.2.5 化学平衡图像 课件(共22张PPT)-高二化学人教版选择性必修1课件
文档属性
| 名称 | 2.2.5 化学平衡图像 课件(共22张PPT)-高二化学人教版选择性必修1课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 983.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 21:09:05 | ||
图片预览






文档简介
(共22张PPT)
第二章
化学反应速率与化学平衡
第二节
化学平衡
第 5课时
化学平衡图像
教 学 目 标
核 心 素 养
1.通过对四种常见的化学平衡图像进行分析,理解化学平衡图像的意义。
2.掌握化学平衡图像题的一般解题方法。
通过图像分析,加深对反应速率、平衡移动的理解,培养学生的信息综合加工能力。
提出问题
1.你能通过分析下列图像,判断 平衡的移动吗?
2NO2(g) N2O4(g)
快速推动至10 mL处
压强 p1 =2p0
快速拉动至20 mL处
压强 p2 = p1
20 mL NO2(g)
压强 p0
一、化学平衡图像
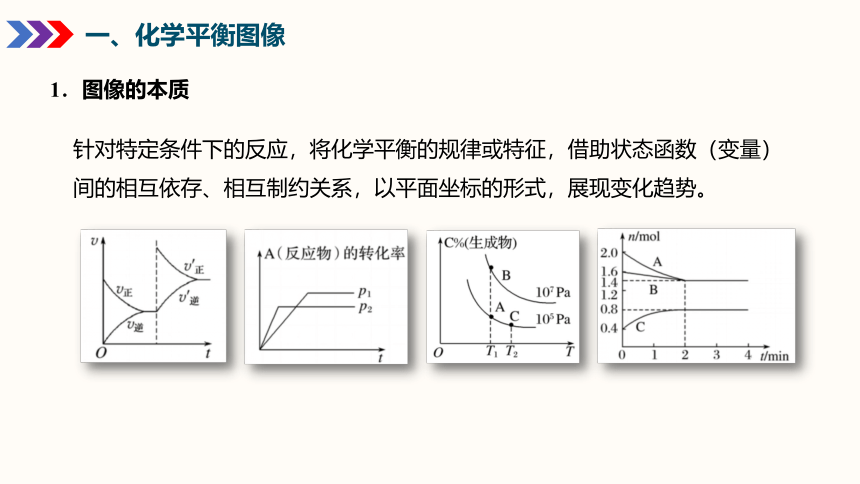
1.图像的本质
针对特定条件下的反应,将化学平衡的规律或特征,借助状态函数(变量)间的相互依存、相互制约关系,以平面坐标的形式,展现变化趋势。
2.读图方法
(5)五看量的变化,如浓度、温度、转化率、物质的量斜率的变化等。
(1)一看轴,明确横坐标和纵坐标的意义。
(2)二看点,关注一些特殊点(如起点、拐点、交点、终点、最高点)的意义。
(3)三看线,观察图像中线的走向和变化趋势。
(4)四作辅助线,分析图像斜率的大小。
一、化学平衡图像
3.解题技巧
(1)想规律:依据图像信息,利用平衡移动原理,分析可逆反应的特征。
(2作判断:定一议二、先拐先平,温高压大。
一、化学平衡图像
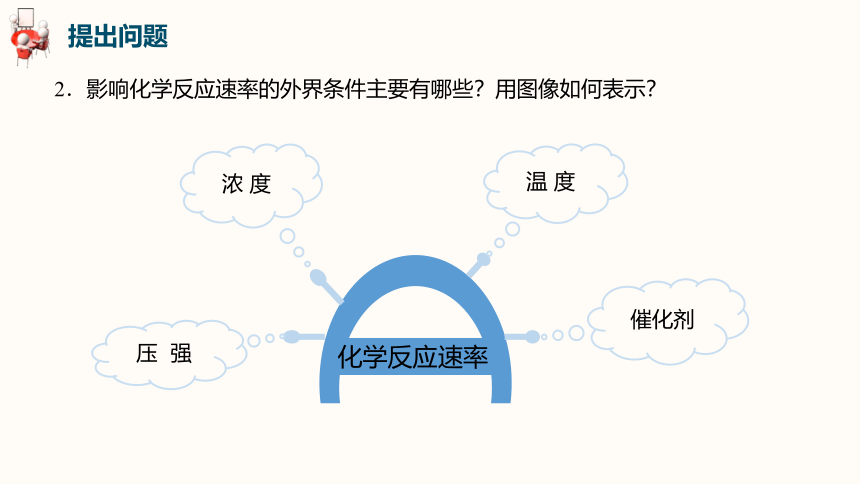
2.影响化学反应速率的外界条件主要有哪些?用图像如何表示?
浓 度
压 强
温 度
催化剂
化学反应速率
提出问题
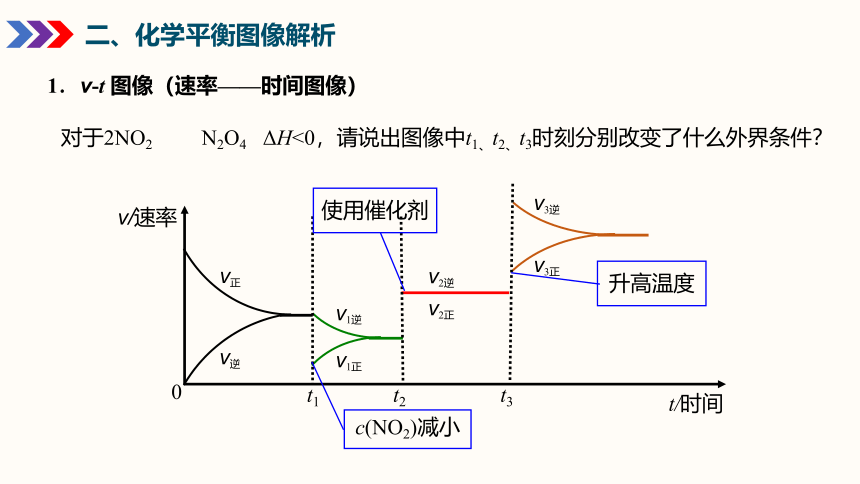
1.v-t 图像(速率——时间图像)
t/时间
v/速率
v正
v逆
v1逆
v1正
0
v2逆
v2正
t1 t2 t3
v3逆
v3正
对于2NO2 N2O4 ΔH<0,请说出图像中t1、t2、t3时刻分别改变了什么外界条件?
c(NO2)减小
使用催化剂
升高温度
二、化学平衡图像解析
③若两个都发生了“突变”且仍然相等,则为加入催化剂或等体积反应改变压强。
(1)根据改变条件的那一时刻v′正、v′逆的变化,判断改变的哪种外界条件。
(2)根据v′正、v′逆的相对大小,判断平衡移动方向。
①若v′正或v′逆有一个发生了“突变”,则为改变的浓度;
②若两个都发生了“突变”,则为改变的温度或压强;
方法总结
1.v-t 图像(速率——时间图像)
例1.对于反应aA(g)+bB(g) cC(g)+dD(g) ,a+b > c+d。若t2时刻增大压强,请画出速率时间图像。
t
v
v正
v逆
v正=v逆
0
v’正
v’ '逆
v’正=v’逆
t1
t2
t3
深度思考
2.c (n)-t 图像[浓度(物质的量)——时间图像]
例2.某温度时,在2 L容器中,x、y、z三种物质随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式是_____________,反应开始至2 min,z的平均速率是___________________。
1 2 3 4 5
0.2
0
1.0
0.4
0.6
0.8
0.2
0.7
0.9
y
x
z
时间/min
物质的量/
mol
0.1
0.3
0.2
3x+y 2z
0.05 mol ·L-1·min-1
二、化学平衡图像解析
2.c-t 图(浓度——时间图像)
得出方程式中化学计量数
反应速率之比
=化学计量数之比
=各物质的转化量之比
跟据起始量和平衡量求出转化量
方法总结
例3.研究下列图像,分析 的焓变特点、判断计量数m+n和p+q的大小关系。
3.α(或百分含量) –p(或T) – t 图像
m+n = p+q
m+n < p+q
“先拐先平数值大”
mA(g)+nB(g) pC(g)+qD(g)
p2>p1
T2>T1
va>vb
ΔH<0
升温,平衡逆向移动
加压,平衡逆向移动
v增大,平衡不移动
或使用催化剂
二、化学平衡图像解析
加入催化剂或等体积反应改变压强(如图Ⅲ)。
(1)“先拐先平数值大”。在化学平衡图像中,先出现拐点的反应则先达到平衡。
先出现拐点的曲线证明反应速率大
压强较大(如图Ⅱ中p2>p1);
温度较高(如图Ⅰ中T2>T1) ;
(2)正确掌握图像中反应规律的判断方法
方法总结
3.α(或百分含量) –p(或T) – t 图像
例4.下图是在其它条件一定时,反应2NO+O2 2NO2 ΔH<0 中NO 的最大转化率与温度的关系曲线。图中坐标1、2 、3、4四点,其中表示未达平衡状态且
v正>v逆的点是 。
平衡状态
温度不变,由1→平衡时, α(NO)减小,平衡逆向移动,v逆>v正。
温度不变,由3→平衡时, α(NO)增大,平衡正向移动,v正>v逆。
3
4.α(或百分含量) –p – T 图像
二、化学平衡图像解析
例5.研究下列图像,根据 2A+B 2C ΔH<0判断p1、p2和T1、T2的大小关系。
● a
● b
T1
T2
“先拐先平数值大”
等压线
等温线
图Ⅰ:a→b,温度一定,c减小, 平衡逆移,正向为体积缩小的反应,压强: p2> p1。
图Ⅱ:①②温度一定,压强: p2> p1;②③压强一定,温度: T1> T2 。
②
①
③
“定一议二”
深度思考
● c
(1)分析图像中纵坐标、横坐标和曲线所表示的三个量。
“定一议二”
(2)先确定其中一个量,再讨论其余两个量的关系––––“定一议二”。
方法总结
4.α(或百分含量) –p – T 图像
例6.研究下列图像,分析 的焓变特点、判断计量数m+n和p+q的大小关系。
mA(g)+nB(g) pC(g)+qD(g)
C%
450℃
P
A%
P1
★
正反应放热
★
m+n图像中某一条件对平衡的影响只能向一个方向移动,所以最高点(最低点)及以后为平衡状态受条件影响的情况,前面为未达到平衡的情况。
平衡状态
深度思考
T
化学平衡图像题
看图像:①面 ②线 ③点 ④量变 ⑤是否作辅助线
想规律:①浓度 ②压强 ③温度 ④催化剂
作判断:①先“拐”先“平” ②定“一”议“二”
课堂小结
1.符合图1、图2的反应是 ( )
B
“先拐先平数值大”
T2>T1
升温,平衡向吸热方向移动,产物减少,逆反应吸热。
反应速率之比
=化学计量数之比
=各物质的转化量之比
Δc(X)=1 mol·L-1
Δc(Y)=3 mol·L-1
Δc(Z)=2 mol·L-1
v(X)∶v(Y)∶v(Z)=1∶3∶2
随堂练习
2.下面的各图中,表示2A(g)+B(g) 2C(g)(正反应放热)这个可逆反应的正确图像为 ( )
√
升温,平衡向吸热(逆反应)方向移动,产物减少,反应物的含量增大,反应物的转化率减小,A正确,D错误。
×
增大压强,由于反应的两边都是气态物质,正反应和逆反应的速率都增大,B错误。
×
催化剂能加快反应速率,不能使平衡移动,平衡时,各组分的浓度及体积分数应该不变,C错误。
×
A
随堂练习
本节内容结束
第二章
化学反应速率与化学平衡
第二节
化学平衡
第 5课时
化学平衡图像
教 学 目 标
核 心 素 养
1.通过对四种常见的化学平衡图像进行分析,理解化学平衡图像的意义。
2.掌握化学平衡图像题的一般解题方法。
通过图像分析,加深对反应速率、平衡移动的理解,培养学生的信息综合加工能力。
提出问题
1.你能通过分析下列图像,判断 平衡的移动吗?
2NO2(g) N2O4(g)
快速推动至10 mL处
压强 p1 =2p0
快速拉动至20 mL处
压强 p2 = p1
20 mL NO2(g)
压强 p0
一、化学平衡图像
1.图像的本质
针对特定条件下的反应,将化学平衡的规律或特征,借助状态函数(变量)间的相互依存、相互制约关系,以平面坐标的形式,展现变化趋势。
2.读图方法
(5)五看量的变化,如浓度、温度、转化率、物质的量斜率的变化等。
(1)一看轴,明确横坐标和纵坐标的意义。
(2)二看点,关注一些特殊点(如起点、拐点、交点、终点、最高点)的意义。
(3)三看线,观察图像中线的走向和变化趋势。
(4)四作辅助线,分析图像斜率的大小。
一、化学平衡图像
3.解题技巧
(1)想规律:依据图像信息,利用平衡移动原理,分析可逆反应的特征。
(2作判断:定一议二、先拐先平,温高压大。
一、化学平衡图像
2.影响化学反应速率的外界条件主要有哪些?用图像如何表示?
浓 度
压 强
温 度
催化剂
化学反应速率
提出问题
1.v-t 图像(速率——时间图像)
t/时间
v/速率
v正
v逆
v1逆
v1正
0
v2逆
v2正
t1 t2 t3
v3逆
v3正
对于2NO2 N2O4 ΔH<0,请说出图像中t1、t2、t3时刻分别改变了什么外界条件?
c(NO2)减小
使用催化剂
升高温度
二、化学平衡图像解析
③若两个都发生了“突变”且仍然相等,则为加入催化剂或等体积反应改变压强。
(1)根据改变条件的那一时刻v′正、v′逆的变化,判断改变的哪种外界条件。
(2)根据v′正、v′逆的相对大小,判断平衡移动方向。
①若v′正或v′逆有一个发生了“突变”,则为改变的浓度;
②若两个都发生了“突变”,则为改变的温度或压强;
方法总结
1.v-t 图像(速率——时间图像)
例1.对于反应aA(g)+bB(g) cC(g)+dD(g) ,a+b > c+d。若t2时刻增大压强,请画出速率时间图像。
t
v
v正
v逆
v正=v逆
0
v’正
v’ '逆
v’正=v’逆
t1
t2
t3
深度思考
2.c (n)-t 图像[浓度(物质的量)——时间图像]
例2.某温度时,在2 L容器中,x、y、z三种物质随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式是_____________,反应开始至2 min,z的平均速率是___________________。
1 2 3 4 5
0.2
0
1.0
0.4
0.6
0.8
0.2
0.7
0.9
y
x
z
时间/min
物质的量/
mol
0.1
0.3
0.2
3x+y 2z
0.05 mol ·L-1·min-1
二、化学平衡图像解析
2.c-t 图(浓度——时间图像)
得出方程式中化学计量数
反应速率之比
=化学计量数之比
=各物质的转化量之比
跟据起始量和平衡量求出转化量
方法总结
例3.研究下列图像,分析 的焓变特点、判断计量数m+n和p+q的大小关系。
3.α(或百分含量) –p(或T) – t 图像
m+n = p+q
m+n < p+q
“先拐先平数值大”
mA(g)+nB(g) pC(g)+qD(g)
p2>p1
T2>T1
va>vb
ΔH<0
升温,平衡逆向移动
加压,平衡逆向移动
v增大,平衡不移动
或使用催化剂
二、化学平衡图像解析
加入催化剂或等体积反应改变压强(如图Ⅲ)。
(1)“先拐先平数值大”。在化学平衡图像中,先出现拐点的反应则先达到平衡。
先出现拐点的曲线证明反应速率大
压强较大(如图Ⅱ中p2>p1);
温度较高(如图Ⅰ中T2>T1) ;
(2)正确掌握图像中反应规律的判断方法
方法总结
3.α(或百分含量) –p(或T) – t 图像
例4.下图是在其它条件一定时,反应2NO+O2 2NO2 ΔH<0 中NO 的最大转化率与温度的关系曲线。图中坐标1、2 、3、4四点,其中表示未达平衡状态且
v正>v逆的点是 。
平衡状态
温度不变,由1→平衡时, α(NO)减小,平衡逆向移动,v逆>v正。
温度不变,由3→平衡时, α(NO)增大,平衡正向移动,v正>v逆。
3
4.α(或百分含量) –p – T 图像
二、化学平衡图像解析
例5.研究下列图像,根据 2A+B 2C ΔH<0判断p1、p2和T1、T2的大小关系。
● a
● b
T1
T2
“先拐先平数值大”
等压线
等温线
图Ⅰ:a→b,温度一定,c减小, 平衡逆移,正向为体积缩小的反应,压强: p2> p1。
图Ⅱ:①②温度一定,压强: p2> p1;②③压强一定,温度: T1> T2 。
②
①
③
“定一议二”
深度思考
● c
(1)分析图像中纵坐标、横坐标和曲线所表示的三个量。
“定一议二”
(2)先确定其中一个量,再讨论其余两个量的关系––––“定一议二”。
方法总结
4.α(或百分含量) –p – T 图像
例6.研究下列图像,分析 的焓变特点、判断计量数m+n和p+q的大小关系。
mA(g)+nB(g) pC(g)+qD(g)
C%
450℃
P
A%
P1
★
正反应放热
★
m+n
平衡状态
深度思考
T
化学平衡图像题
看图像:①面 ②线 ③点 ④量变 ⑤是否作辅助线
想规律:①浓度 ②压强 ③温度 ④催化剂
作判断:①先“拐”先“平” ②定“一”议“二”
课堂小结
1.符合图1、图2的反应是 ( )
B
“先拐先平数值大”
T2>T1
升温,平衡向吸热方向移动,产物减少,逆反应吸热。
反应速率之比
=化学计量数之比
=各物质的转化量之比
Δc(X)=1 mol·L-1
Δc(Y)=3 mol·L-1
Δc(Z)=2 mol·L-1
v(X)∶v(Y)∶v(Z)=1∶3∶2
随堂练习
2.下面的各图中,表示2A(g)+B(g) 2C(g)(正反应放热)这个可逆反应的正确图像为 ( )
√
升温,平衡向吸热(逆反应)方向移动,产物减少,反应物的含量增大,反应物的转化率减小,A正确,D错误。
×
增大压强,由于反应的两边都是气态物质,正反应和逆反应的速率都增大,B错误。
×
催化剂能加快反应速率,不能使平衡移动,平衡时,各组分的浓度及体积分数应该不变,C错误。
×
A
随堂练习
本节内容结束
