2.4 化学反应的调控 课件(共28张PPT)-高二化学人教版选择性必修1课件
文档属性
| 名称 | 2.4 化学反应的调控 课件(共28张PPT)-高二化学人教版选择性必修1课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 21:09:37 | ||
图片预览







文档简介
(共28张PPT)
第四节 化学反应的调控
第二章 化学反应速率与化学平衡
民以食为天。人类从诞生到1 900年,几百万年时间,人口只有16亿,而1908年合成氨工业化至现在100多年时间,人口增加到超过76亿,合成氨是起了巨大的作用的。合成氨,诞生了化学肥料,使土地的粮食产量翻了几番,地球才能养活这么多人口,这其中的意义是无法用语言来表达的。
工业合成氨
氨除了作为肥料,也是生产硝酸、各种含氮的无机盐及有机中间体、磺胺药、聚氨酯、聚酰胺纤维和丁腈橡胶等的原料,在国民经济中占有重要地位。合成氨工业诞生以后,各种炸药都是以氨为原料合成的,在人类两次最大规模的战争——一战和二战中成为杀人的利器。
粮食增产
工业合成氨
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:ΔH<0,熵变:ΔS<0。
(4)自发性:常温(298 K)下,ΔH-TΔS<0,能自发进行。
合成氨反应的特点
工业合成氨时主要考虑的因素有哪些?
(3) 便宜
(4) 绿色
(2) 快
(1) 多
提高平衡混合物里氨的含量
提高单位时间里氨的产量
降低成本,提高原料利用率
保护环境,对设备的要求
——化学平衡
——化学反应速率
思考·交流
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
提高合成氨的产量 影响因素
浓度 温度 压强 催化剂
反应速率
化学平衡
实际生产
增大
正向移动
增大
升高
增大
使用
增大反应物浓度
减小生成物浓度
降低
增大
——
归纳·总结
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
对合成氨反应的影响 影响因素
浓度 温度 压强
提高平衡混合物中氨的含量
1.从化学平衡分析
化学反应原理的分析
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
1∶1 1∶2 1∶3 1∶4 1∶5 1∶6
0.6
0.5
0.4
0.3
0.2
0.1
NH3%
N2∶H2
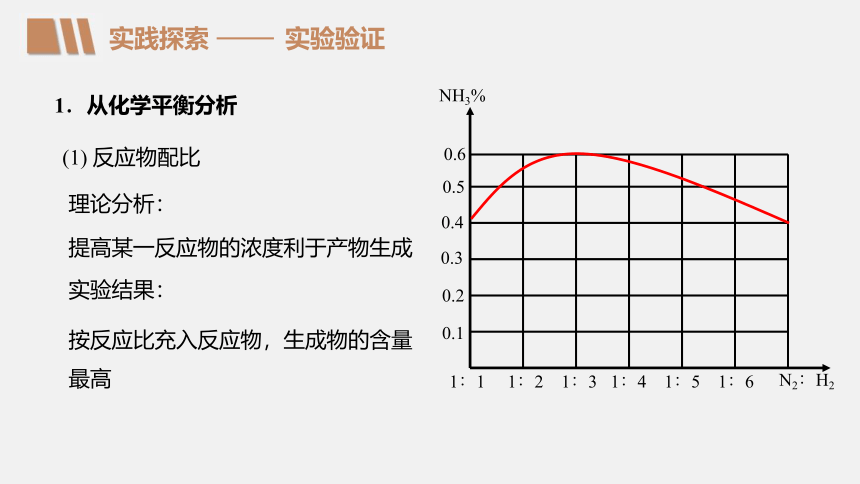
(1) 反应物配比
理论分析:
实验结果:
提高某一反应物的浓度利于产物生成
按反应比充入反应物,生成物的含量最高
实践探索
实验验证
1.从化学平衡分析
理论分析:
实验结果:
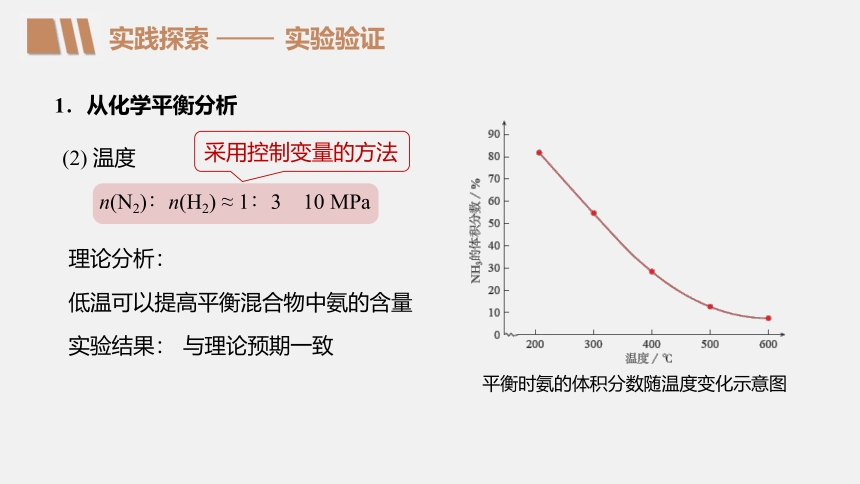
(2) 温度
低温可以提高平衡混合物中氨的含量
n(N2)∶n(H2) ≈ 1∶3 10 MPa
与理论预期一致
平衡时氨的体积分数随温度变化示意图
采用控制变量的方法
实践探索
实验验证
1.从化学平衡分析
(3) 压强
实践探索
实验验证
1.从化学平衡分析
压强越大越有利于提高平衡混合物中氨的含量
与理论预期一致
平衡时氨的体积分数随压强变化示意图
n(N2)∶n(H2) ≈ 1∶3 400 ℃
理论分析:
实验结果:
反应过程
能量
反应物
非催化反应
催化反应
生成物
催化剂与反应历程示意图
催化剂
降低活化能
加快反应速率
1.从化学反应速率分析
化学反应原理的分析
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
对合成氨 反应的影响 影响因素
浓度 温度 压强 催化剂
增大合成氨的反应速率 增大 升高 增大 使用
提高平衡混合物中氨的含量 n(N2)∶n(H2)≈1∶3 及时移走产生的氨 降低 增大 无影响
归纳·总结
1.浓度
迅速冷却氨使其变成液氨后及时分离,将分离后的原料气循环使用,并及时补充N2和H2
2.温度
综合考虑:
一般400~500 ℃
低温利于提高平衡混合物中氨的含量,但会减小化学反应速率
催化剂的活性
N2和H2的投料比为1∶2.8
化学反应条件的选择
3.压强
从化学反应速率与化学平衡考虑,压强越大越好
综合成本与设备耐压:
10 MPa~30 MPa
4.催化剂
增大化学反应速率,不改变平衡混合物的组成
现在常用铁触媒,其活性最好的温度为500 ℃左右
使用催化剂可使合成氨反应的速率提高上万亿倍
化学反应条件的选择
热交换
液态NH3
N2+H2
N2+H2
NH3+N2+H2
NH3+N2+H2
N2+H2
N2+H2
合 成 氨 流 程 简 图
干燥
净化
压缩机
加压
10 MPa ~30 MPa
冷却
铁触媒
400~500 ℃
N2+H2
合 成 氨 流 程 简 图
合 成 塔
氨 分 离 器
液氨
水 冷 器
循环气体
压缩机
循环压缩机
氢氮混合气
内因:物质组成、结构、性质
外因
通过改变反应条件使一个可能发生的反应按照某一方向进行
化学反应的调控
反应条件
温度、压强、浓度、催化剂
其他因素
设备条件、安全操作、经济成本
环境保护、社会效益
化学反应速率
化学平衡
化学反应的调控
提高合成氨的产量 影响因素
浓度 温度 压强 催化剂
反应速率
化学平衡
实际生产 提高
增大
正向移动
增大
升高
增大
使用
增大反应物浓度
减小生成物浓度
降低
增大
——
化学反应的调控
N2(g) + 3H2(g) 2NH3(g) ΔH = -92.4 kJ/mol
铁触媒
500 ℃
一般
400 ℃~500 ℃
一般
10-30 MPa
循环N2和H2
分离液氨
及时补充N2和H2
弗里茨·哈伯(Fritz Haber,1868.12. 9. ~1934.1. 29)德国化学家
1908年,循环法合成氨
1909年,17.5 MPa~20.0 MPa、锇作催化剂、500~600 ℃
氨含量6%
1918年获诺贝尔化学奖
科学·技术·社会
卡尔·博施(Carl Bosch,1874.8.27. ~1940.4.26)德国工业化学家
1931年实现了合成氨的工业化
铁作催化剂、开发了适合高温、高压下的合成设备、设计了获得大量廉价原料气的方法
1931年获诺贝尔化学奖
科学·技术·社会
格哈德·埃特尔,德国化学家
2007年揭开了合成氨的“天机”
在合成氨反应初期,氮、氢分子被吸附在铁催化剂表面,进而确定吸附的氮原子和氢原子是反应活性物,整个反应就是氮原子逐步加氢最终生成氨分子的过程,并给出了每步反应的活化能。
n(N2)∶n(H2)理论值为1∶3,实际为1∶2.8
科学·技术·社会
中国科学院大连化物所构筑的双活性中心催化体系,将合成氨的温度、压强分别降到350℃和 1MPa,为发展更加节能的催化剂提供了新思路,体现绿色化学的理念,使我国的合成氨工业位于世界领先水平。
科学·技术·社会
1.有关合成氨工业的说法中,正确的是 ( )
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂效率都很低
B.由于氨易液化,N2、H2在实际生产中是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是20~50 MPa,因为该压强下铁触媒的活性最大
B
从合成塔中出来的混合气体还要循环使用,连续化生产,生产氨的工厂效率并不低,A错误;抽出液化氨,合成氨平衡正向移动,提高原料转化率,且N2、H2循环使用,氨的产率很高,B正确;温度需要综合速率、反应物转化率和催化剂活性等因素共同决定,500 ℃只是保证催化活性最大,不是使化学平衡向正反应方向移动,C错误;高压有利于合成氨反应向正方向移动,且能提高正反应速率,跟催化剂无关,D错误。
2.有关合成氨的下列叙述中,不能用勒夏特列原理解释的是 ( )
A.加入催化剂能使合成氨反应速率加快
B.高压有利于提高NH3的产量
C.温度过高不利于氨的生成
D.增大N2浓度能提高H2的转化率
A
催化剂只能加快反应速率,不影响平衡移动,不能用勒夏特列原理解释,A符合题意;增大压强合成氨正向进行,利于提高NH3的产量,可用勒夏特列原理解释,B不符合题意;温度升高,化学平衡向着吸热方向即逆反应方向进行,可用勒夏特列原理解释,C不符合题意;增大反应物的浓度,化学平衡向着正反应方向即合成氨的方向进行,可用勒夏特列原理解释,D不符合题意。
3.硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关反应2SO2+O2 2SO3的说法中正确的是 ( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正、逆反应速率均为零
C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
D
4.合成氨工业对国民经济和社会发展具有重要的意义,哈伯法合成氨需要在20~50 MPa的高压和500 ℃左右的高温下,并用铁触媒作为催化剂,氨在平衡混合物中的含量仍较少。最近英国俄勒冈大学的化学家使用了一种名为 trans-Fe(DMeOPrPE)2的新催化剂,在常温下合成氨,反应方程式可表示为:N2+3H2 2NH3。有关说法正确的是 ( )
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景
C.新法合成氨能在常温下进行是因为不需要断裂化学键
D.新催化剂降低了反应所需要的能量,使平衡正向移动
B
5.冰醋酸CH3COOH沸点较高(117.9 ℃),且能形成二聚物(CH3COOH)2,其反应式为2CH3COOH(g) (CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用( )
A.高温低压 B.低温低压 C.加催化剂 D.低温高压
A
该反应具备气体分子数减小,正反应放热的特征。要测定醋酸相对分子质量,尽量增加乙酸的含量减少二聚物(CH3COOH)2的含量,平衡逆向移动程度越大越好,高温、低压满足要求,A正确。
本节内容结束
第四节 化学反应的调控
第二章 化学反应速率与化学平衡
民以食为天。人类从诞生到1 900年,几百万年时间,人口只有16亿,而1908年合成氨工业化至现在100多年时间,人口增加到超过76亿,合成氨是起了巨大的作用的。合成氨,诞生了化学肥料,使土地的粮食产量翻了几番,地球才能养活这么多人口,这其中的意义是无法用语言来表达的。
工业合成氨
氨除了作为肥料,也是生产硝酸、各种含氮的无机盐及有机中间体、磺胺药、聚氨酯、聚酰胺纤维和丁腈橡胶等的原料,在国民经济中占有重要地位。合成氨工业诞生以后,各种炸药都是以氨为原料合成的,在人类两次最大规模的战争——一战和二战中成为杀人的利器。
粮食增产
工业合成氨
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
(1)可逆性:反应为可逆反应。
(2)体积变化:正反应是气体体积缩小的反应。
(3)焓变:ΔH<0,熵变:ΔS<0。
(4)自发性:常温(298 K)下,ΔH-TΔS<0,能自发进行。
合成氨反应的特点
工业合成氨时主要考虑的因素有哪些?
(3) 便宜
(4) 绿色
(2) 快
(1) 多
提高平衡混合物里氨的含量
提高单位时间里氨的产量
降低成本,提高原料利用率
保护环境,对设备的要求
——化学平衡
——化学反应速率
思考·交流
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
提高合成氨的产量 影响因素
浓度 温度 压强 催化剂
反应速率
化学平衡
实际生产
增大
正向移动
增大
升高
增大
使用
增大反应物浓度
减小生成物浓度
降低
增大
——
归纳·总结
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
对合成氨反应的影响 影响因素
浓度 温度 压强
提高平衡混合物中氨的含量
1.从化学平衡分析
化学反应原理的分析
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
1∶1 1∶2 1∶3 1∶4 1∶5 1∶6
0.6
0.5
0.4
0.3
0.2
0.1
NH3%
N2∶H2
(1) 反应物配比
理论分析:
实验结果:
提高某一反应物的浓度利于产物生成
按反应比充入反应物,生成物的含量最高
实践探索
实验验证
1.从化学平衡分析
理论分析:
实验结果:
(2) 温度
低温可以提高平衡混合物中氨的含量
n(N2)∶n(H2) ≈ 1∶3 10 MPa
与理论预期一致
平衡时氨的体积分数随温度变化示意图
采用控制变量的方法
实践探索
实验验证
1.从化学平衡分析
(3) 压强
实践探索
实验验证
1.从化学平衡分析
压强越大越有利于提高平衡混合物中氨的含量
与理论预期一致
平衡时氨的体积分数随压强变化示意图
n(N2)∶n(H2) ≈ 1∶3 400 ℃
理论分析:
实验结果:
反应过程
能量
反应物
非催化反应
催化反应
生成物
催化剂与反应历程示意图
催化剂
降低活化能
加快反应速率
1.从化学反应速率分析
化学反应原理的分析
298 K,N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,
ΔS=-198.2 J·mol-1·K-1
对合成氨 反应的影响 影响因素
浓度 温度 压强 催化剂
增大合成氨的反应速率 增大 升高 增大 使用
提高平衡混合物中氨的含量 n(N2)∶n(H2)≈1∶3 及时移走产生的氨 降低 增大 无影响
归纳·总结
1.浓度
迅速冷却氨使其变成液氨后及时分离,将分离后的原料气循环使用,并及时补充N2和H2
2.温度
综合考虑:
一般400~500 ℃
低温利于提高平衡混合物中氨的含量,但会减小化学反应速率
催化剂的活性
N2和H2的投料比为1∶2.8
化学反应条件的选择
3.压强
从化学反应速率与化学平衡考虑,压强越大越好
综合成本与设备耐压:
10 MPa~30 MPa
4.催化剂
增大化学反应速率,不改变平衡混合物的组成
现在常用铁触媒,其活性最好的温度为500 ℃左右
使用催化剂可使合成氨反应的速率提高上万亿倍
化学反应条件的选择
热交换
液态NH3
N2+H2
N2+H2
NH3+N2+H2
NH3+N2+H2
N2+H2
N2+H2
合 成 氨 流 程 简 图
干燥
净化
压缩机
加压
10 MPa ~30 MPa
冷却
铁触媒
400~500 ℃
N2+H2
合 成 氨 流 程 简 图
合 成 塔
氨 分 离 器
液氨
水 冷 器
循环气体
压缩机
循环压缩机
氢氮混合气
内因:物质组成、结构、性质
外因
通过改变反应条件使一个可能发生的反应按照某一方向进行
化学反应的调控
反应条件
温度、压强、浓度、催化剂
其他因素
设备条件、安全操作、经济成本
环境保护、社会效益
化学反应速率
化学平衡
化学反应的调控
提高合成氨的产量 影响因素
浓度 温度 压强 催化剂
反应速率
化学平衡
实际生产 提高
增大
正向移动
增大
升高
增大
使用
增大反应物浓度
减小生成物浓度
降低
增大
——
化学反应的调控
N2(g) + 3H2(g) 2NH3(g) ΔH = -92.4 kJ/mol
铁触媒
500 ℃
一般
400 ℃~500 ℃
一般
10-30 MPa
循环N2和H2
分离液氨
及时补充N2和H2
弗里茨·哈伯(Fritz Haber,1868.12. 9. ~1934.1. 29)德国化学家
1908年,循环法合成氨
1909年,17.5 MPa~20.0 MPa、锇作催化剂、500~600 ℃
氨含量6%
1918年获诺贝尔化学奖
科学·技术·社会
卡尔·博施(Carl Bosch,1874.8.27. ~1940.4.26)德国工业化学家
1931年实现了合成氨的工业化
铁作催化剂、开发了适合高温、高压下的合成设备、设计了获得大量廉价原料气的方法
1931年获诺贝尔化学奖
科学·技术·社会
格哈德·埃特尔,德国化学家
2007年揭开了合成氨的“天机”
在合成氨反应初期,氮、氢分子被吸附在铁催化剂表面,进而确定吸附的氮原子和氢原子是反应活性物,整个反应就是氮原子逐步加氢最终生成氨分子的过程,并给出了每步反应的活化能。
n(N2)∶n(H2)理论值为1∶3,实际为1∶2.8
科学·技术·社会
中国科学院大连化物所构筑的双活性中心催化体系,将合成氨的温度、压强分别降到350℃和 1MPa,为发展更加节能的催化剂提供了新思路,体现绿色化学的理念,使我国的合成氨工业位于世界领先水平。
科学·技术·社会
1.有关合成氨工业的说法中,正确的是 ( )
A.从合成塔出来的混合气体,其中NH3只占15%,所以生产氨的工厂效率都很低
B.由于氨易液化,N2、H2在实际生产中是循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是20~50 MPa,因为该压强下铁触媒的活性最大
B
从合成塔中出来的混合气体还要循环使用,连续化生产,生产氨的工厂效率并不低,A错误;抽出液化氨,合成氨平衡正向移动,提高原料转化率,且N2、H2循环使用,氨的产率很高,B正确;温度需要综合速率、反应物转化率和催化剂活性等因素共同决定,500 ℃只是保证催化活性最大,不是使化学平衡向正反应方向移动,C错误;高压有利于合成氨反应向正方向移动,且能提高正反应速率,跟催化剂无关,D错误。
2.有关合成氨的下列叙述中,不能用勒夏特列原理解释的是 ( )
A.加入催化剂能使合成氨反应速率加快
B.高压有利于提高NH3的产量
C.温度过高不利于氨的生成
D.增大N2浓度能提高H2的转化率
A
催化剂只能加快反应速率,不影响平衡移动,不能用勒夏特列原理解释,A符合题意;增大压强合成氨正向进行,利于提高NH3的产量,可用勒夏特列原理解释,B不符合题意;温度升高,化学平衡向着吸热方向即逆反应方向进行,可用勒夏特列原理解释,C不符合题意;增大反应物的浓度,化学平衡向着正反应方向即合成氨的方向进行,可用勒夏特列原理解释,D不符合题意。
3.硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关反应2SO2+O2 2SO3的说法中正确的是 ( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正、逆反应速率均为零
C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
D
4.合成氨工业对国民经济和社会发展具有重要的意义,哈伯法合成氨需要在20~50 MPa的高压和500 ℃左右的高温下,并用铁触媒作为催化剂,氨在平衡混合物中的含量仍较少。最近英国俄勒冈大学的化学家使用了一种名为 trans-Fe(DMeOPrPE)2的新催化剂,在常温下合成氨,反应方程式可表示为:N2+3H2 2NH3。有关说法正确的是 ( )
A.哈伯法合成氨是吸热反应,新法合成氨是放热反应
B.新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景
C.新法合成氨能在常温下进行是因为不需要断裂化学键
D.新催化剂降低了反应所需要的能量,使平衡正向移动
B
5.冰醋酸CH3COOH沸点较高(117.9 ℃),且能形成二聚物(CH3COOH)2,其反应式为2CH3COOH(g) (CH3COOH)2(g) (正反应为放热反应),若采用测气体密度的方法测醋酸相对分子质量,为尽量接近真实性,在测定时应采用( )
A.高温低压 B.低温低压 C.加催化剂 D.低温高压
A
该反应具备气体分子数减小,正反应放热的特征。要测定醋酸相对分子质量,尽量增加乙酸的含量减少二聚物(CH3COOH)2的含量,平衡逆向移动程度越大越好,高温、低压满足要求,A正确。
本节内容结束
