3.2.2 溶液的酸碱性与pH 课件(共22张PPT)-高二化学人教版选择性必修1课件
文档属性
| 名称 | 3.2.2 溶液的酸碱性与pH 课件(共22张PPT)-高二化学人教版选择性必修1课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 40.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 21:12:06 | ||
图片预览








文档简介
(共22张PPT)
第三章
水溶液中的离子反应与平衡
第二节
水的电离和溶液的pH
溶液的酸碱性与pH
第 2课时
教 学 目 标
核 心 素 养
1. 掌握表示溶液酸碱度的方法——pH的范围、及其与溶液酸碱性的关系等。
2.学会用pH试纸测定溶液的酸碱度,会利用溶液酸碱度知识解决实际问题。
感受和体会化学物质的重要作用;保持和增强学习化学的强烈欲望,培养学生证据推理与模型认知的化学核心素养。
提出问题
如何用简单的实验测定下列溶液的酸碱性?
实验测定
——用酸碱指示剂测定。
粗略测定——pH试纸
精确测定——pH计
溶液酸碱性
定性判断
定量判断
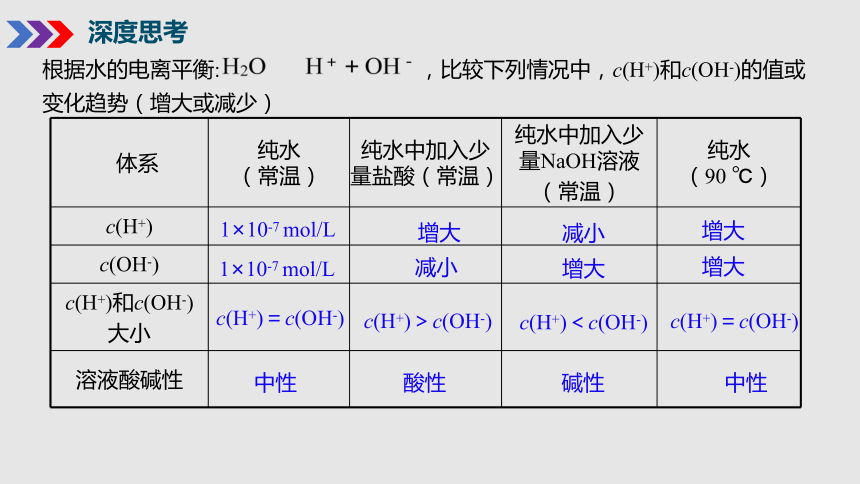
深度思考
体系 纯水 (常温) 纯水中加入少量盐酸(常温) 纯水中加入少量NaOH溶液 (常温) 纯水
(90 ℃)
c(H+)
c(OH-)
c(H+)和c(OH-) 大小
溶液酸碱性
c(H+)>c(OH-)
1×10-7 mol/L
1×10-7 mol/L
减小
增大
c(H+)=c(OH-)
c(H+)<c(OH-)
增大
减小
c(H+)=c(OH-)
增大
增大
根据水的电离平衡: ,比较下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或减少)
中性
酸性
碱性
中性
一、溶液的酸碱性与pH
H2O H++OH-
溶液的 酸碱性 c(H+) 和 c(OH-) 的关系 pH
25℃
酸性 c(H+) > c(OH-)
中性 c(H+) = c(OH-)
碱性 c(H+) < c(OH-)
= 7
> 7
< 7
25℃,Kw=c(H+)·c(OH-)=1×10-14
1.溶液的酸碱性由c(H+)和c(OH-)相对大小决定
2. pH是c(H+)的负对数,即:pH=-lgc(H+)
pH=-lg10-10=10
c(OH-)=1×10-4 mol/L
例1: 常温下,1×10-4 mol/L NaOH溶液,求溶液的pH。
c(H+)== 1×10-10 mol/L
■ pH的适用范围:
c(H+)和c(OH-)都较小的稀溶液(小于1 mol/L)
一、溶液的酸碱性与pH
提出问题
[追加条件]若该溶液是在
25 ℃时,
10 ℃时,
90 ℃时,
溶液的酸碱性又如何?
t ℃ 时,某溶液中c(H+)=1×10-7 mol/L, 分析该溶液的酸碱性。
解决问题
t℃ Kw c(H+) (mol/L ) c(OH-) (mol/L ) c(H+)和c(OH-) 的大小比较 溶液的
酸碱性
25
10
90
Kw=c(H+)·c(OH-)
1×10-14
1×10-7
1×10-7
c(H+)=c(OH-)
中性
<1×10-14
1×10-7
<1×10-7
c(H+)>c(OH-)
酸性
>1×10-14
1×10-7
>1×10-7
c(H+)<c(OH-)
碱性
ΔH >0
3.pH大小与溶液的酸碱性关系 (25℃)
pH 溶液的酸碱性
pH<7 溶液呈酸性,pH越小,酸性越强
pH=7 溶液呈中性
pH>7 溶液呈碱性,pH越大,碱性越强
10-5
10-4
10-3
10-2
10-1
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
10-6
5
4
3
2
1
7
8
9
10
11
12
13
14
6
c(H+)
pH
c(H+)增大,pH减小
酸性增强
c(H+)减小,pH增大
碱性增强
一、溶液的酸碱性与pH
学以致用
例2.常温时,将1 mL 1×10-5 mol/L的盐酸稀释至1000 mL,测得稀释后溶液的pH为6.96。试分析:
(1)稀释后溶液中存在哪些粒子?
(2)这些粒子的来源是什么?
(3)每种离子的浓度是多少?
HCl === H+ + Cl-
OH-只来自H2O的电离。
H+来自HCl和H2O的电离,
H+ 、Cl- 、 、 H2O
c(H+)总=10-6.96 mol/L
c()==
=9.1×10-8 mol/L
c(Cl-)= = 1×10-8 mol/L
学以致用
盐酸
H+
OH- :H2O电离
HCl电离的H+
H2O电离的H+
主要
次要
稀释前
pH=5
稀释后
pH=6.96
次要
主要
方法归纳
ΔH >0
1.可逆过程
2.化学平衡移动原理
3.水的离子积 Kw
4.pH
定性
定量
理论
模型
定性
定量
1. pH与人体健康
人体血液的pH值是7.35~7.45时正常;
人体血液的pH值<7.35时,处于亚健康状况;
人体血液的pH值=6.9时,变成植物人;
人体血液的pH值是6.85~6.45时会死亡。
人体部分体液的pH值
二、pH的应用
2.溶液酸碱度对头发的影响
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
碱性物质对头发有损坏作用。所以洗发液应选接近中性的,不要选碱性大的洗发液,然后再用微酸性的护发素来保护头发。
pH=1 pH=4 pH=7 pH=10 pH=13
观察头发光泽 光泽好 较好 正常 不好 很不好
拉断的难易程度 难 较难 正常 易 很易
二、pH的应用
3.化工生产中许多反应必须在一定pH溶液里进行。
硫酸厂呈酸性的废水
印染厂呈碱性的废水
用碱性物质处理
用酸性物质处理
两工厂同时排放废水,怎样处理最节约成本?
二、pH的应用
4.农业生产中土壤pH的影响。
土壤pH和有效养分的关系
如果想在酸性土壤中种薄荷,可以用什么改良土壤,使其适合薄荷的生长?
二、pH的应用
5.测量雨水的pH,以监测酸雨的发生。
正常雨水pH约为5.6,因为溶有CO2 。当pH< 5.6时,被称为酸雨 。酸雨主要是人为地向大气中排放大量的酸性物质( SOx 、NOx等)造成的,如:燃烧含硫量高的煤,机动车排放的尾气(硫化物和氮化物等酸性气体),遇到水蒸气和冷空气就会形成酸雨。酸雨可以随大气流动而漂移,影响范围大。
二、pH的应用
课堂小结
1.溶液的酸碱性与pH的关系
2.pH=-lgc(H+)
溶液的酸碱性 c(H+) 和 c(OH-) 的关系 pH(25℃)
酸性 c(H+) > c(OH-) <7
中性 c(H+) = c(OH-) =7
碱性 c(H+) < c(OH-) >7
随堂练习
1.用pH试纸测定某无色溶液的pH,正确的是( )
A.用广泛pH试纸测得该溶液的pH为3.2
B.用pH试纸蘸取溶液,观察其颜色变化并与标准比色卡对照
C.用干燥、洁净的玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色变化并与标准比色卡对照
D.用干燥、洁净的玻璃棒蘸取溶液,滴在湿润的pH试纸上,所测得的pH一定偏小
用干燥、洁净玻璃棒蘸取溶液,滴在湿润的pH试纸上,测量的pH结果不一定偏低,如中性溶液氯化钠溶液的 pH不变。
广泛pH试纸的读数不会出现小数,只能读到整数
污染溶液
测得溶液 pH,操作正确。
pH试纸不能湿润,防止形成实验误差,
×
×
√
×
C
随堂练习
2.下列说法正确的是( )
A.c(H+)<c(OH﹣)的溶液一定显碱性
B.pH=6的溶液一定显酸性
C.pH=7的溶液一定显中性
D.c(OH﹣)=1×10﹣6mol/L的溶液一定显酸性
√
可能为中性,如 100℃时氯化钠溶液
×
温度未知,不能直接由 pH判断酸碱性
×
c(H+)未知,不能确定与c(H+)的关系,不能判断酸碱性。
A
×
溶液的酸碱性 c(H+) 和 c(OH-) 的关系 pH(25℃)
酸性 c(H+) > c(OH-) <7
中性 c(H+) = c(OH-) =7
碱性 c(H+) < c(OH-) >7
本节内容结束
第三章
水溶液中的离子反应与平衡
第二节
水的电离和溶液的pH
溶液的酸碱性与pH
第 2课时
教 学 目 标
核 心 素 养
1. 掌握表示溶液酸碱度的方法——pH的范围、及其与溶液酸碱性的关系等。
2.学会用pH试纸测定溶液的酸碱度,会利用溶液酸碱度知识解决实际问题。
感受和体会化学物质的重要作用;保持和增强学习化学的强烈欲望,培养学生证据推理与模型认知的化学核心素养。
提出问题
如何用简单的实验测定下列溶液的酸碱性?
实验测定
——用酸碱指示剂测定。
粗略测定——pH试纸
精确测定——pH计
溶液酸碱性
定性判断
定量判断
深度思考
体系 纯水 (常温) 纯水中加入少量盐酸(常温) 纯水中加入少量NaOH溶液 (常温) 纯水
(90 ℃)
c(H+)
c(OH-)
c(H+)和c(OH-) 大小
溶液酸碱性
c(H+)>c(OH-)
1×10-7 mol/L
1×10-7 mol/L
减小
增大
c(H+)=c(OH-)
c(H+)<c(OH-)
增大
减小
c(H+)=c(OH-)
增大
增大
根据水的电离平衡: ,比较下列情况中,c(H+)和c(OH-)的值或变化趋势(增大或减少)
中性
酸性
碱性
中性
一、溶液的酸碱性与pH
H2O H++OH-
溶液的 酸碱性 c(H+) 和 c(OH-) 的关系 pH
25℃
酸性 c(H+) > c(OH-)
中性 c(H+) = c(OH-)
碱性 c(H+) < c(OH-)
= 7
> 7
< 7
25℃,Kw=c(H+)·c(OH-)=1×10-14
1.溶液的酸碱性由c(H+)和c(OH-)相对大小决定
2. pH是c(H+)的负对数,即:pH=-lgc(H+)
pH=-lg10-10=10
c(OH-)=1×10-4 mol/L
例1: 常温下,1×10-4 mol/L NaOH溶液,求溶液的pH。
c(H+)== 1×10-10 mol/L
■ pH的适用范围:
c(H+)和c(OH-)都较小的稀溶液(小于1 mol/L)
一、溶液的酸碱性与pH
提出问题
[追加条件]若该溶液是在
25 ℃时,
10 ℃时,
90 ℃时,
溶液的酸碱性又如何?
t ℃ 时,某溶液中c(H+)=1×10-7 mol/L, 分析该溶液的酸碱性。
解决问题
t℃ Kw c(H+) (mol/L ) c(OH-) (mol/L ) c(H+)和c(OH-) 的大小比较 溶液的
酸碱性
25
10
90
Kw=c(H+)·c(OH-)
1×10-14
1×10-7
1×10-7
c(H+)=c(OH-)
中性
<1×10-14
1×10-7
<1×10-7
c(H+)>c(OH-)
酸性
>1×10-14
1×10-7
>1×10-7
c(H+)<c(OH-)
碱性
ΔH >0
3.pH大小与溶液的酸碱性关系 (25℃)
pH 溶液的酸碱性
pH<7 溶液呈酸性,pH越小,酸性越强
pH=7 溶液呈中性
pH>7 溶液呈碱性,pH越大,碱性越强
10-5
10-4
10-3
10-2
10-1
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
10-6
5
4
3
2
1
7
8
9
10
11
12
13
14
6
c(H+)
pH
c(H+)增大,pH减小
酸性增强
c(H+)减小,pH增大
碱性增强
一、溶液的酸碱性与pH
学以致用
例2.常温时,将1 mL 1×10-5 mol/L的盐酸稀释至1000 mL,测得稀释后溶液的pH为6.96。试分析:
(1)稀释后溶液中存在哪些粒子?
(2)这些粒子的来源是什么?
(3)每种离子的浓度是多少?
HCl === H+ + Cl-
OH-只来自H2O的电离。
H+来自HCl和H2O的电离,
H+ 、Cl- 、 、 H2O
c(H+)总=10-6.96 mol/L
c()==
=9.1×10-8 mol/L
c(Cl-)= = 1×10-8 mol/L
学以致用
盐酸
H+
OH- :H2O电离
HCl电离的H+
H2O电离的H+
主要
次要
稀释前
pH=5
稀释后
pH=6.96
次要
主要
方法归纳
ΔH >0
1.可逆过程
2.化学平衡移动原理
3.水的离子积 Kw
4.pH
定性
定量
理论
模型
定性
定量
1. pH与人体健康
人体血液的pH值是7.35~7.45时正常;
人体血液的pH值<7.35时,处于亚健康状况;
人体血液的pH值=6.9时,变成植物人;
人体血液的pH值是6.85~6.45时会死亡。
人体部分体液的pH值
二、pH的应用
2.溶液酸碱度对头发的影响
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
碱性物质对头发有损坏作用。所以洗发液应选接近中性的,不要选碱性大的洗发液,然后再用微酸性的护发素来保护头发。
pH=1 pH=4 pH=7 pH=10 pH=13
观察头发光泽 光泽好 较好 正常 不好 很不好
拉断的难易程度 难 较难 正常 易 很易
二、pH的应用
3.化工生产中许多反应必须在一定pH溶液里进行。
硫酸厂呈酸性的废水
印染厂呈碱性的废水
用碱性物质处理
用酸性物质处理
两工厂同时排放废水,怎样处理最节约成本?
二、pH的应用
4.农业生产中土壤pH的影响。
土壤pH和有效养分的关系
如果想在酸性土壤中种薄荷,可以用什么改良土壤,使其适合薄荷的生长?
二、pH的应用
5.测量雨水的pH,以监测酸雨的发生。
正常雨水pH约为5.6,因为溶有CO2 。当pH< 5.6时,被称为酸雨 。酸雨主要是人为地向大气中排放大量的酸性物质( SOx 、NOx等)造成的,如:燃烧含硫量高的煤,机动车排放的尾气(硫化物和氮化物等酸性气体),遇到水蒸气和冷空气就会形成酸雨。酸雨可以随大气流动而漂移,影响范围大。
二、pH的应用
课堂小结
1.溶液的酸碱性与pH的关系
2.pH=-lgc(H+)
溶液的酸碱性 c(H+) 和 c(OH-) 的关系 pH(25℃)
酸性 c(H+) > c(OH-) <7
中性 c(H+) = c(OH-) =7
碱性 c(H+) < c(OH-) >7
随堂练习
1.用pH试纸测定某无色溶液的pH,正确的是( )
A.用广泛pH试纸测得该溶液的pH为3.2
B.用pH试纸蘸取溶液,观察其颜色变化并与标准比色卡对照
C.用干燥、洁净的玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色变化并与标准比色卡对照
D.用干燥、洁净的玻璃棒蘸取溶液,滴在湿润的pH试纸上,所测得的pH一定偏小
用干燥、洁净玻璃棒蘸取溶液,滴在湿润的pH试纸上,测量的pH结果不一定偏低,如中性溶液氯化钠溶液的 pH不变。
广泛pH试纸的读数不会出现小数,只能读到整数
污染溶液
测得溶液 pH,操作正确。
pH试纸不能湿润,防止形成实验误差,
×
×
√
×
C
随堂练习
2.下列说法正确的是( )
A.c(H+)<c(OH﹣)的溶液一定显碱性
B.pH=6的溶液一定显酸性
C.pH=7的溶液一定显中性
D.c(OH﹣)=1×10﹣6mol/L的溶液一定显酸性
√
可能为中性,如 100℃时氯化钠溶液
×
温度未知,不能直接由 pH判断酸碱性
×
c(H+)未知,不能确定与c(H+)的关系,不能判断酸碱性。
A
×
溶液的酸碱性 c(H+) 和 c(OH-) 的关系 pH(25℃)
酸性 c(H+) > c(OH-) <7
中性 c(H+) = c(OH-) =7
碱性 c(H+) < c(OH-) >7
本节内容结束
