2.1.1 化学反应速率 课件(共18张PPT)-高二化学人教版选择性必修1课件
文档属性
| 名称 | 2.1.1 化学反应速率 课件(共18张PPT)-高二化学人教版选择性必修1课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 12.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 21:18:51 | ||
图片预览






文档简介
(共18张PPT)
第1课时 化学反应速率
第 二 章 化学反应速率与化学平衡 第1节 化学反应速率
教 学 目 标
核 心 素 养
1.认识化学反应速率的概念和表示方法,掌握化学反应速率的简单计算。
1.“变化观念与平衡思想”:认识化学反应是有一定速率的,可以通过改变条件调控反应的快慢。
2.学会从化学的视角去观察生活、生产和社会中有关化学反应速率的问题。
2.“科学探究与创新意识”:初步形成探究化学规律的思路与方法,发展创造性体验和想象创意能力。
情境再现
美丽的烟花
炸药爆炸
溶洞的形成
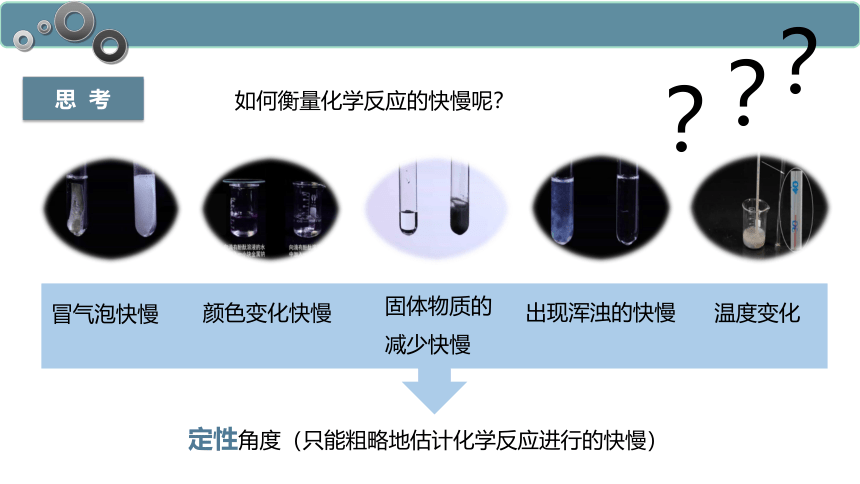
思 考
如何衡量化学反应的快慢呢?
?
?
?
冒气泡快慢
颜色变化快慢
固体物质的减少快慢
出现浑浊的快慢
温度变化
定性角度(只能粗略地估计化学反应进行的快慢)
如何定量地描述化学反应的快慢呢?
思 考
单位时间冒气泡的个数
颜色变化到某一色度所需时间
固体物质彻底消失的时间
不再生成沉淀所需时间
变化相同温度所需时间
?
?
?
知识梳理
化学反应速率
——描述化学反应快慢的物理量
1. 定义:
用单位时间内某反应物浓度的减少量或生成物浓度的增加量来表示。
mol·L-1·s-1 或 mol·L-1·min-1
Δc(A)
Δt
v(A)=
3.单位:
2.表示方法:
对于一体积固定的容器中进行的化学反应:
Δc(D)
Δt
v(D)=
aA(g)+bB(g)===cC(g)+dD(g)
mol/(L·s) 或 mol/(L·min)
①v表示平均反应速率,不是瞬时速率,且为正值;
②固体或纯液体,其浓度可视为常数。因此不用固体或纯液体的浓度的变化量表示化学反应速率。
注意:
知识梳理
化学反应速率
合作探究
在 2 L的密闭容器中,加入1 mol N2和 3 mol H2,发生 N2+3H2 2NH3 ,在 2 s末时,测得容器中含有 0.4 mol 的NH3,则用N2、H2、NH3表示的化学反应速率分别是多少?
起始浓度(mol/L)
2 s末浓度(mol/L)
变化浓度(mol/L)
“三段法”解题思路
0.5
1.5
0
0.2
0.2
0.3
0.1
0.4
1.2
化学反应的计算和比较
Δc(N2)
Δt
v(N2)=
=0.05 mol·L-1·s-1
Δc(H2)
Δt
v(H2)=
=0.15 mol·L-1·s-1
Δc(NH3)
Δt
v(NH3)=
=0.10 mol·L-1·s-1
合作探究
化学反应的计算和比较
起始浓度(mol/L)
2 s末浓度(mol/L)
变化浓度(mol/L)
0.5
1.5
0
0.2
0.2
0.3
0.1
0.4
1.2
“三段法”解题思路
思 考
观察并回答,分别用三种物质表示的反应速率之间有什么关系?
v(N2)
=0.05 mol·L-1·s-1
v(H2)
=0.15 mol·L-1·s-1
v(NH3)
=0.10 mol·L-1·s-1
同一个化学反应,各物质的化学反应速率的数值之比等于化学方程式中各物质的化学计量数之比。
v(N2) ∶
v(H2)∶
v(NH3)
=1∶3∶2
(g)
1
v(N2)
3
v(H2)
2
v(NH3)
=
=
aA(g)+bB(g)===cC(g)+dD(g)
a
v(A)
b
v(B)
c
v(C)
=
=
d
v(D)
=
同一个反应,用不同物质表示该反应的速率时,其数值不一定相同,但意义相同。
合作探究
化学反应的计算和比较
(g)
思 考
浓度可以表示化学反应速率,除此以外,还可以测定哪些物理量来表示化学反应速率?
气体的体积
体系的压强
颜色的深浅
导电能力
光的吸收
小 结
化学反应速率
定义
表示方法
单位
简单计算
1.对于反应A2(g)+3b2(g) 2ab3(g)以下表示的反应速率中,速率最大的是( )
A. v(A2)=0.4 mol·L-1·min-1
B. v(B2)=0.8 mol·L-1·min-1
C. v(AB3)=0.6 mol·L-1·min-1
D. v(A2)=0.01 mol·L-1·s-1
例题讲解
D
解析:比较同一反应的快慢,只要比较同一物质的化学反应速率的相对大小, 单位要统一。
例题讲解
2.在 1 L的密闭容器中,发生反应4A(s)+3B(g) 2C(g)+D(g),经 2 min后B的浓度减少 0.6 mol/L。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.用B、C、D分别表示反应的速率,其比值是3∶2∶1
C.在第 2 min末的反应速率用B表示是 0.3 mol·L-1·min-1
D. 2 min末,生成物D的浓度为 0.3 mol·L-1
解析:A为固体,不能表示化学反应速率;化学反应速率之比等于方程式计量数之比; v表示平均反应速率,不是瞬时速率;Δc之比等于系数之比,则 2 min末,生成物D的浓度为 0.2 mol·L-1
B
例题讲解
3.已知某反应中各物质的浓度变化如下:
aA(g) + bB(g) cC(g)
起始浓度/mol·L-1 3.0 1.0 0
2 s末浓度/mol·L-1 1.8 0.6 0.8
据此可推算出上述化学反应方程式为 ( )
A.3A(g)+B(g) 2C(g) B.A(g)+2B(g) 2C(g)
C.A(g)+3B(g) 2C(g) D.2A(g)+B(g) 3C(g)
A
解析:Δc之比等于系数之比,a:b:c=3:1:2
例题讲解
4.反应2SO2(g)+O(g)2 2SO3(g)经过一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
A.0.1 s B.2.5 s C.5 s D.10 s
C
解析:根据速率之比等于系数之比,则v(SO3)= 0.08 mol·(L·s)-1 ,根据公式
可得,Δt= 5 s
Δc(SO3)
Δt
v(SO3)=
本节内容结束
第1课时 化学反应速率
第 二 章 化学反应速率与化学平衡 第1节 化学反应速率
教 学 目 标
核 心 素 养
1.认识化学反应速率的概念和表示方法,掌握化学反应速率的简单计算。
1.“变化观念与平衡思想”:认识化学反应是有一定速率的,可以通过改变条件调控反应的快慢。
2.学会从化学的视角去观察生活、生产和社会中有关化学反应速率的问题。
2.“科学探究与创新意识”:初步形成探究化学规律的思路与方法,发展创造性体验和想象创意能力。
情境再现
美丽的烟花
炸药爆炸
溶洞的形成
思 考
如何衡量化学反应的快慢呢?
?
?
?
冒气泡快慢
颜色变化快慢
固体物质的减少快慢
出现浑浊的快慢
温度变化
定性角度(只能粗略地估计化学反应进行的快慢)
如何定量地描述化学反应的快慢呢?
思 考
单位时间冒气泡的个数
颜色变化到某一色度所需时间
固体物质彻底消失的时间
不再生成沉淀所需时间
变化相同温度所需时间
?
?
?
知识梳理
化学反应速率
——描述化学反应快慢的物理量
1. 定义:
用单位时间内某反应物浓度的减少量或生成物浓度的增加量来表示。
mol·L-1·s-1 或 mol·L-1·min-1
Δc(A)
Δt
v(A)=
3.单位:
2.表示方法:
对于一体积固定的容器中进行的化学反应:
Δc(D)
Δt
v(D)=
aA(g)+bB(g)===cC(g)+dD(g)
mol/(L·s) 或 mol/(L·min)
①v表示平均反应速率,不是瞬时速率,且为正值;
②固体或纯液体,其浓度可视为常数。因此不用固体或纯液体的浓度的变化量表示化学反应速率。
注意:
知识梳理
化学反应速率
合作探究
在 2 L的密闭容器中,加入1 mol N2和 3 mol H2,发生 N2+3H2 2NH3 ,在 2 s末时,测得容器中含有 0.4 mol 的NH3,则用N2、H2、NH3表示的化学反应速率分别是多少?
起始浓度(mol/L)
2 s末浓度(mol/L)
变化浓度(mol/L)
“三段法”解题思路
0.5
1.5
0
0.2
0.2
0.3
0.1
0.4
1.2
化学反应的计算和比较
Δc(N2)
Δt
v(N2)=
=0.05 mol·L-1·s-1
Δc(H2)
Δt
v(H2)=
=0.15 mol·L-1·s-1
Δc(NH3)
Δt
v(NH3)=
=0.10 mol·L-1·s-1
合作探究
化学反应的计算和比较
起始浓度(mol/L)
2 s末浓度(mol/L)
变化浓度(mol/L)
0.5
1.5
0
0.2
0.2
0.3
0.1
0.4
1.2
“三段法”解题思路
思 考
观察并回答,分别用三种物质表示的反应速率之间有什么关系?
v(N2)
=0.05 mol·L-1·s-1
v(H2)
=0.15 mol·L-1·s-1
v(NH3)
=0.10 mol·L-1·s-1
同一个化学反应,各物质的化学反应速率的数值之比等于化学方程式中各物质的化学计量数之比。
v(N2) ∶
v(H2)∶
v(NH3)
=1∶3∶2
(g)
1
v(N2)
3
v(H2)
2
v(NH3)
=
=
aA(g)+bB(g)===cC(g)+dD(g)
a
v(A)
b
v(B)
c
v(C)
=
=
d
v(D)
=
同一个反应,用不同物质表示该反应的速率时,其数值不一定相同,但意义相同。
合作探究
化学反应的计算和比较
(g)
思 考
浓度可以表示化学反应速率,除此以外,还可以测定哪些物理量来表示化学反应速率?
气体的体积
体系的压强
颜色的深浅
导电能力
光的吸收
小 结
化学反应速率
定义
表示方法
单位
简单计算
1.对于反应A2(g)+3b2(g) 2ab3(g)以下表示的反应速率中,速率最大的是( )
A. v(A2)=0.4 mol·L-1·min-1
B. v(B2)=0.8 mol·L-1·min-1
C. v(AB3)=0.6 mol·L-1·min-1
D. v(A2)=0.01 mol·L-1·s-1
例题讲解
D
解析:比较同一反应的快慢,只要比较同一物质的化学反应速率的相对大小, 单位要统一。
例题讲解
2.在 1 L的密闭容器中,发生反应4A(s)+3B(g) 2C(g)+D(g),经 2 min后B的浓度减少 0.6 mol/L。对此反应速率的正确表示是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.用B、C、D分别表示反应的速率,其比值是3∶2∶1
C.在第 2 min末的反应速率用B表示是 0.3 mol·L-1·min-1
D. 2 min末,生成物D的浓度为 0.3 mol·L-1
解析:A为固体,不能表示化学反应速率;化学反应速率之比等于方程式计量数之比; v表示平均反应速率,不是瞬时速率;Δc之比等于系数之比,则 2 min末,生成物D的浓度为 0.2 mol·L-1
B
例题讲解
3.已知某反应中各物质的浓度变化如下:
aA(g) + bB(g) cC(g)
起始浓度/mol·L-1 3.0 1.0 0
2 s末浓度/mol·L-1 1.8 0.6 0.8
据此可推算出上述化学反应方程式为 ( )
A.3A(g)+B(g) 2C(g) B.A(g)+2B(g) 2C(g)
C.A(g)+3B(g) 2C(g) D.2A(g)+B(g) 3C(g)
A
解析:Δc之比等于系数之比,a:b:c=3:1:2
例题讲解
4.反应2SO2(g)+O(g)2 2SO3(g)经过一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )
A.0.1 s B.2.5 s C.5 s D.10 s
C
解析:根据速率之比等于系数之比,则v(SO3)= 0.08 mol·(L·s)-1 ,根据公式
可得,Δt= 5 s
Δc(SO3)
Δt
v(SO3)=
本节内容结束
