3.2.4 酸碱中和滴定 课件(共24张PPT)-高二化学人教版选择性必修1课件
文档属性
| 名称 | 3.2.4 酸碱中和滴定 课件(共24张PPT)-高二化学人教版选择性必修1课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 146.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 21:21:54 | ||
图片预览






文档简介
(共24张PPT)
第三章
水溶液中的离子反应与平衡
第二节
水的电离和溶液的pH
第 4课时
酸碱中和滴定
教 学 目 标
核 心 素 养
1.了解酸碱中和滴定的原理。
2.了解指示剂的选择方法。
3.掌握酸碱中和滴定的实验操作、数据处理、误差分析。
通过分析滴定中溶液pH的变化,掌握判断滴定终点的依据,并能将其在定量测定中迁移应用,培养学生证据推理和科学探究的核心素养。
生活常识
医学检测报告单
问题1.如何测定未知浓度盐酸溶液的物质的量浓度?
(3)用已知物质的量浓度的碱来测定未知物质的量浓度的酸溶液。
定量分析(据化学反应比例)
(1)滴入硝酸银和硝酸混合溶液,称取沉淀的质量。
(2)滴入碳酸钠溶液,测量二氧化碳的体积。
操作复杂
气体体积受温度、压强影响大,误差较大。
酸碱中和滴定
交流讨论
中和反应中:H++OH-===H2O
当n(H+) =n (OH-),完全中和
对于一元酸与碱反应时:c(H+)·V(酸)=c(OH-)·V(碱)
1.原理
一、酸碱中和滴定
问题1:酸碱中和滴定操作关键问题是什么?
(1)标准碱:浓度精确,便于使用。
问题2:如何测定待测盐酸的浓度并达到一定的精确度要求呢?
(2)仪器:准确测定参加中和反应的酸、碱溶液的体积。
(3)终点判断:准确判断中和反应是否恰好完全反应。
筛选条件提高精度
(1)标准碱:如何保证与待测酸溶液充分反应?使用浓度?
(3)终点判断:如何让反应终点有明显现象便于判断,并分析其可行性。
(2)仪器:盛装药品原则?精确度?
交流讨论
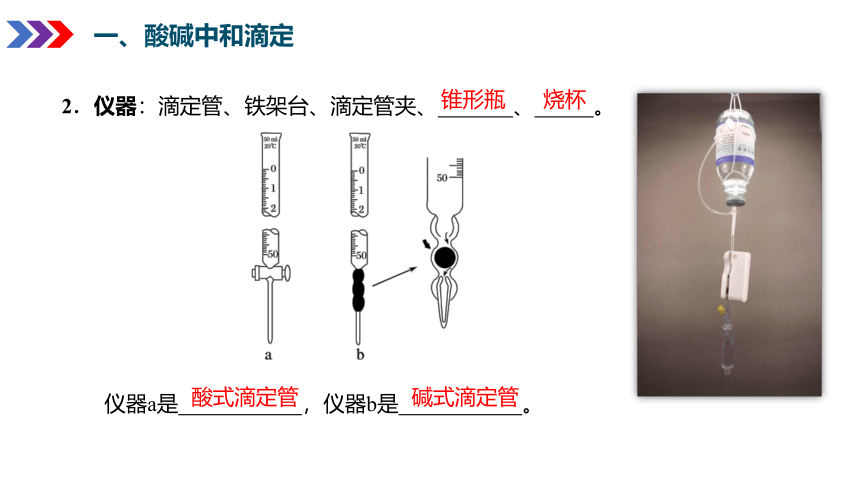
仪器a是 ,仪器b是 。
一、酸碱中和滴定
2.仪器:滴定管、铁架台、滴定管夹、 、 。
锥形瓶 烧杯
酸式滴定管 碱式滴定管
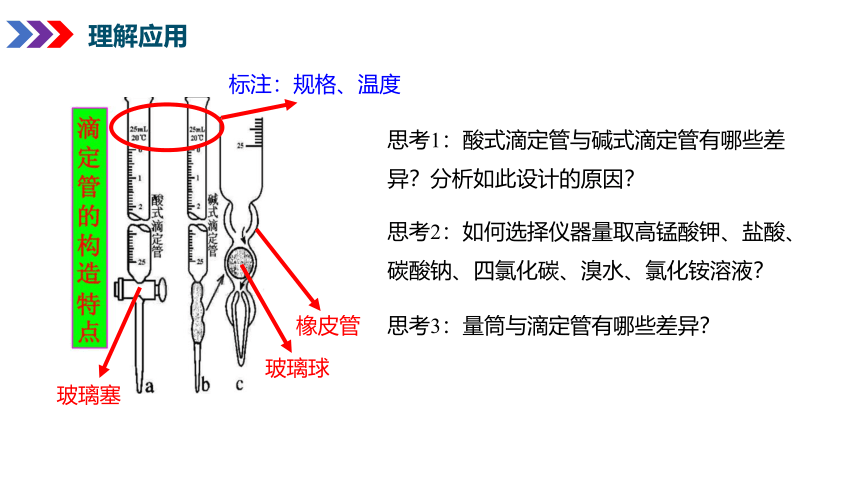
玻璃塞
玻璃球
橡皮管
标注:规格、温度
思考1:酸式滴定管与碱式滴定管有哪些差异?分析如此设计的原因?
思考2:如何选择仪器量取高锰酸钾、盐酸、碳酸钠、四氯化碳、溴水、氯化铵溶液?
思考3:量筒与滴定管有哪些差异?
理解应用
3.准确判断酸碱恰好完全反应
(1)滴加适当的酸碱指示剂,通过颜色变化指示中和反应恰好完成。
常用指示剂变色范围(pH)
甲基橙 <3.1 (红色) 3.1~4.4(橙色) >4.4(黄色)
石 蕊 <5.0 (红色) 5.0~8.0(紫色) >8.0(蓝色)
酚 酞 <8.2 (无色) 8.2~10.0(浅红) >10.0(红色)
★注意:酸碱中和滴定实验时选择颜色变化明显的指示剂。
一、酸碱中和滴定
突跃范围
3.准确判断酸碱恰好完全反应
一、酸碱中和滴定
(2)pH传感器数字监测滴定终点溶液pH突变
计算:滴定误差允许范围为0.1%,用0.100 mol/L NaOH溶液滴20.00 mL 0.100 mol/L盐酸,计算误差允许范围内溶液的pH是多少?(标准碱溶液滴入误差允许范围19.98 mL~20.02 mL)
20.02 mL碱溶液:pH =9.7;19.98 mL碱溶液:pH =4.3
当氢氧化钠溶液的体积从19.98 mL变为20.02 mL时,pH从4.3突跃至9.7。
★选择变色范围在这一范围内的指示剂就不会造成很大误差。
突跃范围
20.02 mL
19.98 mL
pH
VNaOH/(mL)
定量计算
二、实验操作步骤
1.实验准备
(2)洗涤:用水洗净后,各用少量待装液润洗滴定管2~3次
(3)装液:用倾倒法将盐酸注入酸式滴定管中,使液面高于刻度2~3 cm
(4)赶气泡:
酸式滴定管:快速放液
碱式滴定管:橡皮管向上翘起
(5)调液:
调节滴定管中液面高度,记下读数。
(1)查漏:检查两滴定管是否漏水、堵塞和活塞转动是否灵活
二、实验操作步骤
3.数据处理:为减少实验误差,滴定时,要求重复实验2~3次,求出所用标
准溶液体积的 ,然后再计算待测液的物质的量浓度。
2.滴定
终点的判断:等到滴入最后一滴标准液,指示剂变色,且在半分钟内_____
,视为滴定终点并记录标准液的体积。
不变
回原色
平均值
控制活塞
锥形瓶
内溶液颜色变化
摇动锥形瓶
二、实验操作步骤
三、中和滴定数据处理和计算
一次滴定 二次滴定 三次滴定
终点读数 起点读数 用量
V标HCl
V待NaOH
c待NaOH
c待平均
cNaOH= —————
cHCl . VHCl
VNaOH
定性分析与定量分析
定性分析主要包括试样的外表观察和准备、初步试验(如焰色试验、灼烧试验和溶解试验等)、阳离子分析和阴离子分析等。
中和滴定就是一种重要的定量分析。在定量分析中,实验误差是客观存在的,所以需要对所得的数据进行处理和评价。在几次实验结果相近的情况下,可计算它们的平均值。
方法引导
c(测)=
c(标)× V(标)
V(测)
c(标)、 V(测)是已知的数据,因此c(测)的大小只由V(标) ——“读数”决定,只要直接或者间接的能引起“读数”的变化,则c(测)也随着变化,且二者的变化是成正比例关系。
已知
已知
读数
1.决定误差因素
四、误差分析
2.常见的误差分析
用标准盐酸滴定待测氢氧化钠溶液为例:
步骤 操作 c(NaOH)
洗涤 未用标准液润洗滴定管 _____
锥形瓶用待测液润洗 _____
未用待测液润洗取用待测液的滴定管 _____
锥形瓶洗净后瓶内残留有少量蒸馏水 _______
偏高
偏高
偏低
无影响
四、误差分析
步骤 操作 c(NaOH)
读数 滴定前仰视读数或滴定后俯视读数(图Ⅰ) _____
滴定前俯视读数或滴定后仰视读数(图Ⅱ) _____
偏低
偏高
四、误差分析
步骤 操作 c(NaOH)
滴定 滴定完毕后立即读数,半分钟后颜色又褪去 _____
滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 _____
滴定过程中振荡时有液滴溅出 _____
滴定过程中,锥形瓶内加少量蒸馏水 _______
偏低
偏高
偏低
无影响
四、误差分析
3.通过条件筛选、实验操作、pH数字传感监测、误差分析,明确滴定操作定量分析的基本方法。
2.根据精度要求筛选条件:
选择标准溶液、实验仪器、终点判断指示剂。
1.明确定量分析酸碱中和滴定原理。
课堂小结
1.用标准KOH溶液滴定未知浓度的硫酸,若测定结果偏低,则原因可能是( )
A.配制标准溶液的固体KOH中混有KCl杂质
B.滴定到终点时,俯视读数,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂了一滴溶液
A.标准液的c(OH-)偏小,滴定时消耗的V(标) 偏大,导致c(硫酸)偏高;
B.滴定终点时俯视读数,使读取的标准液体积偏小,测定的c(硫酸)偏低;
C.用未知液润洗锥形瓶,滴定时消耗的V(标) 偏大,测定的c(硫酸)偏高;
D.尖嘴处悬挂溶液,使读取的V(标)偏大,测定c(硫酸)偏高。
大
小
B
随堂练习
2.某同学欲用已知物质的量浓度为0.100 0 mol/L的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。结合下表数据,计算被测氢氧化钠溶液的物质的量浓度。
滴定 次数 待测溶液 体积/mL 标准酸溶液体积
滴定前的刻度/mL 滴定后的刻度/mL
第一次 10.00 3.20 20.30
第二次 10.00 4.10 21.10
第三次 10.00 0.40 17.60
V(HCl)
17.10
17.00
17.20
)==17.10 mL
对于一元酸与碱反应时:c(H+)·V(酸)=c(OH-)·V(碱)
0.100 0 mol/L · 0.017 10 L=c(OH-)· 0.010 00 L
c(OH-)=0.171 0 mol/L
随堂练习
本节内容结束
第三章
水溶液中的离子反应与平衡
第二节
水的电离和溶液的pH
第 4课时
酸碱中和滴定
教 学 目 标
核 心 素 养
1.了解酸碱中和滴定的原理。
2.了解指示剂的选择方法。
3.掌握酸碱中和滴定的实验操作、数据处理、误差分析。
通过分析滴定中溶液pH的变化,掌握判断滴定终点的依据,并能将其在定量测定中迁移应用,培养学生证据推理和科学探究的核心素养。
生活常识
医学检测报告单
问题1.如何测定未知浓度盐酸溶液的物质的量浓度?
(3)用已知物质的量浓度的碱来测定未知物质的量浓度的酸溶液。
定量分析(据化学反应比例)
(1)滴入硝酸银和硝酸混合溶液,称取沉淀的质量。
(2)滴入碳酸钠溶液,测量二氧化碳的体积。
操作复杂
气体体积受温度、压强影响大,误差较大。
酸碱中和滴定
交流讨论
中和反应中:H++OH-===H2O
当n(H+) =n (OH-),完全中和
对于一元酸与碱反应时:c(H+)·V(酸)=c(OH-)·V(碱)
1.原理
一、酸碱中和滴定
问题1:酸碱中和滴定操作关键问题是什么?
(1)标准碱:浓度精确,便于使用。
问题2:如何测定待测盐酸的浓度并达到一定的精确度要求呢?
(2)仪器:准确测定参加中和反应的酸、碱溶液的体积。
(3)终点判断:准确判断中和反应是否恰好完全反应。
筛选条件提高精度
(1)标准碱:如何保证与待测酸溶液充分反应?使用浓度?
(3)终点判断:如何让反应终点有明显现象便于判断,并分析其可行性。
(2)仪器:盛装药品原则?精确度?
交流讨论
仪器a是 ,仪器b是 。
一、酸碱中和滴定
2.仪器:滴定管、铁架台、滴定管夹、 、 。
锥形瓶 烧杯
酸式滴定管 碱式滴定管
玻璃塞
玻璃球
橡皮管
标注:规格、温度
思考1:酸式滴定管与碱式滴定管有哪些差异?分析如此设计的原因?
思考2:如何选择仪器量取高锰酸钾、盐酸、碳酸钠、四氯化碳、溴水、氯化铵溶液?
思考3:量筒与滴定管有哪些差异?
理解应用
3.准确判断酸碱恰好完全反应
(1)滴加适当的酸碱指示剂,通过颜色变化指示中和反应恰好完成。
常用指示剂变色范围(pH)
甲基橙 <3.1 (红色) 3.1~4.4(橙色) >4.4(黄色)
石 蕊 <5.0 (红色) 5.0~8.0(紫色) >8.0(蓝色)
酚 酞 <8.2 (无色) 8.2~10.0(浅红) >10.0(红色)
★注意:酸碱中和滴定实验时选择颜色变化明显的指示剂。
一、酸碱中和滴定
突跃范围
3.准确判断酸碱恰好完全反应
一、酸碱中和滴定
(2)pH传感器数字监测滴定终点溶液pH突变
计算:滴定误差允许范围为0.1%,用0.100 mol/L NaOH溶液滴20.00 mL 0.100 mol/L盐酸,计算误差允许范围内溶液的pH是多少?(标准碱溶液滴入误差允许范围19.98 mL~20.02 mL)
20.02 mL碱溶液:pH =9.7;19.98 mL碱溶液:pH =4.3
当氢氧化钠溶液的体积从19.98 mL变为20.02 mL时,pH从4.3突跃至9.7。
★选择变色范围在这一范围内的指示剂就不会造成很大误差。
突跃范围
20.02 mL
19.98 mL
pH
VNaOH/(mL)
定量计算
二、实验操作步骤
1.实验准备
(2)洗涤:用水洗净后,各用少量待装液润洗滴定管2~3次
(3)装液:用倾倒法将盐酸注入酸式滴定管中,使液面高于刻度2~3 cm
(4)赶气泡:
酸式滴定管:快速放液
碱式滴定管:橡皮管向上翘起
(5)调液:
调节滴定管中液面高度,记下读数。
(1)查漏:检查两滴定管是否漏水、堵塞和活塞转动是否灵活
二、实验操作步骤
3.数据处理:为减少实验误差,滴定时,要求重复实验2~3次,求出所用标
准溶液体积的 ,然后再计算待测液的物质的量浓度。
2.滴定
终点的判断:等到滴入最后一滴标准液,指示剂变色,且在半分钟内_____
,视为滴定终点并记录标准液的体积。
不变
回原色
平均值
控制活塞
锥形瓶
内溶液颜色变化
摇动锥形瓶
二、实验操作步骤
三、中和滴定数据处理和计算
一次滴定 二次滴定 三次滴定
终点读数 起点读数 用量
V标HCl
V待NaOH
c待NaOH
c待平均
cNaOH= —————
cHCl . VHCl
VNaOH
定性分析与定量分析
定性分析主要包括试样的外表观察和准备、初步试验(如焰色试验、灼烧试验和溶解试验等)、阳离子分析和阴离子分析等。
中和滴定就是一种重要的定量分析。在定量分析中,实验误差是客观存在的,所以需要对所得的数据进行处理和评价。在几次实验结果相近的情况下,可计算它们的平均值。
方法引导
c(测)=
c(标)× V(标)
V(测)
c(标)、 V(测)是已知的数据,因此c(测)的大小只由V(标) ——“读数”决定,只要直接或者间接的能引起“读数”的变化,则c(测)也随着变化,且二者的变化是成正比例关系。
已知
已知
读数
1.决定误差因素
四、误差分析
2.常见的误差分析
用标准盐酸滴定待测氢氧化钠溶液为例:
步骤 操作 c(NaOH)
洗涤 未用标准液润洗滴定管 _____
锥形瓶用待测液润洗 _____
未用待测液润洗取用待测液的滴定管 _____
锥形瓶洗净后瓶内残留有少量蒸馏水 _______
偏高
偏高
偏低
无影响
四、误差分析
步骤 操作 c(NaOH)
读数 滴定前仰视读数或滴定后俯视读数(图Ⅰ) _____
滴定前俯视读数或滴定后仰视读数(图Ⅱ) _____
偏低
偏高
四、误差分析
步骤 操作 c(NaOH)
滴定 滴定完毕后立即读数,半分钟后颜色又褪去 _____
滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 _____
滴定过程中振荡时有液滴溅出 _____
滴定过程中,锥形瓶内加少量蒸馏水 _______
偏低
偏高
偏低
无影响
四、误差分析
3.通过条件筛选、实验操作、pH数字传感监测、误差分析,明确滴定操作定量分析的基本方法。
2.根据精度要求筛选条件:
选择标准溶液、实验仪器、终点判断指示剂。
1.明确定量分析酸碱中和滴定原理。
课堂小结
1.用标准KOH溶液滴定未知浓度的硫酸,若测定结果偏低,则原因可能是( )
A.配制标准溶液的固体KOH中混有KCl杂质
B.滴定到终点时,俯视读数,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂了一滴溶液
A.标准液的c(OH-)偏小,滴定时消耗的V(标) 偏大,导致c(硫酸)偏高;
B.滴定终点时俯视读数,使读取的标准液体积偏小,测定的c(硫酸)偏低;
C.用未知液润洗锥形瓶,滴定时消耗的V(标) 偏大,测定的c(硫酸)偏高;
D.尖嘴处悬挂溶液,使读取的V(标)偏大,测定c(硫酸)偏高。
大
小
B
随堂练习
2.某同学欲用已知物质的量浓度为0.100 0 mol/L的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。结合下表数据,计算被测氢氧化钠溶液的物质的量浓度。
滴定 次数 待测溶液 体积/mL 标准酸溶液体积
滴定前的刻度/mL 滴定后的刻度/mL
第一次 10.00 3.20 20.30
第二次 10.00 4.10 21.10
第三次 10.00 0.40 17.60
V(HCl)
17.10
17.00
17.20
)==17.10 mL
对于一元酸与碱反应时:c(H+)·V(酸)=c(OH-)·V(碱)
0.100 0 mol/L · 0.017 10 L=c(OH-)· 0.010 00 L
c(OH-)=0.171 0 mol/L
随堂练习
本节内容结束
