2.2.1 化学平衡状态的建立 课件(共19张PPT)-高二化学人教版选择性必修1课件
文档属性
| 名称 | 2.2.1 化学平衡状态的建立 课件(共19张PPT)-高二化学人教版选择性必修1课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 28.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 21:22:25 | ||
图片预览






文档简介
(共19张PPT)
第二章
化学反应速率与化学平衡
第二节
化学平衡
第 1课时
化学平衡状态的建立
教 学 目 标
核 心 素 养
1.了解化学反应的可逆性,理解可逆反应的特征。
2.从可逆反应化学平衡状态的建立过程,结合图像理解化学平衡是一种动态平衡。
熟知化学平衡状态的特征,建立化学平衡状态判断方 法的思维模型,培养学生证据推理与模型认知的化学核心素养。
你知道吗?
高炉炼铁的主要反应:
从炼铁炉口排出的尾气中含有一定量的CO。
100多年前,人们认为是由于CO和铁矿石接
触时间不够,曾耗费巨资改建高炉,以延长
反应物接触时间,结果尾气中的CO含量没有
减少,你知道这是什么原因吗?如何改进?
Fe2O3+3CO ==== 2Fe+3CO2
高温
反应可逆
一、可逆反应
1.概念
双同性:正逆反应在相同的条件下,同时进行
NH3+H2O
NH3·H2O
+OH-
在相同条件下,能同时向正、逆反应方向进行的化学反应称为可逆反应。
双向性:可逆反应分为方向相反的两个方向,正反应方向和逆反应方向
共存性:反应物转化率小于100%,反应物与生成物共存
2.特征
例1.可逆反应:2SO2(g)+O2(g) 2SO3(g),充入由18O组成的氧气一段时间后,18O存在下列物质中的 ( )
A.多余的氧气中
B.生成的三氧化硫中
C.氧气和二氧化硫中
D.二氧化硫、氧气和三氧化硫中
理解应用
解析 18O2的加入定会与SO2结合生成含18O的SO3,同时含有18O的SO3又会分解得到SO2和O2,使得SO2和O2中也含有18O,因此18O存在于SO2、O2、SO3这三种物质中。
D
科学· 技术· 社会
工业合成氨
氨气在国民经济中占有重要地位,
随着人类社会的发展,对氨的需求量日益增长。
如何提高生产效率呢?只要尽力提高化学反应速率生产效率就一定高吗?
2NH3
N2 + 3H2
催化剂
高温、高压
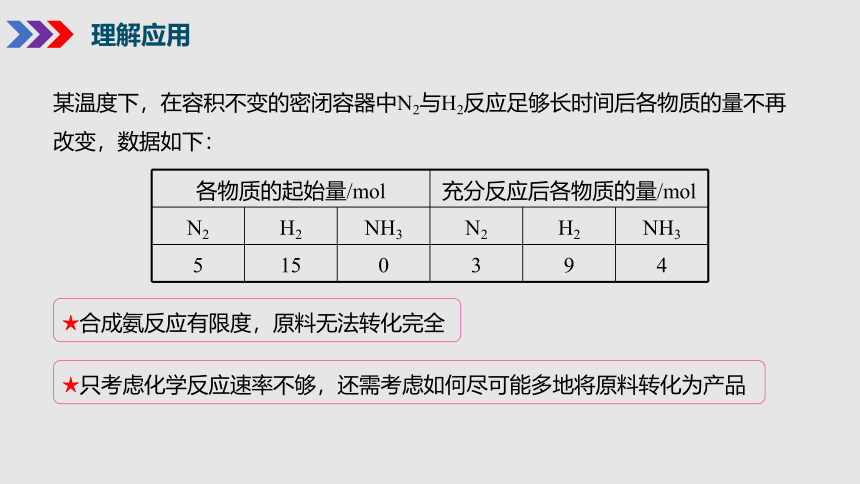
理解应用
各物质的起始量/mol 充分反应后各物质的量/mol
N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
某温度下,在容积不变的密闭容器中N2与H2反应足够长时间后各物质的量不再改变,数据如下:
★合成氨反应有限度,原料无法转化完全
★只考虑化学反应速率不够,还需考虑如何尽可能多地将原料转化为产品
二、化学平衡的建立
合成氨反应中有关物质的浓度随时间变化示意图
2NH3
N2 + 3H2
催化剂
高温、高压
任何可逆反应在一定条件下都存在反应的限度。达到限度时,反应就停止了吗?
正向: N2 + 3H2 2NH3
逆向:2NH3 N2 + 3H2
理解应用
该可逆反应中包含两个反应,两个反应同时发生
当正、逆反应速率相等时,达到看似不变的“表面静止”状态,但实际反应并未停止,一直在进行中。
v正
v逆
v正= v逆
反应时间
反应速率
化学平衡
t0
≠0
正向: N2 + 3H2 2NH3
逆向:2NH3 N2 + 3H2
三、化学平衡的特征
正反应速率
逆反应速率
相等
时间
速率
逆
等
动
定
变
——研究对象为可逆反应
——v正= v逆≠0
——正逆反应速率相等
——平衡混合物中,各组分的百分含量保持一定
——外界条件改变,化学平衡状态可能发生改变
理解应用
例2.可逆反应:N2(g)+3H2(g) 2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
C
解析 可逆反应达到化学平衡状态的主要特征之一是v正=v逆,
A.3v正(N2)=v正(H2),均为v正,并未体现v正=v逆的关系,错误;
在N2与H2合成NH3的反应中,v(N2)∶v(H2)∶v(NH3)=1∶3∶2,转化成反应体系中同一物质速率考虑。
B.v逆(NH3)=2v逆(N2), v正(N2) ≠ v逆(N2),未平衡;
C.3v逆(NH3) =2v逆(H2) , 2 v正(H2) =2v逆(H2),已达平衡;
D.3v逆(H2)=9v逆(N2),v正(N2) ≠ v逆(N2),未平衡。
四、化学平衡状态的判定
判断方法:反应中“变化的量”“不变”时,即达到化学平衡状态
v正
v逆
v正= v逆≠0
t
v
等
动
定
——v正= v逆≠0
——正逆反应速率相等
——平衡混合物中,各组分的百分含量保持一定
可以判断反应已达到化学平衡状态的是_______。
理解应用
BC
例3.一定温度下,在容积不变的密闭容器中进行合成氨反应,
A.单位时间内消耗 a mol N2,同时生成 2a mol NH3
B.H2的消耗速率等于N2生成速率的3倍 C.容器内的压强不再变化
D.混合气体的总质量不再变化 E.混合气体的密度不再变化
v正(N2)
v正(NH3)
v正(H2)
v逆(N2)
N2(g) + 3H2(g) 2NH3(g),
解析 判断方法“变量不变”。
A、B.变量是速率, v正=v逆达平衡,A中均为v正无法判断;
v正(H2)=3v逆(N2), ∵ 3v逆(N2)=v逆(H2 ),∴B平衡;
C.变量是压强,正反应方向压强减小,当压强不变证明已达平衡;
D.体系中反应物、生成物均为气体,总质量为定量,无法判断;
E.ρ容器体积不变,则混合气体体积不变,且气体质量也不变, ρ为定值,无法判断。
随堂练习
1.在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能是 ( )
A.SO2、O2分别为0.4 mol/L 、0.2 mol/L B.SO2为0.25 mol/L
C.SO2为0.24 mol/L ,SO3为0.14 mol/L D.SO2、SO3均为0.15 mol/L
解析 用极限法。可逆反应不可能进行到底,假设反应由正反应或逆反应开始建立。
A.0.2 mol/L SO3全部转化时,SO2和O2浓度才是0.4 mol/L 、0.2 mol/L ;
B.SO2的浓度应在0~0.4 mol/L之间;
根据S元素守恒,SO2和SO3浓度之和应为0.4 mol/L ,C、D两项均错误。
B
2.一定温度下,反应N2O4(g) 2NO2(g)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )
A.①② B.②④ C.③④ D.①④
D
随堂练习
解析 判断方法“变量不变”。
① ρ
②焓变为ΔH为定量;
③通过v正=v逆才能判断,③中只有v正,无法判断;
④浓度是变量,不变证明已达平衡。
本节内容结束
第二章
化学反应速率与化学平衡
第二节
化学平衡
第 1课时
化学平衡状态的建立
教 学 目 标
核 心 素 养
1.了解化学反应的可逆性,理解可逆反应的特征。
2.从可逆反应化学平衡状态的建立过程,结合图像理解化学平衡是一种动态平衡。
熟知化学平衡状态的特征,建立化学平衡状态判断方 法的思维模型,培养学生证据推理与模型认知的化学核心素养。
你知道吗?
高炉炼铁的主要反应:
从炼铁炉口排出的尾气中含有一定量的CO。
100多年前,人们认为是由于CO和铁矿石接
触时间不够,曾耗费巨资改建高炉,以延长
反应物接触时间,结果尾气中的CO含量没有
减少,你知道这是什么原因吗?如何改进?
Fe2O3+3CO ==== 2Fe+3CO2
高温
反应可逆
一、可逆反应
1.概念
双同性:正逆反应在相同的条件下,同时进行
NH3+H2O
NH3·H2O
+OH-
在相同条件下,能同时向正、逆反应方向进行的化学反应称为可逆反应。
双向性:可逆反应分为方向相反的两个方向,正反应方向和逆反应方向
共存性:反应物转化率小于100%,反应物与生成物共存
2.特征
例1.可逆反应:2SO2(g)+O2(g) 2SO3(g),充入由18O组成的氧气一段时间后,18O存在下列物质中的 ( )
A.多余的氧气中
B.生成的三氧化硫中
C.氧气和二氧化硫中
D.二氧化硫、氧气和三氧化硫中
理解应用
解析 18O2的加入定会与SO2结合生成含18O的SO3,同时含有18O的SO3又会分解得到SO2和O2,使得SO2和O2中也含有18O,因此18O存在于SO2、O2、SO3这三种物质中。
D
科学· 技术· 社会
工业合成氨
氨气在国民经济中占有重要地位,
随着人类社会的发展,对氨的需求量日益增长。
如何提高生产效率呢?只要尽力提高化学反应速率生产效率就一定高吗?
2NH3
N2 + 3H2
催化剂
高温、高压
理解应用
各物质的起始量/mol 充分反应后各物质的量/mol
N2 H2 NH3 N2 H2 NH3
5 15 0 3 9 4
某温度下,在容积不变的密闭容器中N2与H2反应足够长时间后各物质的量不再改变,数据如下:
★合成氨反应有限度,原料无法转化完全
★只考虑化学反应速率不够,还需考虑如何尽可能多地将原料转化为产品
二、化学平衡的建立
合成氨反应中有关物质的浓度随时间变化示意图
2NH3
N2 + 3H2
催化剂
高温、高压
任何可逆反应在一定条件下都存在反应的限度。达到限度时,反应就停止了吗?
正向: N2 + 3H2 2NH3
逆向:2NH3 N2 + 3H2
理解应用
该可逆反应中包含两个反应,两个反应同时发生
当正、逆反应速率相等时,达到看似不变的“表面静止”状态,但实际反应并未停止,一直在进行中。
v正
v逆
v正= v逆
反应时间
反应速率
化学平衡
t0
≠0
正向: N2 + 3H2 2NH3
逆向:2NH3 N2 + 3H2
三、化学平衡的特征
正反应速率
逆反应速率
相等
时间
速率
逆
等
动
定
变
——研究对象为可逆反应
——v正= v逆≠0
——正逆反应速率相等
——平衡混合物中,各组分的百分含量保持一定
——外界条件改变,化学平衡状态可能发生改变
理解应用
例2.可逆反应:N2(g)+3H2(g) 2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
C
解析 可逆反应达到化学平衡状态的主要特征之一是v正=v逆,
A.3v正(N2)=v正(H2),均为v正,并未体现v正=v逆的关系,错误;
在N2与H2合成NH3的反应中,v(N2)∶v(H2)∶v(NH3)=1∶3∶2,转化成反应体系中同一物质速率考虑。
B.v逆(NH3)=2v逆(N2), v正(N2) ≠ v逆(N2),未平衡;
C.3v逆(NH3) =2v逆(H2) , 2 v正(H2) =2v逆(H2),已达平衡;
D.3v逆(H2)=9v逆(N2),v正(N2) ≠ v逆(N2),未平衡。
四、化学平衡状态的判定
判断方法:反应中“变化的量”“不变”时,即达到化学平衡状态
v正
v逆
v正= v逆≠0
t
v
等
动
定
——v正= v逆≠0
——正逆反应速率相等
——平衡混合物中,各组分的百分含量保持一定
可以判断反应已达到化学平衡状态的是_______。
理解应用
BC
例3.一定温度下,在容积不变的密闭容器中进行合成氨反应,
A.单位时间内消耗 a mol N2,同时生成 2a mol NH3
B.H2的消耗速率等于N2生成速率的3倍 C.容器内的压强不再变化
D.混合气体的总质量不再变化 E.混合气体的密度不再变化
v正(N2)
v正(NH3)
v正(H2)
v逆(N2)
N2(g) + 3H2(g) 2NH3(g),
解析 判断方法“变量不变”。
A、B.变量是速率, v正=v逆达平衡,A中均为v正无法判断;
v正(H2)=3v逆(N2), ∵ 3v逆(N2)=v逆(H2 ),∴B平衡;
C.变量是压强,正反应方向压强减小,当压强不变证明已达平衡;
D.体系中反应物、生成物均为气体,总质量为定量,无法判断;
E.ρ容器体积不变,则混合气体体积不变,且气体质量也不变, ρ为定值,无法判断。
随堂练习
1.在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g) 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能是 ( )
A.SO2、O2分别为0.4 mol/L 、0.2 mol/L B.SO2为0.25 mol/L
C.SO2为0.24 mol/L ,SO3为0.14 mol/L D.SO2、SO3均为0.15 mol/L
解析 用极限法。可逆反应不可能进行到底,假设反应由正反应或逆反应开始建立。
A.0.2 mol/L SO3全部转化时,SO2和O2浓度才是0.4 mol/L 、0.2 mol/L ;
B.SO2的浓度应在0~0.4 mol/L之间;
根据S元素守恒,SO2和SO3浓度之和应为0.4 mol/L ,C、D两项均错误。
B
2.一定温度下,反应N2O4(g) 2NO2(g)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是( )
A.①② B.②④ C.③④ D.①④
D
随堂练习
解析 判断方法“变量不变”。
① ρ
②焓变为ΔH为定量;
③通过v正=v逆才能判断,③中只有v正,无法判断;
④浓度是变量,不变证明已达平衡。
本节内容结束
