2.2.3 浓度、压强对化学平衡的影响 课件(共27张PPT)--高二化学人教版选择性必修1课件
文档属性
| 名称 | 2.2.3 浓度、压强对化学平衡的影响 课件(共27张PPT)--高二化学人教版选择性必修1课件 | 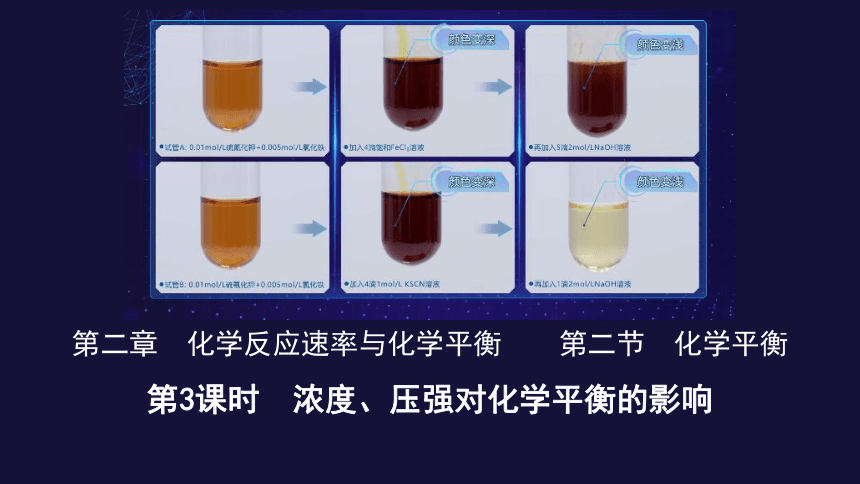 | |
| 格式 | pptx | ||
| 文件大小 | 128.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-31 21:23:46 | ||
图片预览








文档简介
(共27张PPT)
第3课时 浓度、压强对化学平衡的影响
第二章 化学反应速率与化学平衡 第二节 化学平衡
教 学 目 标
核 心 素 养
1.理解化学平衡移动的概念;
2.掌握化学平衡移动的影响因素;
3.运用勒夏特列原理分析化学平衡移动的方向。
通过分析浓度、压强等对化学平衡影响的实验,培养学生证据推理与模型认知的化学核心素养。
科学·技术·社会
为什么火灾逃生时,为了防止烟雾中毒,预防窒息,可用湿毛巾等蒙鼻、匍匐撤离到通风较好的地方或吸氧呢
在火灾现场,人的呼吸存在下述反应:
(血液中的血红蛋白用Hb表示)
实验表明,空气中的CO浓度较大时,人体就感到恶心、胸闷。当过多的血红蛋白与一氧化碳结合时,就会因窒息而引起死亡。
CO + Hb·O2 O2 + Hb·CO
减少CO吸入量
增大O2吸入量
促进平衡逆向移动
知识回顾
化学平衡状态的特征
等
动
变
——正逆反应速率相等
——外界条件改变,化学平衡状态可能发生改变
正反应速率
逆反应速率
相等
时间
速率
——v正= v逆≠0
任务一 探讨影响化学平衡的因素
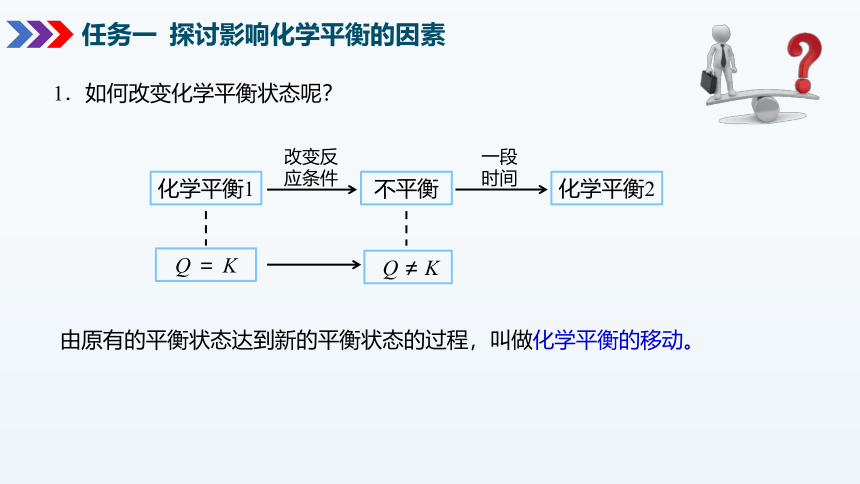
化学平衡1
Q = K
改变反
应条件
不平衡
Q ≠ K
一段时间
化学平衡2
1.如何改变化学平衡状态呢?
由原有的平衡状态达到新的平衡状态的过程,叫做化学平衡的移动。
2.改变哪些反应条件可使Q ≠ K,从而改变化学平衡状态?
① 改变浓度,使Q发生改变
② 改变温度,使K发生改变
☆ 浓度商只与浓度有关,平衡常数只与温度有关。
任务一 探讨影响化学平衡的因素
运用浓度商与平衡常数比较判断化学平衡移动的方向
向正反应方向移动
向逆反应方向移动
Q = K
任意时刻的浓度商
Q =
cp(C)·cq(D)
cm(A)·cn(B)
Q < K
Q > K
平衡状态
温故知新
m A(g) + n B(g) p C(g) + q D(g)
若其他条件不变,仅增加反应物的浓度,化学平衡如何移动?
任意时刻的浓度商
Q =
m A(g) + n B(g) p C(g) + q D(g)
增大反应物浓度
Q 减小
K不变
Q < K
平衡向正反应方向移动
1.理论分析:
请自我分析减小生成物浓度,化学平衡如何移动?
任务二 探讨浓度对化学平衡的影响
实验1.浓度对化学平衡的影响
2.实验验证
实验原理
变量控制
实验操作
Fe3+(黄色) + 3SCN-(无色) Fe(SCN)3(红色)
5 mL 0.01 mol·L-1
KSCN溶液
5 mL 0.005 mol·L-1
FeCl3溶液
①加4滴饱和 FeCl3溶液
②加4滴1 mol·L-1 KSCN溶液
③在①中加5滴2 mol·L-1 NaOH溶液
④在②中加1滴1 mol·L-1 NaOH溶液
温度等其他因素不变,只改变一种物质的浓度
实验1.浓度对化学平衡的影响
实验操作 ①加4滴饱和 FeCl3溶液 ②加4滴1 mol·L-1 KSCN溶液
现象 与结论
理论分析
Fe3+(黄色) + 3SCN-(无色) Fe(SCN)3(红色)
溶液颜色加深
溶液颜色加深
问题1:为什么加饱和的FeCl3溶液或1 mol/L KSCN溶液能生成更多的Fe(SCN)3
c(Fe3+)或c(SCN-)增大,Q减小,
Q=
K不变,Q<K,平衡正向移动
交流讨论
实验操作 ③在①中加5滴2 mol·L-1 NaOH溶液 ④在②中加1滴1 mol·L-1 NaOH溶液
现象 与结论
理论分析
3OH-+Fe3+===Fe(OH)3↓
溶液颜色变浅
溶液颜色变浅
c(Fe3+)减小,Q增大,
K不变,Q>K,平衡逆向移动。
Fe3+(黄色) + 3SCN-(无色) Fe(SCN)3(红色)
交流讨论
问题2:还能怎么改变浓度使平衡正向移动呢
改变条件 平衡移动 移动结果
①
②
c(反应物) 增大
c(生成物)减小
c(反应物)减小
c(生成物)增大
减小c(反应物)
增大c(生成物)
增大c(反应物)
减小c(生成物)
Fe3+(黄色) + 3SCN-(无色) Fe(SCN)3(红色)
平衡向正反应方向移动
平衡向逆反应方向移动
交流讨论
一、浓度对化学平衡的影响
增大生成物的浓度或减小反应物浓度→ Q>K →平衡向逆反应方向移动。
增大反应物浓度或减小生成物的浓度→ Q<K →平衡向正反应方向移动;
其他条件不变时,
归纳总结
压强的改变,可能影响反应体系中多种物质的浓度。
如果增大压强(缩小容积),以下反应各物质的浓度会如何变化?
浓度商会如何变化?
红棕色
无色
2NO2(g) N2O4(g)
任务三 探讨压强对化学平衡的影响
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4
原化学平衡容器容积为V p1 a b
扩大容积至2V 时
p1
a
b
Q1=K
Q2=K
☆通过计算Q2 =2 K, 即Q2 > K ,平衡逆向移动。
理论分析:
任务三 探讨压强对化学平衡的影响
红棕色
无色
2NO2(g) N2O4(g)
实验2.压强对化学平衡的影响
实验验证:
快速推动至10 mL处
压强p1 =2p0
快速拉动至20 mL处
压强p2 = p1
20 mL NO2(g)
压强p0
实验2.压强对化学平衡的影响
实验 (同温度下) 压强变化 平衡 移动方向 c(NO2)变化 气体颜色变化
原平衡气体20 mL p0 —— —— ——
压缩至10 mL
扩大至20 mL
p0< p1 < 2p0
p1< p2< p1
先增大后减小
先减小后增大
红棕色
无色
2NO2(g) N2O4(g)
请用平衡常数解释上述平衡移动规律。
交流讨论
正向移动
c0< c1 < 2c0
先加深再变浅
逆向移动
c1< c2< c1
先变浅再加深
改变条件 平衡移动 移动结果
①
②
c(反应物)增大
c(生成物)减小
c(反应物)减小
c(生成物)增大
减小c(反应物)
增大c(生成物)
增大c(反应物)
减小c(生成物)
p 增大
p 减小
向气体分子数减小的方向移动
减小 p
向气体分子数增大的方向移动
增大 p
移
动
削
弱
改
变
向正反应方向移动
向逆反应方向移动
交流讨论
增大压强(减小容器的容积),会使化学平衡向气体体积缩小的方向移动;
减小压强(增大容器的容积),会使平衡向气体体积增大的方向移动。
二、压强对化学平衡的影响
归纳总结
其他条件不变时,
1.是否压强改变时,平衡一定能移动呢?
2.对于H2(g)+ I2(g) 2HI(g) 当其他条件不变,减小或增大容器容积来改变压强时,化学平衡如何变化呢?
提示:用平衡常数和浓度商定量判断
深度思考
☆对于反应前后气体物质的总体积没有变化的可逆反应,压强改变不能使化学
平衡发生移动。
3.对于只有固体或液体参加的反应,体系压强的改变会使化学平衡移动吗?
深度思考
☆固态或液态物质的体积受压强影响很小,可以忽略不计。当平衡混合物中都
是固态或液态物质时,改变压强后化学平衡一般不发生移动。
一、浓度对化学平衡的影响
增大生成物的浓度或减小反应物浓度→ Q>K→平衡向逆反应方向移动。
增大反应物浓度或减小生成物的浓度→Q<K→平衡向正反应方向移动;
其他条件不变时,
增大压强(减小容器的容积),会使化学平衡向气体体积缩小的方向移动;
二、压强对化学平衡的影响
减小压强(增大容器的容积),会使平衡向气体体积增大的方向移动。
其他条件不变时,
课堂小结
1.在新制的氯水中存在平衡:Cl2+H2O H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是 ( )
A.H+浓度减小,HClO浓度减小 B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大 D.H+浓度增大,HClO浓度减小
C
解析 酸性: HClO2HCl+CaCO3=== CaCl2 + CO2 ↑+ H2O,而不与次氯酸反应。
又由于c(H+) 减小,Cl2+H2O H++Cl-+HClO,平衡向正反应方向移动, c(HClO) 增大。
随堂练习
2.在恒温恒容的条件下,反应:A(g)+B(g) C(g)+D(s)已达平衡,能使平衡正向移动的措施是 ( )
A.减小C或D的浓度 B.增大D的浓度
C.减小B的浓度 D.增大A或B的浓度
解析 增大反应物的浓度或减小生成物的浓度都可以使平衡向正反应方向移动。
本题中物质D是固体,其浓度是常数,因此改变物质D的量对平衡无影响,D项正确。
D
随堂练习
本节内容结束
第3课时 浓度、压强对化学平衡的影响
第二章 化学反应速率与化学平衡 第二节 化学平衡
教 学 目 标
核 心 素 养
1.理解化学平衡移动的概念;
2.掌握化学平衡移动的影响因素;
3.运用勒夏特列原理分析化学平衡移动的方向。
通过分析浓度、压强等对化学平衡影响的实验,培养学生证据推理与模型认知的化学核心素养。
科学·技术·社会
为什么火灾逃生时,为了防止烟雾中毒,预防窒息,可用湿毛巾等蒙鼻、匍匐撤离到通风较好的地方或吸氧呢
在火灾现场,人的呼吸存在下述反应:
(血液中的血红蛋白用Hb表示)
实验表明,空气中的CO浓度较大时,人体就感到恶心、胸闷。当过多的血红蛋白与一氧化碳结合时,就会因窒息而引起死亡。
CO + Hb·O2 O2 + Hb·CO
减少CO吸入量
增大O2吸入量
促进平衡逆向移动
知识回顾
化学平衡状态的特征
等
动
变
——正逆反应速率相等
——外界条件改变,化学平衡状态可能发生改变
正反应速率
逆反应速率
相等
时间
速率
——v正= v逆≠0
任务一 探讨影响化学平衡的因素
化学平衡1
Q = K
改变反
应条件
不平衡
Q ≠ K
一段时间
化学平衡2
1.如何改变化学平衡状态呢?
由原有的平衡状态达到新的平衡状态的过程,叫做化学平衡的移动。
2.改变哪些反应条件可使Q ≠ K,从而改变化学平衡状态?
① 改变浓度,使Q发生改变
② 改变温度,使K发生改变
☆ 浓度商只与浓度有关,平衡常数只与温度有关。
任务一 探讨影响化学平衡的因素
运用浓度商与平衡常数比较判断化学平衡移动的方向
向正反应方向移动
向逆反应方向移动
Q = K
任意时刻的浓度商
Q =
cp(C)·cq(D)
cm(A)·cn(B)
Q < K
Q > K
平衡状态
温故知新
m A(g) + n B(g) p C(g) + q D(g)
若其他条件不变,仅增加反应物的浓度,化学平衡如何移动?
任意时刻的浓度商
Q =
m A(g) + n B(g) p C(g) + q D(g)
增大反应物浓度
Q 减小
K不变
Q < K
平衡向正反应方向移动
1.理论分析:
请自我分析减小生成物浓度,化学平衡如何移动?
任务二 探讨浓度对化学平衡的影响
实验1.浓度对化学平衡的影响
2.实验验证
实验原理
变量控制
实验操作
Fe3+(黄色) + 3SCN-(无色) Fe(SCN)3(红色)
5 mL 0.01 mol·L-1
KSCN溶液
5 mL 0.005 mol·L-1
FeCl3溶液
①加4滴饱和 FeCl3溶液
②加4滴1 mol·L-1 KSCN溶液
③在①中加5滴2 mol·L-1 NaOH溶液
④在②中加1滴1 mol·L-1 NaOH溶液
温度等其他因素不变,只改变一种物质的浓度
实验1.浓度对化学平衡的影响
实验操作 ①加4滴饱和 FeCl3溶液 ②加4滴1 mol·L-1 KSCN溶液
现象 与结论
理论分析
Fe3+(黄色) + 3SCN-(无色) Fe(SCN)3(红色)
溶液颜色加深
溶液颜色加深
问题1:为什么加饱和的FeCl3溶液或1 mol/L KSCN溶液能生成更多的Fe(SCN)3
c(Fe3+)或c(SCN-)增大,Q减小,
Q=
K不变,Q<K,平衡正向移动
交流讨论
实验操作 ③在①中加5滴2 mol·L-1 NaOH溶液 ④在②中加1滴1 mol·L-1 NaOH溶液
现象 与结论
理论分析
3OH-+Fe3+===Fe(OH)3↓
溶液颜色变浅
溶液颜色变浅
c(Fe3+)减小,Q增大,
K不变,Q>K,平衡逆向移动。
Fe3+(黄色) + 3SCN-(无色) Fe(SCN)3(红色)
交流讨论
问题2:还能怎么改变浓度使平衡正向移动呢
改变条件 平衡移动 移动结果
①
②
c(反应物) 增大
c(生成物)减小
c(反应物)减小
c(生成物)增大
减小c(反应物)
增大c(生成物)
增大c(反应物)
减小c(生成物)
Fe3+(黄色) + 3SCN-(无色) Fe(SCN)3(红色)
平衡向正反应方向移动
平衡向逆反应方向移动
交流讨论
一、浓度对化学平衡的影响
增大生成物的浓度或减小反应物浓度→ Q>K →平衡向逆反应方向移动。
增大反应物浓度或减小生成物的浓度→ Q<K →平衡向正反应方向移动;
其他条件不变时,
归纳总结
压强的改变,可能影响反应体系中多种物质的浓度。
如果增大压强(缩小容积),以下反应各物质的浓度会如何变化?
浓度商会如何变化?
红棕色
无色
2NO2(g) N2O4(g)
任务三 探讨压强对化学平衡的影响
实验 (同温度下) 压强 各物质浓度 (mol·L-1) 浓度商
(Q )
NO2 N2O4
原化学平衡容器容积为V p1 a b
扩大容积至2V 时
p1
a
b
Q1=K
Q2=K
☆通过计算Q2 =2 K, 即Q2 > K ,平衡逆向移动。
理论分析:
任务三 探讨压强对化学平衡的影响
红棕色
无色
2NO2(g) N2O4(g)
实验2.压强对化学平衡的影响
实验验证:
快速推动至10 mL处
压强p1 =2p0
快速拉动至20 mL处
压强p2 = p1
20 mL NO2(g)
压强p0
实验2.压强对化学平衡的影响
实验 (同温度下) 压强变化 平衡 移动方向 c(NO2)变化 气体颜色变化
原平衡气体20 mL p0 —— —— ——
压缩至10 mL
扩大至20 mL
p0< p1 < 2p0
p1< p2< p1
先增大后减小
先减小后增大
红棕色
无色
2NO2(g) N2O4(g)
请用平衡常数解释上述平衡移动规律。
交流讨论
正向移动
c0< c1 < 2c0
先加深再变浅
逆向移动
c1< c2< c1
先变浅再加深
改变条件 平衡移动 移动结果
①
②
c(反应物)增大
c(生成物)减小
c(反应物)减小
c(生成物)增大
减小c(反应物)
增大c(生成物)
增大c(反应物)
减小c(生成物)
p 增大
p 减小
向气体分子数减小的方向移动
减小 p
向气体分子数增大的方向移动
增大 p
移
动
削
弱
改
变
向正反应方向移动
向逆反应方向移动
交流讨论
增大压强(减小容器的容积),会使化学平衡向气体体积缩小的方向移动;
减小压强(增大容器的容积),会使平衡向气体体积增大的方向移动。
二、压强对化学平衡的影响
归纳总结
其他条件不变时,
1.是否压强改变时,平衡一定能移动呢?
2.对于H2(g)+ I2(g) 2HI(g) 当其他条件不变,减小或增大容器容积来改变压强时,化学平衡如何变化呢?
提示:用平衡常数和浓度商定量判断
深度思考
☆对于反应前后气体物质的总体积没有变化的可逆反应,压强改变不能使化学
平衡发生移动。
3.对于只有固体或液体参加的反应,体系压强的改变会使化学平衡移动吗?
深度思考
☆固态或液态物质的体积受压强影响很小,可以忽略不计。当平衡混合物中都
是固态或液态物质时,改变压强后化学平衡一般不发生移动。
一、浓度对化学平衡的影响
增大生成物的浓度或减小反应物浓度→ Q>K→平衡向逆反应方向移动。
增大反应物浓度或减小生成物的浓度→Q<K→平衡向正反应方向移动;
其他条件不变时,
增大压强(减小容器的容积),会使化学平衡向气体体积缩小的方向移动;
二、压强对化学平衡的影响
减小压强(增大容器的容积),会使平衡向气体体积增大的方向移动。
其他条件不变时,
课堂小结
1.在新制的氯水中存在平衡:Cl2+H2O H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是 ( )
A.H+浓度减小,HClO浓度减小 B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大 D.H+浓度增大,HClO浓度减小
C
解析 酸性: HClO
又由于c(H+) 减小,Cl2+H2O H++Cl-+HClO,平衡向正反应方向移动, c(HClO) 增大。
随堂练习
2.在恒温恒容的条件下,反应:A(g)+B(g) C(g)+D(s)已达平衡,能使平衡正向移动的措施是 ( )
A.减小C或D的浓度 B.增大D的浓度
C.减小B的浓度 D.增大A或B的浓度
解析 增大反应物的浓度或减小生成物的浓度都可以使平衡向正反应方向移动。
本题中物质D是固体,其浓度是常数,因此改变物质D的量对平衡无影响,D项正确。
D
随堂练习
本节内容结束
