1.3.2 氧化剂 还原剂 课件(共27张PPT)-2024届高一化学(人教版2019必修第一册)
文档属性
| 名称 | 1.3.2 氧化剂 还原剂 课件(共27张PPT)-2024届高一化学(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-01 14:33:21 | ||
图片预览








文档简介
(共27张PPT)
第3节 氧化还原反应
第1课时 氧化剂 还原剂
第一章 物质及其变化
1.通过分析物质所含元素的化合价,认识氧化还原反应的特征,能够对常见的化学反应进行分类。
2.认识到氧化还原反应在生产生活中的普遍存在,能够运用氧化还原反应的有关理论解决有关问题。
3.能利用氧化还原反应概念判断物质的氧化性和还原性,归纳常见的氧化剂和还原剂。
学习目标
氧化剂和还原剂的概念
氧化还原反应相关概念之间的联系
氧化剂和还原剂的概念
氧化还原反应相关概念之间的联系
本节重难点
本节重点
本节难点
氧化还原反应广泛存在于生产生活中
资料卡片
金属冶炼
光合作用
燃烧
Q:月饼盒中的食品脱氧剂有什么用途?
脱氧剂主要成分:铁粉
脱氧剂发生的反应:
4 Fe + 3O2 + xH2O == 2Fe2O3·xH2O
资料卡片
根据氧化还原反应的特征,元素化合价的变化,分析上述反应的元素化合价变化情况。
4 Fe + 3O2 + xH2O == 2Fe2O3·xH2O
铁元素的化合价:
氧元素的化合价:
0 → +3
0 → -2
化合价升高,铁元素被氧化
化合价降低,氧元素被还原
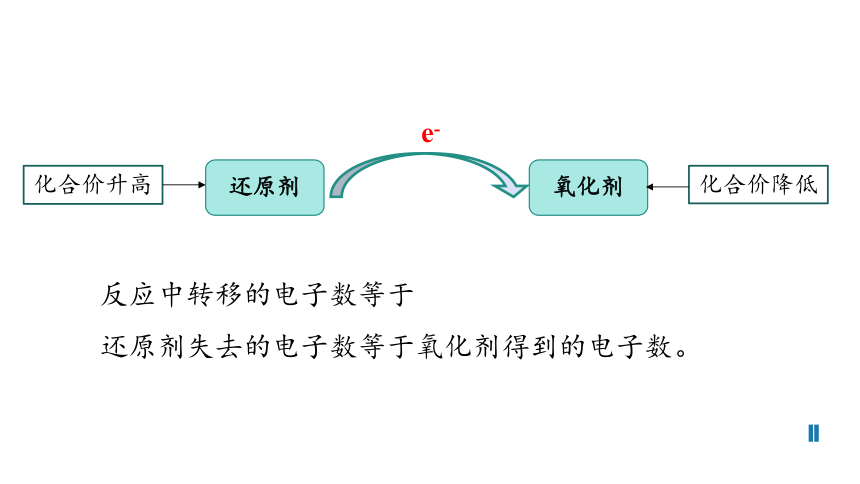
还原剂
氧化剂
还原剂
氧化剂
在反应时,所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
在反应时,所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
1.氧化剂具有氧化性,反应时使物质氧化,本身被还原。
2.还原剂具有还原性,反应时使物质还原,本身被氧化。
Q1:元素价态与物质的氧化性、还原性有什么联系?
Q2:电子转移与物质的氧化性、还原性有什么联系?
e-
反应中转移的电子数等于
还原剂失去的电子数等于氧化剂得到的电子数。
还原剂
氧化剂
化合价升高
化合价降低
高温
氧化剂
还原剂
( )产物
( )产物
2Fe + CuSO4 2FeSO4 + Cu
+2
0
0
+2
氧化
还原
低价 高价
高价 低价
高价氧化,低价还原。
氧化产物
还原产物
还原剂发生氧化反应后的生成物
氧化剂发生还原反应后的生成物
氧化性
还原性
物质得到电子的能力
物质失去电子的能力
氧化剂
氧化性
还原反应
还原产物
还原剂
还原性
氧化反应
氧化产物
具有
生成
发生
发生
生成
具有
化合价降低
被还原
化合价升高
被氧化
Q:如何判断某物质在反应中是氧化剂是还原剂?
分析中心元素
确定中心元素
了解中心元素常见价态
判断中心元素变价趋势
思考为什么KMnO4做氧化剂?
常见的氧化剂和还原剂
氧化剂
活泼金属单质
含低价态元素的物质
部分非金属单质
Na、Mg、Al
H2S、HI
H2、C
常见的氧化剂和还原剂
还原剂
含高价态元素的物质
部分非金属单质
HNO3、FeCl3
O2、Cl2
Q:如何判断物质的氧化性、还原性强弱呢?
Fe+Cu2+ Fe2+ +Cu
失去1×2e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
氧化性:Cu2+> Fe2+
还原性:Fe > Cu
0
0
+1
+2
强氧化剂+强还原剂 弱氧化剂+弱还原剂
分析下列反应,HCl在反应中体现了其什么化学性质?
体现还原性
体现氧化性
既体现氧化性又体现还原性
①MnO2 + 4HCl(浓) MnCl2 + Cl2 + 2H2O
②Zn + 2HCl ZnCl2 + H2
③2HCl Cl2 + H2
△
通电
汽车尾气系统中安装了催化转化器(见图),在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下转化成了无毒的CO2和N2。涉及化学反应分别是:
①2NO+2CO === 2CO2+N2
②2NO+O2 === 2NO2
催化剂
1.反应①、②是否都是氧化还原反应?若是,请指出反应中的氧化剂和还原剂。
2.反应①、②中的反应物都有NO,NO在两反应中具有的性质相同吗?
都是氧化还原反应;反应①中的氧化剂是NO,还原剂是CO;反应②中氧化剂是O2,还原剂是NO。
不相同;反应①中NO具有氧化性,反应②中NO具有还原性。
1.在氧化还原反应中,下列各组物质均可用作氧化剂的是 ( )
A.F-、I-、S2- B.Fe3+、MnO4-、O2
C.ClO4-、Mg D.Cl2、Fe3+、Al
课堂小练
B
2.在下列氧化还原反应中,溴单质(Br2)既作氧化剂又作还原剂的是 ( )
A.Br2 + 2NaI = 2NaBr + I2
B.2P + 8H2O + 5Br2 = 2H3PO4 + 10HBr ↑
C.3Br2 + 3Na2CO3 = 5NaBr + NaBrO3 + 3CO2↑
D.SO2 + 2H2O + Br2 = H2SO4 + 2HBr
C
课堂小练
过氧化氢在催化剂的作用下可以分解产生氧气,请从物质的分类、性质、物质发生的反应等角度进行分析。
探究活动
氧化剂
还原剂
化合价升高,失去1e- ╳ 2,氧化反应
化合价降低,得到1e- ╳ 2,还原反应
2H2O2
O2
2H2O +
-1 -2 0
课堂小结
氧化剂
氧化性
还原反应
还原产物
还原剂
还原性
氧化反应
氧化产物
具有
生成
发生
发生
生成
具有
化合价降低
被还原
化合价升高
被氧化
课堂小结
分析中心元素
确定中心元素
了解中心元素常见价态
判断中心元素变价趋势
强氧化剂+强还原剂 弱氧化剂+弱还原剂
判断氧化性、还原性的强弱
下节课见!
第3节 氧化还原反应
第1课时 氧化剂 还原剂
第一章 物质及其变化
1.通过分析物质所含元素的化合价,认识氧化还原反应的特征,能够对常见的化学反应进行分类。
2.认识到氧化还原反应在生产生活中的普遍存在,能够运用氧化还原反应的有关理论解决有关问题。
3.能利用氧化还原反应概念判断物质的氧化性和还原性,归纳常见的氧化剂和还原剂。
学习目标
氧化剂和还原剂的概念
氧化还原反应相关概念之间的联系
氧化剂和还原剂的概念
氧化还原反应相关概念之间的联系
本节重难点
本节重点
本节难点
氧化还原反应广泛存在于生产生活中
资料卡片
金属冶炼
光合作用
燃烧
Q:月饼盒中的食品脱氧剂有什么用途?
脱氧剂主要成分:铁粉
脱氧剂发生的反应:
4 Fe + 3O2 + xH2O == 2Fe2O3·xH2O
资料卡片
根据氧化还原反应的特征,元素化合价的变化,分析上述反应的元素化合价变化情况。
4 Fe + 3O2 + xH2O == 2Fe2O3·xH2O
铁元素的化合价:
氧元素的化合价:
0 → +3
0 → -2
化合价升高,铁元素被氧化
化合价降低,氧元素被还原
还原剂
氧化剂
还原剂
氧化剂
在反应时,所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
在反应时,所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
1.氧化剂具有氧化性,反应时使物质氧化,本身被还原。
2.还原剂具有还原性,反应时使物质还原,本身被氧化。
Q1:元素价态与物质的氧化性、还原性有什么联系?
Q2:电子转移与物质的氧化性、还原性有什么联系?
e-
反应中转移的电子数等于
还原剂失去的电子数等于氧化剂得到的电子数。
还原剂
氧化剂
化合价升高
化合价降低
高温
氧化剂
还原剂
( )产物
( )产物
2Fe + CuSO4 2FeSO4 + Cu
+2
0
0
+2
氧化
还原
低价 高价
高价 低价
高价氧化,低价还原。
氧化产物
还原产物
还原剂发生氧化反应后的生成物
氧化剂发生还原反应后的生成物
氧化性
还原性
物质得到电子的能力
物质失去电子的能力
氧化剂
氧化性
还原反应
还原产物
还原剂
还原性
氧化反应
氧化产物
具有
生成
发生
发生
生成
具有
化合价降低
被还原
化合价升高
被氧化
Q:如何判断某物质在反应中是氧化剂是还原剂?
分析中心元素
确定中心元素
了解中心元素常见价态
判断中心元素变价趋势
思考为什么KMnO4做氧化剂?
常见的氧化剂和还原剂
氧化剂
活泼金属单质
含低价态元素的物质
部分非金属单质
Na、Mg、Al
H2S、HI
H2、C
常见的氧化剂和还原剂
还原剂
含高价态元素的物质
部分非金属单质
HNO3、FeCl3
O2、Cl2
Q:如何判断物质的氧化性、还原性强弱呢?
Fe+Cu2+ Fe2+ +Cu
失去1×2e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
氧化性:Cu2+> Fe2+
还原性:Fe > Cu
0
0
+1
+2
强氧化剂+强还原剂 弱氧化剂+弱还原剂
分析下列反应,HCl在反应中体现了其什么化学性质?
体现还原性
体现氧化性
既体现氧化性又体现还原性
①MnO2 + 4HCl(浓) MnCl2 + Cl2 + 2H2O
②Zn + 2HCl ZnCl2 + H2
③2HCl Cl2 + H2
△
通电
汽车尾气系统中安装了催化转化器(见图),在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下转化成了无毒的CO2和N2。涉及化学反应分别是:
①2NO+2CO === 2CO2+N2
②2NO+O2 === 2NO2
催化剂
1.反应①、②是否都是氧化还原反应?若是,请指出反应中的氧化剂和还原剂。
2.反应①、②中的反应物都有NO,NO在两反应中具有的性质相同吗?
都是氧化还原反应;反应①中的氧化剂是NO,还原剂是CO;反应②中氧化剂是O2,还原剂是NO。
不相同;反应①中NO具有氧化性,反应②中NO具有还原性。
1.在氧化还原反应中,下列各组物质均可用作氧化剂的是 ( )
A.F-、I-、S2- B.Fe3+、MnO4-、O2
C.ClO4-、Mg D.Cl2、Fe3+、Al
课堂小练
B
2.在下列氧化还原反应中,溴单质(Br2)既作氧化剂又作还原剂的是 ( )
A.Br2 + 2NaI = 2NaBr + I2
B.2P + 8H2O + 5Br2 = 2H3PO4 + 10HBr ↑
C.3Br2 + 3Na2CO3 = 5NaBr + NaBrO3 + 3CO2↑
D.SO2 + 2H2O + Br2 = H2SO4 + 2HBr
C
课堂小练
过氧化氢在催化剂的作用下可以分解产生氧气,请从物质的分类、性质、物质发生的反应等角度进行分析。
探究活动
氧化剂
还原剂
化合价升高,失去1e- ╳ 2,氧化反应
化合价降低,得到1e- ╳ 2,还原反应
2H2O2
O2
2H2O +
-1 -2 0
课堂小结
氧化剂
氧化性
还原反应
还原产物
还原剂
还原性
氧化反应
氧化产物
具有
生成
发生
发生
生成
具有
化合价降低
被还原
化合价升高
被氧化
课堂小结
分析中心元素
确定中心元素
了解中心元素常见价态
判断中心元素变价趋势
强氧化剂+强还原剂 弱氧化剂+弱还原剂
判断氧化性、还原性的强弱
下节课见!
