人教版化学九年级上册 第六单元 实验活动2 二氧化碳的实验室制取与性质课件(共19张PPT)
文档属性
| 名称 | 人教版化学九年级上册 第六单元 实验活动2 二氧化碳的实验室制取与性质课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 24.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-01 21:39:24 | ||
图片预览




文档简介
(共19张PPT)
实验活动2 二氧化碳的实验室制取与性质
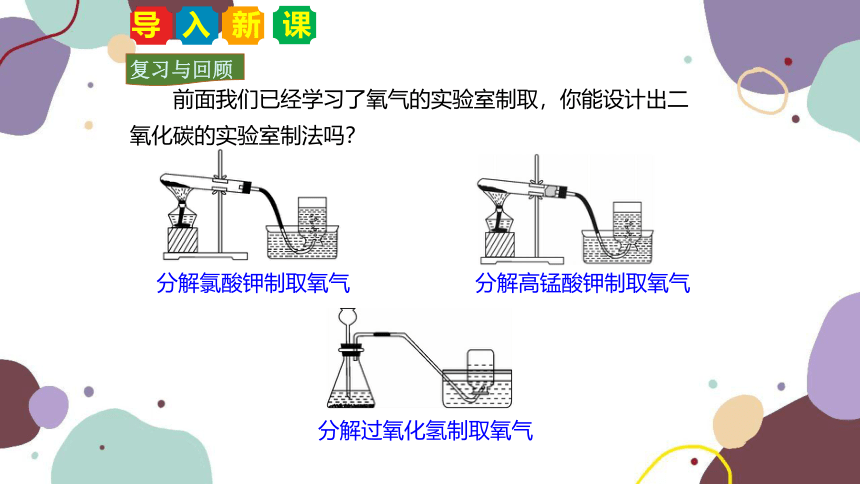
复习与回顾
前面我们已经学习了氧气的实验室制取,你能设计出二氧化碳的实验室制法吗?
分解氯酸钾制取氧气
分解高锰酸钾制取氧气
分解过氧化氢制取氧气
导入新课
使带火星的木条复燃
2KClO3 MnO2 2KCl + 3O2
固体+固体----加热
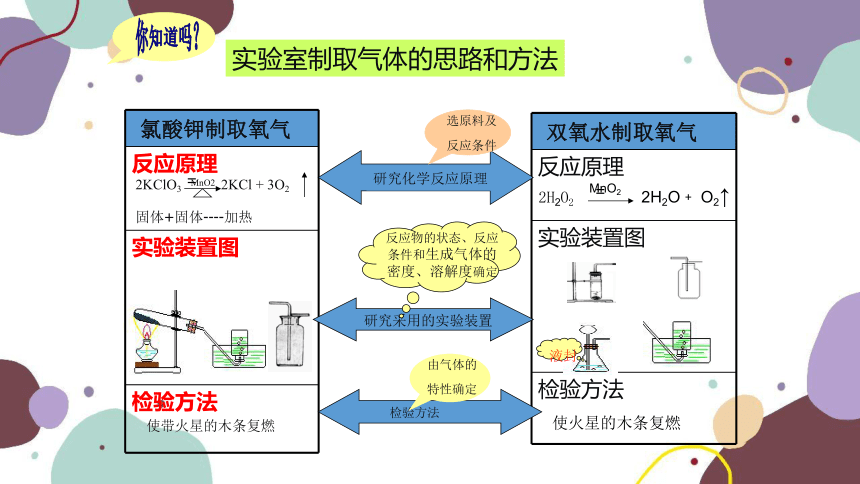
氯酸钾制取氧气
反应原理
实验装置图
检验方法
双氧水制取氧气
反应原理
实验装置图
检验方法
实验室制取气体的思路和方法
研究化学反应原理
选原料及
反应条件
研究采用的实验装置
反应物的状态、反应条件和生成气体的密度、溶解度确定
检验方法
由气体的特性确定
你知道吗?
2H2O2
MnO2
2H2O﹢ O2↑
使火星的木条复燃
液封
=
=
二氧化碳的实验室制取
一
实验与探究
实验目的
1.练习实验室制取二氧化碳和用向上排空气法收集气体。
2.加深对二氧化碳性质的认识。
实验用品
烧杯、集气瓶、量筒、胶头滴管、玻璃导管、胶皮管、单孔橡胶塞、铁架台(带铁夹)、试管、试管夹、玻璃片、酒精灯。大理石(或石灰石)、稀盐酸(1∶2)、澄清石灰水、紫色石蕊溶液。 蜡烛、木条、蒸馏水、火柴
课堂探究
实验与探究
实验步骤
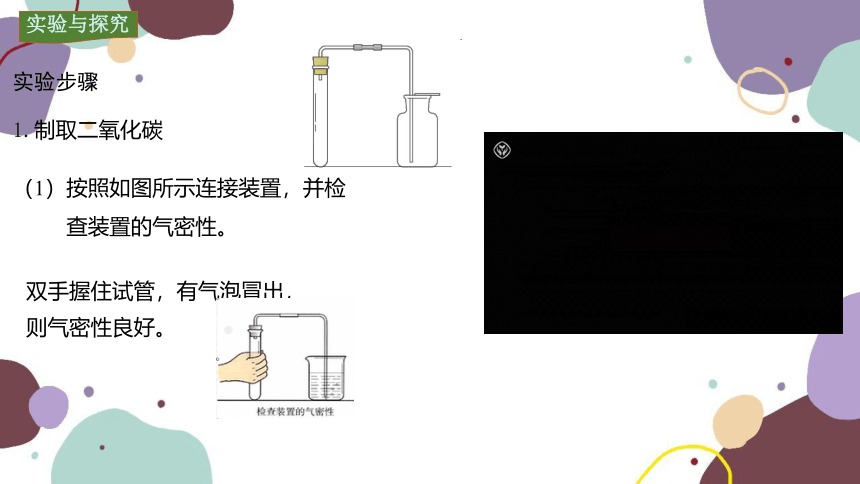
1.制取二氧化碳
(1)按照如图所示连接装置,并检
查装置的气密性。
双手握住试管,有气泡冒出,则气密性良好。
实验与探究
实验步骤
(2)在试管里放入几小块大理石(或石灰石),然后小心地注入15 mL稀盐酸。立即用带有导管的橡胶塞塞住管口,观察试管里发生的现象,以及反应中产生气体的颜色。过一会儿,检查集气瓶中是否已收集满二氧化碳。用玻璃片盖住已收集满二氧化碳的集气瓶,备用。
实验现象
发生剧烈反应,产生大量气泡。
CaCO3+2HCl CaCl2+H2O+CO2↑
思考与交流
如何检验集气瓶是否收集满?
用燃着的木条平放在集气瓶口,木条熄灭,则已收集满。
如何验证集气瓶中收集的气体是二氧化碳?
向集气瓶内加入少量澄清石灰水,振荡,若澄清石灰水变浑浊,则证明所收集的气体为二氧化碳。
二氧化碳的性质
二
实验与探究
(1)把一支短蜡烛固定在烧杯内,点燃。拿起收集满二氧化碳的集气瓶,向烧杯内缓慢倾倒二氧化碳,观察现象。
实验现象
燃着的蜡烛熄灭
实验结论
二氧化碳不燃烧,也不支持燃烧;密度比空气大。
实验与探究
(2)向两支试管中分别加入2mL蒸馏水,然后各滴入1~2滴石蕊溶液,观察试管中溶液的颜色。将其中一支试管静置。向另一支试管中通入二氧化碳,观察现象,并与静置的试管中溶液的颜色进行对比。将通入二氧化碳的试管放在酒精灯火焰上加热,观察现象。
实验与探究
静置的试管 通入CO2的试管
现象
溶液呈紫色
溶液由紫色变成红色
实验与探究
(3)另取一支试管,向其中注入少量澄清石灰水,然后通入二氧化碳,观察现象。
实验现象
澄清石灰水变浑浊
归纳与小结
1.二氧化碳不燃烧,也不支持燃烧。
2.二氧化碳能溶于水,且能与水反应生成能使紫色石蕊溶液变红的碳酸,CO2+H2O H2CO3;
碳酸不稳定,受热易分解,H2CO3 H2O+CO2↑。
3.二氧化碳能使澄清石灰水变浑浊,
Ca(OH)2+CO2 CaCO3↓+H2O 。
实验视频
实验:实验室制取二氧化碳
一、实验室制取二氧化碳
收集、检验、验满的方法
二、二氧化碳的性质
1.二氧化碳不燃烧,也不支持燃烧;
2.二氧化碳能溶于水,碳酸不稳定易分解;
3.二氧化碳能使澄清石灰水变浑浊。
课堂小结
1、同学们设计了如图所示装置来探究二氧化碳的制取和性质,下列关于该实验的叙述正确的是( )
A.移动粗铜丝能控制反应的发生和停止
B.该实验能证明二氧化碳的密度比空气大
C.浸有紫色石蕊试液的棉花会变蓝
D.产生的二氧化碳可用生石灰干燥
A
当堂达标
2、下列关于CO2性质的描述中,正确的是( )
A.CO2能溶于水生成H2CO3
B. CO2具有酸性
C. CO2在一定条件下具有可燃性
D. CO2有毒性
A
3、某班同学在实验室制取二氧化碳,老师观察到了四个同学的如下操作,其中正确的是( )
B
4、实验室制取CO2应选择的装置是( )
A.①③ B.②③
C.②④ D.②⑤
B
5、实验室制取CO2有以下步骤:①连接好装置;②向试管中小心放入几小块石灰石;③向试管中小心注入适量稀盐酸;④检查装置的气密性;⑤收集产生的气体;⑥用燃烧的木条检验集气瓶是否收集满CO2。以上操作按由先至后的顺序排列正确的是( )
A.①②③④⑤⑥ B.①④②③⑤⑥
C.①③②④⑤⑥ D.③①②④⑤⑥
B
实验活动2 二氧化碳的实验室制取与性质
复习与回顾
前面我们已经学习了氧气的实验室制取,你能设计出二氧化碳的实验室制法吗?
分解氯酸钾制取氧气
分解高锰酸钾制取氧气
分解过氧化氢制取氧气
导入新课
使带火星的木条复燃
2KClO3 MnO2 2KCl + 3O2
固体+固体----加热
氯酸钾制取氧气
反应原理
实验装置图
检验方法
双氧水制取氧气
反应原理
实验装置图
检验方法
实验室制取气体的思路和方法
研究化学反应原理
选原料及
反应条件
研究采用的实验装置
反应物的状态、反应条件和生成气体的密度、溶解度确定
检验方法
由气体的特性确定
你知道吗?
2H2O2
MnO2
2H2O﹢ O2↑
使火星的木条复燃
液封
=
=
二氧化碳的实验室制取
一
实验与探究
实验目的
1.练习实验室制取二氧化碳和用向上排空气法收集气体。
2.加深对二氧化碳性质的认识。
实验用品
烧杯、集气瓶、量筒、胶头滴管、玻璃导管、胶皮管、单孔橡胶塞、铁架台(带铁夹)、试管、试管夹、玻璃片、酒精灯。大理石(或石灰石)、稀盐酸(1∶2)、澄清石灰水、紫色石蕊溶液。 蜡烛、木条、蒸馏水、火柴
课堂探究
实验与探究
实验步骤
1.制取二氧化碳
(1)按照如图所示连接装置,并检
查装置的气密性。
双手握住试管,有气泡冒出,则气密性良好。
实验与探究
实验步骤
(2)在试管里放入几小块大理石(或石灰石),然后小心地注入15 mL稀盐酸。立即用带有导管的橡胶塞塞住管口,观察试管里发生的现象,以及反应中产生气体的颜色。过一会儿,检查集气瓶中是否已收集满二氧化碳。用玻璃片盖住已收集满二氧化碳的集气瓶,备用。
实验现象
发生剧烈反应,产生大量气泡。
CaCO3+2HCl CaCl2+H2O+CO2↑
思考与交流
如何检验集气瓶是否收集满?
用燃着的木条平放在集气瓶口,木条熄灭,则已收集满。
如何验证集气瓶中收集的气体是二氧化碳?
向集气瓶内加入少量澄清石灰水,振荡,若澄清石灰水变浑浊,则证明所收集的气体为二氧化碳。
二氧化碳的性质
二
实验与探究
(1)把一支短蜡烛固定在烧杯内,点燃。拿起收集满二氧化碳的集气瓶,向烧杯内缓慢倾倒二氧化碳,观察现象。
实验现象
燃着的蜡烛熄灭
实验结论
二氧化碳不燃烧,也不支持燃烧;密度比空气大。
实验与探究
(2)向两支试管中分别加入2mL蒸馏水,然后各滴入1~2滴石蕊溶液,观察试管中溶液的颜色。将其中一支试管静置。向另一支试管中通入二氧化碳,观察现象,并与静置的试管中溶液的颜色进行对比。将通入二氧化碳的试管放在酒精灯火焰上加热,观察现象。
实验与探究
静置的试管 通入CO2的试管
现象
溶液呈紫色
溶液由紫色变成红色
实验与探究
(3)另取一支试管,向其中注入少量澄清石灰水,然后通入二氧化碳,观察现象。
实验现象
澄清石灰水变浑浊
归纳与小结
1.二氧化碳不燃烧,也不支持燃烧。
2.二氧化碳能溶于水,且能与水反应生成能使紫色石蕊溶液变红的碳酸,CO2+H2O H2CO3;
碳酸不稳定,受热易分解,H2CO3 H2O+CO2↑。
3.二氧化碳能使澄清石灰水变浑浊,
Ca(OH)2+CO2 CaCO3↓+H2O 。
实验视频
实验:实验室制取二氧化碳
一、实验室制取二氧化碳
收集、检验、验满的方法
二、二氧化碳的性质
1.二氧化碳不燃烧,也不支持燃烧;
2.二氧化碳能溶于水,碳酸不稳定易分解;
3.二氧化碳能使澄清石灰水变浑浊。
课堂小结
1、同学们设计了如图所示装置来探究二氧化碳的制取和性质,下列关于该实验的叙述正确的是( )
A.移动粗铜丝能控制反应的发生和停止
B.该实验能证明二氧化碳的密度比空气大
C.浸有紫色石蕊试液的棉花会变蓝
D.产生的二氧化碳可用生石灰干燥
A
当堂达标
2、下列关于CO2性质的描述中,正确的是( )
A.CO2能溶于水生成H2CO3
B. CO2具有酸性
C. CO2在一定条件下具有可燃性
D. CO2有毒性
A
3、某班同学在实验室制取二氧化碳,老师观察到了四个同学的如下操作,其中正确的是( )
B
4、实验室制取CO2应选择的装置是( )
A.①③ B.②③
C.②④ D.②⑤
B
5、实验室制取CO2有以下步骤:①连接好装置;②向试管中小心放入几小块石灰石;③向试管中小心注入适量稀盐酸;④检查装置的气密性;⑤收集产生的气体;⑥用燃烧的木条检验集气瓶是否收集满CO2。以上操作按由先至后的顺序排列正确的是( )
A.①②③④⑤⑥ B.①④②③⑤⑥
C.①③②④⑤⑥ D.③①②④⑤⑥
B
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
