化学人教版(2019)必修第一册1.3.2氧化剂和还原剂 课件(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.2氧化剂和还原剂 课件(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 37.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-01 20:01:53 | ||
图片预览








文档简介
(共26张PPT)
§3.2 氧化剂和还原剂
什么是氧化剂?什么是还原剂?
切开的苹果慢慢变黄腐坏
氧气—氧化剂
食品包装中的
脱氧剂—还原剂
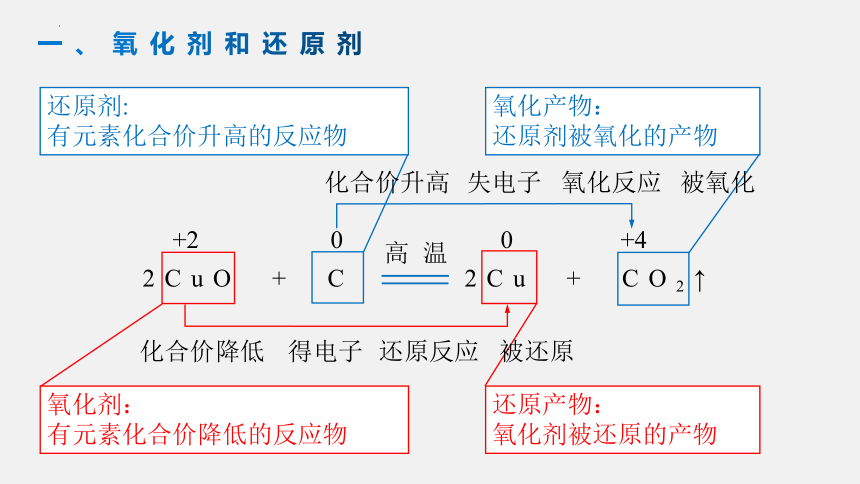
2CuO + C 2Cu + CO2↑
高温
+2
0
化合价降低
还原反应
氧化剂:
有元素化合价降低的反应物
还原产物:
氧化剂被还原的产物
0
+4
还原剂:
有元素化合价升高的反应物
氧化产物:
还原剂被氧化的产物
得电子
化合价升高
被氧化
失电子
被还原
氧化反应
一、氧化剂和还原剂
氧化剂+还原剂=还原产物+氧化产物
失电子(电子对偏离),化合价升高,氧化反应,被氧化
得电子(电子对偏向),化合价降低,还原反应,被还原
(氧化性)
(还原性)
[知识小结]
[记忆口诀]升失氧化还原剂,降得还原氧化剂
分析下列反应,并指出氧化剂、还原剂、氧化产物、还原产物。
SO2 + 2H2S = 3S↓+ 2H2O
Cl2+H2O = HClO+HCl
[点拨]
氧化剂、还原剂可以是同一种物质;
氧化产物、还原产物可以是同一种物质。
[达标检测1]
分析下列反应,并指出氧化剂、还原剂、氧化产物、还原产物。
[点拨]
同一种物质在不同的反应中所起的作用不同。
[达标检测2]
(1)H2O2+H2S = 2H2O+S↓
(2)H2O2+Cl2 = 2HC1+O2
(3)2H2O2 = 2H2O+O2↑
MnO2
H2O2作氧化剂
H2O2作还原剂
H2O2作氧化剂和还原剂
常见氧化剂
某些非金属单质:O2、Cl2、I2、Br2等
含有高价态元素的化合物: 浓H2SO4、HNO3、KMnO4、K2Cr2O7等
某些阳离子:Fe3+、Cu2+、H+、Ag+等
某些过氧化物:Na2O2、H2O2等
具有氧化性,即得电子的能力,表现为化合价降低。
二、常见的氧化剂和还原剂
常见还原剂
具有还原性,即失电子的能力,表现为化合价升高。
活泼的金属单质: 如K、 Na、Mg、Fe、 Al等
某些非金属单质: 如H2、C等
低价态化合物: 如CO、H2S、SO2等
低价态金属阳离子: 如Fe2+、Cu+、等
在MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑反应中
(1)氧化剂为 ,还原产物为 。
(2)被氧化的物质是为 ,发生 反应。
下列元素是被氧化还是被还原,要加氧化剂/还原剂实现?
(1)KI → I2
(2)FeCl3 → FeCl2
(3)KMnO4 → MnO2
(4)Fe → Fe2+
[达标检测3]
[达标检测4]
三、表示方法
1.双线桥法
标价态
标元素化合价,判断升降,算化合价变化值
连双线
一条线:反应物中降价元素→生成物中同种元素
一条线:反应物中升价元素→生成物中同种元素
注得失
标出得(失)电子总数、化合价变化、反应类型
得到 2 × 3e-,化合价降低,被还原
+3 0 0 +3
失去 2 ×3e-,化合价升高,被氧化
单个Fe原子得到3个电子
两个Fe原子
单个Al原子失去3个电子
两个Al原子
[特别提醒]
得电子总数=失电子总数=变价原子数×单个变价的原子得(失)电子数
Fe2O3 + 2Al = 2Fe + 2Al2O3
[经典示例]
注意事项
①箭头、箭尾必须对应变价的同种元素,反应物指向生成物;
②双线桥上必须注明“得到(得)”或“失去(失);
③氧化剂得电子总数=还原剂失电子总数;
④书写电子转移数目时,写成“得(失) a × be-”
a—化合价变化的元素的原子数
b—化合价变化的元素的一个原子的得(失)电子数
+4 -1 +2 0
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
得到1×2e-,
化合价降低,
被还原
被氧化
化合价升高,
失去2 ×e-,
[易错警醒]部分氧化还原反应
[点拨]该反应中,只有一部分氯元素的化合价发生变化,还有一部分氯元素的价态不变,故失去电子数为2×e-,而不是4 ×e-。
0 -1 +1
Cl2+2NaOH=NaCl+NaClO+H2O
得到1×e-,
化合价降低,
被还原
被氧化
化合价升高,
失去1×e-,
[易错警醒]歧化反应
[点拨]该反应中,同一反应物中氯元素化合价既升高又降低,发生氧化反应和还原反应的氯原子个数比为1:1。
-2 +4 0
2H2S + SO2 = 3S↓ + 2H2O
得到1×4e-,
化合价降低,
被还原
被氧化
化合价升高,
失去2×2e-,
[易错警醒]归中反应
[点拨]该反应中,不同反应物中的硫元素化合价既升高又降低,发生氧化反应和还原反应的硫原子个数比为2:1。
KClO3 + 6HCl = KCl + 3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去5×e-,
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
得到 1×5e-,
化合价降低,
被还原
化合价升高,
被氧化
得到 1×6e-,
化合价降低,
被还原
失去6×e-,
化合价升高,
被氧化
[易错警醒]价态不交叉规律
价态不交叉规律:同种元素的不同价态间发生氧化还原反应时,高价态和低价态变成它们相邻的中间价态。
最低价
最高价
中间价
最低价
最高价
中间价
中间价
最低价
最高价
中间价
中间价
只相邻,不交叉
2.2Al + 3CuSO4 = 2Al2(SO4)3 + 3Cu
用双线桥法分析氧化还原反应。
3.3CO + Fe2O3 = 2Fe + 3CO2
4.3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
1.2Fe + 3Cl2 = 2FeCl3
[达标检测5]
2.单线桥法
标价态
标化合价,算变化数
连单线
始于反应物中的升价元素,止于反应物中降价元素
注数目
标出反应中转移的电子总数即可
注意:箭头标明电子转移的方向,还原剂→氧化剂
注意:不需要标明“得到”或“失去”
+3 0 0 +3
6e-
单线桥和双线桥两种表示方法的形式不同,实质相同
——氧化还原反应电子转移关系
Fe2O3 + 2Al = 2Fe + 2Al2O3
[经典示例]
[点拨]反应中,Al失去6e-,化合价升高;Fe得到6e-,化合价降低,电子转移方向由Al指向Fe。
1.Fe + H2SO4 = FeSO4 + H2↑
2.SO2 + 2H2S =3S + 2H2O
3.3NO2 + H2O = 2HNO3 + NO
用单线桥法分析氧化还原反应并指出氧化剂和还原剂。
4.2KClO3 = 2KCl + 3O2↑
[达标检测6]
三、氧化性、还原性强弱的比较
(1)根据氧化还原反应方程式判断
氧化性:Cl2 > Br2
氧 化 性: 氧化剂 > 氧化产物
还 原 性: 还原剂 > 还原产物
[例]Cl2 + 2NaBr = 2NaCl + Br2
氧化剂+还原剂→还原产物 +氧化产物
还原性:Br- >Cl-
(2) 根据元素的价态高低判断
具有变价的元素。
最高价态—只有氧化性
最低价态—只有还原性
中间价态—氧化性和还原性
一般是价态越高,其氧化性越强;价态越低,其还原性越强。
[例]氧化性:Fe3+ >Fe2+ >Fe;
H2SO4(浓) >SO2>S
(3)根据物质的活动性顺序判断
①在金属活动性顺序中,排在左边的金属的还原性强
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)、Cu、Hg、 Ag、Pt、Au
还原性减弱
K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、Sn2+、Pb2+(H+)、Cu2+、 Ag+
氧化性增强
②非金属元素按F、Cl、Br、I、S从左向右的顺序,其单质的氧化性逐渐减
弱,其阴离子的还原性逐渐增强。
氧化性:F2>Cl2> Br2>l2>S 还原性:F-判断H2SO3、I-、Fe2+的还原性由强到弱的顺序是 。
H2SO3 + I2 + H2O = 2HI + H2SO4
2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
H2SO3 > I- > Fe2+
(H2SO3>I-)
( I->Fe2+)
[达标检测7]
[达标检测8]
已知三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓) = 2KCl+2MnCl2+8H2O+5Cl2
(1)Fe3+,I2,MnO4-,Cl2的氧化性由强到弱的顺序是 ;
(2)Fe2+,I-,Mn2+,Cl-的还原性由弱到强的顺序是 ;
还原剂
化合价升高
氧化产物
失e-
被氧化,发生氧化反应
氧化剂
化合价降低
还原产物
得e-
被还原,发生还原反应
反
应
物
生成物
电子得失的总数相等
化合价升降总数相等
=
[课堂小结]
§3.2 氧化剂和还原剂
什么是氧化剂?什么是还原剂?
切开的苹果慢慢变黄腐坏
氧气—氧化剂
食品包装中的
脱氧剂—还原剂
2CuO + C 2Cu + CO2↑
高温
+2
0
化合价降低
还原反应
氧化剂:
有元素化合价降低的反应物
还原产物:
氧化剂被还原的产物
0
+4
还原剂:
有元素化合价升高的反应物
氧化产物:
还原剂被氧化的产物
得电子
化合价升高
被氧化
失电子
被还原
氧化反应
一、氧化剂和还原剂
氧化剂+还原剂=还原产物+氧化产物
失电子(电子对偏离),化合价升高,氧化反应,被氧化
得电子(电子对偏向),化合价降低,还原反应,被还原
(氧化性)
(还原性)
[知识小结]
[记忆口诀]升失氧化还原剂,降得还原氧化剂
分析下列反应,并指出氧化剂、还原剂、氧化产物、还原产物。
SO2 + 2H2S = 3S↓+ 2H2O
Cl2+H2O = HClO+HCl
[点拨]
氧化剂、还原剂可以是同一种物质;
氧化产物、还原产物可以是同一种物质。
[达标检测1]
分析下列反应,并指出氧化剂、还原剂、氧化产物、还原产物。
[点拨]
同一种物质在不同的反应中所起的作用不同。
[达标检测2]
(1)H2O2+H2S = 2H2O+S↓
(2)H2O2+Cl2 = 2HC1+O2
(3)2H2O2 = 2H2O+O2↑
MnO2
H2O2作氧化剂
H2O2作还原剂
H2O2作氧化剂和还原剂
常见氧化剂
某些非金属单质:O2、Cl2、I2、Br2等
含有高价态元素的化合物: 浓H2SO4、HNO3、KMnO4、K2Cr2O7等
某些阳离子:Fe3+、Cu2+、H+、Ag+等
某些过氧化物:Na2O2、H2O2等
具有氧化性,即得电子的能力,表现为化合价降低。
二、常见的氧化剂和还原剂
常见还原剂
具有还原性,即失电子的能力,表现为化合价升高。
活泼的金属单质: 如K、 Na、Mg、Fe、 Al等
某些非金属单质: 如H2、C等
低价态化合物: 如CO、H2S、SO2等
低价态金属阳离子: 如Fe2+、Cu+、等
在MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑反应中
(1)氧化剂为 ,还原产物为 。
(2)被氧化的物质是为 ,发生 反应。
下列元素是被氧化还是被还原,要加氧化剂/还原剂实现?
(1)KI → I2
(2)FeCl3 → FeCl2
(3)KMnO4 → MnO2
(4)Fe → Fe2+
[达标检测3]
[达标检测4]
三、表示方法
1.双线桥法
标价态
标元素化合价,判断升降,算化合价变化值
连双线
一条线:反应物中降价元素→生成物中同种元素
一条线:反应物中升价元素→生成物中同种元素
注得失
标出得(失)电子总数、化合价变化、反应类型
得到 2 × 3e-,化合价降低,被还原
+3 0 0 +3
失去 2 ×3e-,化合价升高,被氧化
单个Fe原子得到3个电子
两个Fe原子
单个Al原子失去3个电子
两个Al原子
[特别提醒]
得电子总数=失电子总数=变价原子数×单个变价的原子得(失)电子数
Fe2O3 + 2Al = 2Fe + 2Al2O3
[经典示例]
注意事项
①箭头、箭尾必须对应变价的同种元素,反应物指向生成物;
②双线桥上必须注明“得到(得)”或“失去(失);
③氧化剂得电子总数=还原剂失电子总数;
④书写电子转移数目时,写成“得(失) a × be-”
a—化合价变化的元素的原子数
b—化合价变化的元素的一个原子的得(失)电子数
+4 -1 +2 0
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
得到1×2e-,
化合价降低,
被还原
被氧化
化合价升高,
失去2 ×e-,
[易错警醒]部分氧化还原反应
[点拨]该反应中,只有一部分氯元素的化合价发生变化,还有一部分氯元素的价态不变,故失去电子数为2×e-,而不是4 ×e-。
0 -1 +1
Cl2+2NaOH=NaCl+NaClO+H2O
得到1×e-,
化合价降低,
被还原
被氧化
化合价升高,
失去1×e-,
[易错警醒]歧化反应
[点拨]该反应中,同一反应物中氯元素化合价既升高又降低,发生氧化反应和还原反应的氯原子个数比为1:1。
-2 +4 0
2H2S + SO2 = 3S↓ + 2H2O
得到1×4e-,
化合价降低,
被还原
被氧化
化合价升高,
失去2×2e-,
[易错警醒]归中反应
[点拨]该反应中,不同反应物中的硫元素化合价既升高又降低,发生氧化反应和还原反应的硫原子个数比为2:1。
KClO3 + 6HCl = KCl + 3Cl2 ↑ + 3H2O
+5 -1 -1 0
失去5×e-,
KClO3 + 6HCl = KCl+3Cl2 ↑ + 3H2O
+5 -1 -1 0
得到 1×5e-,
化合价降低,
被还原
化合价升高,
被氧化
得到 1×6e-,
化合价降低,
被还原
失去6×e-,
化合价升高,
被氧化
[易错警醒]价态不交叉规律
价态不交叉规律:同种元素的不同价态间发生氧化还原反应时,高价态和低价态变成它们相邻的中间价态。
最低价
最高价
中间价
最低价
最高价
中间价
中间价
最低价
最高价
中间价
中间价
只相邻,不交叉
2.2Al + 3CuSO4 = 2Al2(SO4)3 + 3Cu
用双线桥法分析氧化还原反应。
3.3CO + Fe2O3 = 2Fe + 3CO2
4.3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
1.2Fe + 3Cl2 = 2FeCl3
[达标检测5]
2.单线桥法
标价态
标化合价,算变化数
连单线
始于反应物中的升价元素,止于反应物中降价元素
注数目
标出反应中转移的电子总数即可
注意:箭头标明电子转移的方向,还原剂→氧化剂
注意:不需要标明“得到”或“失去”
+3 0 0 +3
6e-
单线桥和双线桥两种表示方法的形式不同,实质相同
——氧化还原反应电子转移关系
Fe2O3 + 2Al = 2Fe + 2Al2O3
[经典示例]
[点拨]反应中,Al失去6e-,化合价升高;Fe得到6e-,化合价降低,电子转移方向由Al指向Fe。
1.Fe + H2SO4 = FeSO4 + H2↑
2.SO2 + 2H2S =3S + 2H2O
3.3NO2 + H2O = 2HNO3 + NO
用单线桥法分析氧化还原反应并指出氧化剂和还原剂。
4.2KClO3 = 2KCl + 3O2↑
[达标检测6]
三、氧化性、还原性强弱的比较
(1)根据氧化还原反应方程式判断
氧化性:Cl2 > Br2
氧 化 性: 氧化剂 > 氧化产物
还 原 性: 还原剂 > 还原产物
[例]Cl2 + 2NaBr = 2NaCl + Br2
氧化剂+还原剂→还原产物 +氧化产物
还原性:Br- >Cl-
(2) 根据元素的价态高低判断
具有变价的元素。
最高价态—只有氧化性
最低价态—只有还原性
中间价态—氧化性和还原性
一般是价态越高,其氧化性越强;价态越低,其还原性越强。
[例]氧化性:Fe3+ >Fe2+ >Fe;
H2SO4(浓) >SO2>S
(3)根据物质的活动性顺序判断
①在金属活动性顺序中,排在左边的金属的还原性强
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)、Cu、Hg、 Ag、Pt、Au
还原性减弱
K+、Ca2+、Na+、Mg2+、Al3+、Zn2+、Fe2+、Sn2+、Pb2+(H+)、Cu2+、 Ag+
氧化性增强
②非金属元素按F、Cl、Br、I、S从左向右的顺序,其单质的氧化性逐渐减
弱,其阴离子的还原性逐渐增强。
氧化性:F2>Cl2> Br2>l2>S 还原性:F-
H2SO3 + I2 + H2O = 2HI + H2SO4
2FeCl3 + 2HI = 2FeCl2 + 2HCl + I2
H2SO3 > I- > Fe2+
(H2SO3>I-)
( I->Fe2+)
[达标检测7]
[达标检测8]
已知三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓) = 2KCl+2MnCl2+8H2O+5Cl2
(1)Fe3+,I2,MnO4-,Cl2的氧化性由强到弱的顺序是 ;
(2)Fe2+,I-,Mn2+,Cl-的还原性由弱到强的顺序是 ;
还原剂
化合价升高
氧化产物
失e-
被氧化,发生氧化反应
氧化剂
化合价降低
还原产物
得e-
被还原,发生还原反应
反
应
物
生成物
电子得失的总数相等
化合价升降总数相等
=
[课堂小结]
