化学人教版(2019)必修第一册2.2.1氯及其化合物 课件(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2.1氯及其化合物 课件(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 46.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-01 21:24:31 | ||
图片预览










文档简介
(共31张PPT)
2.2氯及其化合物
氧化
漂白
消毒
课时一
氯气
生活中的氯
Fdz
食盐
洁厕灵
消毒剂
漂白粉
Ca(ClO)2
NaClO
HCl
NaCl
氯元素的存在形式
01
氯元素的存在形式
氯是一种重要的“成盐元素”,在自然界中除了以NaCl、MgCl2、CaCl2等化合物形式大量存在于海水中,还存在于陆地的盐矿和盐湖中。
氯气的发现
将软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。
瑞典化学家舍勒
发现
命名
确认这种气体是一种新元素组成的单质——氯气
英国化学家戴维
氯气的物理性质及毒性
02
氯气的物理性质及毒性
黄绿色、有刺激性气味的气体
密度比空气大
有 毒
01
02
03
04
能溶于水(1:2),形成氯水
氯气的化学性质
03
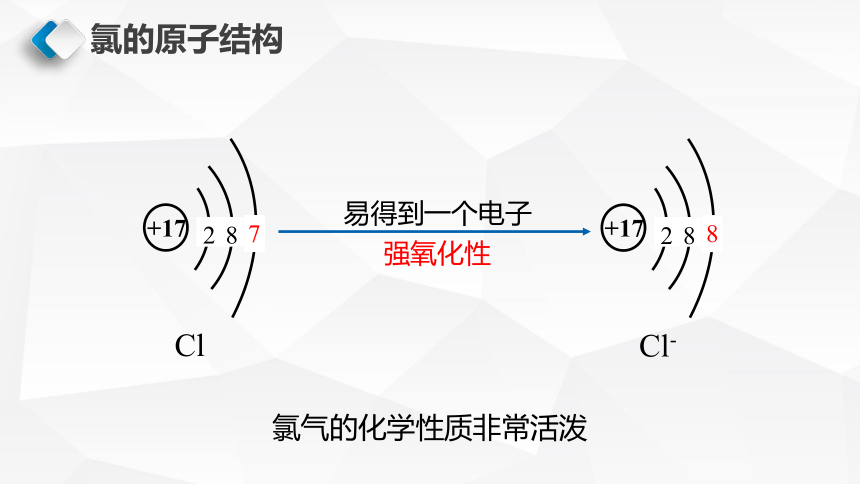
氯的原子结构
+17
2
8
7
易得到一个电子
强氧化性
Cl
Cl-
氯气的化学性质非常活泼
+17
2
8
8
氯气与金属单质的反应
与钠反应
2Na + Cl2 2NaCl
【实验现象】
产生大量白烟
【化学方程式】
氯气与金属单质的反应
与铁反应
2Fe + 3Cl2 2FeCl3
【实验现象】
产生大量棕褐色烟
【化学方程式】
常温下铁与干燥的氯气不反应,且氯气易液化,因此可以用钢瓶储运氯气
氯气与金属单质的反应
与铜反应
Cu + Cl2 CuCl2
【实验现象】
产生大量棕黄色烟
【化学方程式】
氯气与金属单质的反应
与钠反应
Cu + Cl2 CuCl2
产生白烟
【化学方程式】
2Na + Cl2 2NaCl
【化学方程式】
与铁反应
2Fe + 3Cl2 2FeCl3
产生棕褐色烟
与铜反应
【化学方程式】
产生棕黄色烟
+1
+3
+2
氯气的氧化性很强,与变价金属反应时,通常生成高价金属氯化物。
氯气与非金属单质的反应
与氢气反应
在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察现象。
实验探究
氯气与非金属单质的反应
与氢气反应
【实验现象】
氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾
【化学方程式】
(工业制盐酸)
盐酸小液滴
H2 + Cl2 2HCl
注意
氢气和氯气混合点燃或强光照射会发生爆炸。
燃烧不一定要有氧气参加。
思考
Na2O2因其强氧化性而具有漂白性;
Cl2氧化性也很强,是否也具有漂白性呢?
实验
取干燥的和湿润的有色纸条(或布条)各一条,分别放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片。观察现象。
实验探究
氯气与水的反应
实验操作 实验现象 实验结论
干燥的有色纸条
湿润的有色纸条
干燥的有色纸条不褪色
湿润的有色纸条褪色
有色纸鲜花褪色
Cl2无漂白性
Cl2和H2O反应的产物具有漂白性
Cl2和H2O反应的产物具有漂白性
氯气与水的反应
【化学方程式】
Cl2 + H2O HCl + HClO
【离子方程式】
Cl2 + H2O H+ + Cl- + HClO
0
+1
-1
得到e-,化合价降低,被还原
失去e-,化合价升高,被氧化
氧化剂:
Cl2
还原剂:
漂白性
Cl2
次氯酸的性质
弱酸性
次氯酸是易溶于水的弱酸,比碳酸的酸性弱。
强氧化性
a. 自来水的杀菌消毒
b. 漂白剂
不稳定性
次氯酸不稳定,见光易分解:
2HClO 2HCl + O2↑
新制氯水和久置氯水的区别
氯气溶于水形成的混合物叫做氯水
新制氯水和久置氯水的区别
新制氯水 久置氯水
分类 成分
性质
保存
混 合 物
分子:Cl2、H2O、HClO
酸性、氧化性、漂白性
离子:H+、Cl-、ClO-、OH-
分子:H2O
离子:H+、Cl-、OH-
酸性
棕色试剂瓶密封保存
玻璃塞试剂瓶
新制氯水中各微粒的性质
有色纸鲜花褪色
Cl2和H2O反应的产物具有漂白性
能够氧化Fe2+、Br-、I-等
Ag+ + Cl- = AgCl
加活泼金属、碳酸盐产生气泡
使紫色石蕊溶液先变红后褪色
使有色布条或品红溶液褪色
光照易分解
氯气与碱的反应
最初,人们直接用氯水作漂白剂,但因氯气的溶解度不大,生成的次氯酸不稳定,难以保存,于是人们在氯气与水反应的基础上制得了次氯酸钠、次氯酸钙等具有漂白作用的次氯酸盐。
氯气与碱的反应
(1)化学方程式
Cl2 + 2NaOH NaCl + NaClO + H2O
(2)离子方程式
与氢氧化钠溶液反应——制取漂白液、消毒剂
Cl2 + 2OH- Cl- + ClO- + H2O
(3)漂白液的主要成分 ;有效成分 。
NaCl、NaClO
NaClO
(4)漂白原理
NaClO + CO2 + H2O NaHCO3 + HClO
(5)失效原因
NaClO + CO2 + H2O NaHCO3 + HClO
2HClO 2HCl + O2↑
氯气与碱的反应
(1)化学方程式
2Cl2 + 2Ca(OH)2 CaCl2 + Ca(ClO)2 + 2H2O
(2)离子方程式
与石灰乳反应——制取漂白粉
(3)漂白粉的主要成分 ;有效成分 。
CaCl2、Ca(ClO)2
Ca(ClO)2
(4)漂白原理
Ca(ClO)2 + CO2 + H2O CaCO3 + 2HClO
(5)失效原因
2HClO 2HCl + O2↑
Cl2 + Ca(OH)2 Ca2+ + Cl- + ClO- + H2O
Ca(ClO)2 + CO2 + H2O CaCO3 + 2HClO
氯气与碱的反应
漂白液、漂白粉的保存
需密封避光保存
漂白液、漂白粉的应用
漂白棉、麻、纸张。
游泳池消毒等。
氯气与碱的反应
禁止将洁厕灵和84消毒液混合使用
主要成分NaClO
主要成分HCl
NaClO + 2HCl NaCl + Cl2↑ + H2O
ClO- + 2H+ + Cl- Cl2↑ + H2O
氯气的用途
04
氯气的用途
制取盐酸
消毒液、漂白粉
高纯度半导体
有机合成
01
02
03
04
氧化
漂白
消毒
氯气
THANKS
谢谢观看
2.2氯及其化合物
氧化
漂白
消毒
课时一
氯气
生活中的氯
Fdz
食盐
洁厕灵
消毒剂
漂白粉
Ca(ClO)2
NaClO
HCl
NaCl
氯元素的存在形式
01
氯元素的存在形式
氯是一种重要的“成盐元素”,在自然界中除了以NaCl、MgCl2、CaCl2等化合物形式大量存在于海水中,还存在于陆地的盐矿和盐湖中。
氯气的发现
将软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。
瑞典化学家舍勒
发现
命名
确认这种气体是一种新元素组成的单质——氯气
英国化学家戴维
氯气的物理性质及毒性
02
氯气的物理性质及毒性
黄绿色、有刺激性气味的气体
密度比空气大
有 毒
01
02
03
04
能溶于水(1:2),形成氯水
氯气的化学性质
03
氯的原子结构
+17
2
8
7
易得到一个电子
强氧化性
Cl
Cl-
氯气的化学性质非常活泼
+17
2
8
8
氯气与金属单质的反应
与钠反应
2Na + Cl2 2NaCl
【实验现象】
产生大量白烟
【化学方程式】
氯气与金属单质的反应
与铁反应
2Fe + 3Cl2 2FeCl3
【实验现象】
产生大量棕褐色烟
【化学方程式】
常温下铁与干燥的氯气不反应,且氯气易液化,因此可以用钢瓶储运氯气
氯气与金属单质的反应
与铜反应
Cu + Cl2 CuCl2
【实验现象】
产生大量棕黄色烟
【化学方程式】
氯气与金属单质的反应
与钠反应
Cu + Cl2 CuCl2
产生白烟
【化学方程式】
2Na + Cl2 2NaCl
【化学方程式】
与铁反应
2Fe + 3Cl2 2FeCl3
产生棕褐色烟
与铜反应
【化学方程式】
产生棕黄色烟
+1
+3
+2
氯气的氧化性很强,与变价金属反应时,通常生成高价金属氯化物。
氯气与非金属单质的反应
与氢气反应
在空气中点燃氢气,然后把导管缓慢伸入盛满氯气的集气瓶中,观察现象。
实验探究
氯气与非金属单质的反应
与氢气反应
【实验现象】
氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾
【化学方程式】
(工业制盐酸)
盐酸小液滴
H2 + Cl2 2HCl
注意
氢气和氯气混合点燃或强光照射会发生爆炸。
燃烧不一定要有氧气参加。
思考
Na2O2因其强氧化性而具有漂白性;
Cl2氧化性也很强,是否也具有漂白性呢?
实验
取干燥的和湿润的有色纸条(或布条)各一条,分别放入两个盛有干燥氯气的集气瓶中,盖上玻璃片,观察现象。
将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片。观察现象。
实验探究
氯气与水的反应
实验操作 实验现象 实验结论
干燥的有色纸条
湿润的有色纸条
干燥的有色纸条不褪色
湿润的有色纸条褪色
有色纸鲜花褪色
Cl2无漂白性
Cl2和H2O反应的产物具有漂白性
Cl2和H2O反应的产物具有漂白性
氯气与水的反应
【化学方程式】
Cl2 + H2O HCl + HClO
【离子方程式】
Cl2 + H2O H+ + Cl- + HClO
0
+1
-1
得到e-,化合价降低,被还原
失去e-,化合价升高,被氧化
氧化剂:
Cl2
还原剂:
漂白性
Cl2
次氯酸的性质
弱酸性
次氯酸是易溶于水的弱酸,比碳酸的酸性弱。
强氧化性
a. 自来水的杀菌消毒
b. 漂白剂
不稳定性
次氯酸不稳定,见光易分解:
2HClO 2HCl + O2↑
新制氯水和久置氯水的区别
氯气溶于水形成的混合物叫做氯水
新制氯水和久置氯水的区别
新制氯水 久置氯水
分类 成分
性质
保存
混 合 物
分子:Cl2、H2O、HClO
酸性、氧化性、漂白性
离子:H+、Cl-、ClO-、OH-
分子:H2O
离子:H+、Cl-、OH-
酸性
棕色试剂瓶密封保存
玻璃塞试剂瓶
新制氯水中各微粒的性质
有色纸鲜花褪色
Cl2和H2O反应的产物具有漂白性
能够氧化Fe2+、Br-、I-等
Ag+ + Cl- = AgCl
加活泼金属、碳酸盐产生气泡
使紫色石蕊溶液先变红后褪色
使有色布条或品红溶液褪色
光照易分解
氯气与碱的反应
最初,人们直接用氯水作漂白剂,但因氯气的溶解度不大,生成的次氯酸不稳定,难以保存,于是人们在氯气与水反应的基础上制得了次氯酸钠、次氯酸钙等具有漂白作用的次氯酸盐。
氯气与碱的反应
(1)化学方程式
Cl2 + 2NaOH NaCl + NaClO + H2O
(2)离子方程式
与氢氧化钠溶液反应——制取漂白液、消毒剂
Cl2 + 2OH- Cl- + ClO- + H2O
(3)漂白液的主要成分 ;有效成分 。
NaCl、NaClO
NaClO
(4)漂白原理
NaClO + CO2 + H2O NaHCO3 + HClO
(5)失效原因
NaClO + CO2 + H2O NaHCO3 + HClO
2HClO 2HCl + O2↑
氯气与碱的反应
(1)化学方程式
2Cl2 + 2Ca(OH)2 CaCl2 + Ca(ClO)2 + 2H2O
(2)离子方程式
与石灰乳反应——制取漂白粉
(3)漂白粉的主要成分 ;有效成分 。
CaCl2、Ca(ClO)2
Ca(ClO)2
(4)漂白原理
Ca(ClO)2 + CO2 + H2O CaCO3 + 2HClO
(5)失效原因
2HClO 2HCl + O2↑
Cl2 + Ca(OH)2 Ca2+ + Cl- + ClO- + H2O
Ca(ClO)2 + CO2 + H2O CaCO3 + 2HClO
氯气与碱的反应
漂白液、漂白粉的保存
需密封避光保存
漂白液、漂白粉的应用
漂白棉、麻、纸张。
游泳池消毒等。
氯气与碱的反应
禁止将洁厕灵和84消毒液混合使用
主要成分NaClO
主要成分HCl
NaClO + 2HCl NaCl + Cl2↑ + H2O
ClO- + 2H+ + Cl- Cl2↑ + H2O
氯气的用途
04
氯气的用途
制取盐酸
消毒液、漂白粉
高纯度半导体
有机合成
01
02
03
04
氧化
漂白
消毒
氯气
THANKS
谢谢观看
