第四单元 金属 练习题(含解析) 2023-2024学年九年级化学鲁教版(五四学制)全一册
文档属性
| 名称 | 第四单元 金属 练习题(含解析) 2023-2024学年九年级化学鲁教版(五四学制)全一册 |  | |
| 格式 | docx | ||
| 文件大小 | 475.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-02 17:23:00 | ||
图片预览

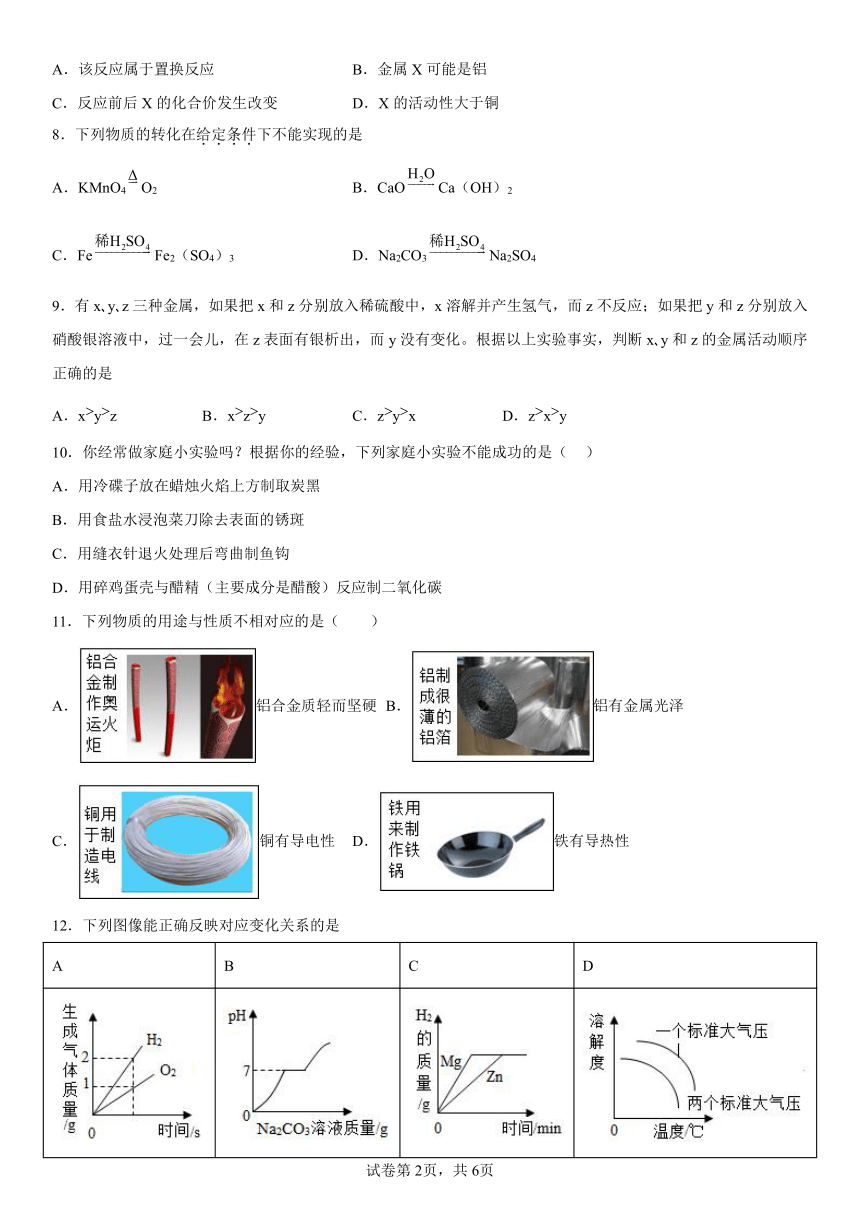


文档简介
金属
一、单选题
1.将铁粉加到一定量的硝酸银、硝酸铜和硝酸锌的混合溶液中,充分反应后过滤,在滤渣中加入稀盐酸,无明显现象。则所得滤液中
A.只含有硝酸锌 B.一定含有硝酸锌和硝酸亚铁
C.一定没有硝酸银 D.一定没有硝酸银和硝酸铜
2.在一定条件下,下列转化不能由一步反应实现的是
A.Fe2O3→FeCl2 B.H2CO3→CO2 C.CuCl2→Cu D.Mg→MgO
3.图像能直观表达化学反应中相关最的关系。下列图像能正确反映其对应关系的是
A.向氢氧化钠溶液中不断加水
B.向一定质量的稀H2SO4和MgSO4的混合溶液中逐滴加入Ba(OH)2溶液
C.在盛有不同固体的三个密闭容器中,分别加入等量的质量分数为10%的盐酸
D.向等质量的Mg和Al中分别加入足量相同溶质质量分数的稀盐酸
4.向两瓶相等质量、相等质量分数的盐酸中,分别加入相等质量的的过量的铁和锌,下列图像能正确反映其对应操作的是
A.B.C. D.
5.学习化学需要正确认识物质的性质及变化。下列说法不正确的是
A.石油分馏获得汽油属于物理变化 B.铁制品在沿海地区比在沙漠易生锈
C.燃烧与缓慢氧化都属于氧化反应 D.纯铜的机器齿轮比黄铜的坚硬耐磨
6.“节能减排,我有责任”,下列实验操作不符合节约原则的是
A.甲学生用白色点滴板代替试管,进行酸、碱溶液与指示剂反应的实验
B.乙学生配制50g5%的氯化钠溶液,把配好的溶液装入试剂瓶,盖好瓶塞,贴标签备用
C.丙学生用高锰酸钾分解制氧气时,先点燃酒精灯,再去组装仪器
D.丁学生做完金属与酸的反应实验后,把多余的金属和剩余的溶液回收
7.金属X可与CuSO4溶液反应:,下列说法不正确的是
A.该反应属于置换反应 B.金属X可能是铝
C.反应前后X的化合价发生改变 D.X的活动性大于铜
8.下列物质的转化在给定条件下不能实现的是
A.KMnO4O2 B.CaOCa(OH)2
C.FeFe2(SO4)3 D.Na2CO3Na2SO4
9.有x y z三种金属,如果把x和z分别放入稀硫酸中,x溶解并产生氢气,而z不反应;如果把y和z分别放入硝酸银溶液中,过一会儿,在z表面有银析出,而y没有变化。根据以上实验事实,判断x y和z的金属活动顺序正确的是
A.xyz B.xzy C.zyx D.zxy
10.你经常做家庭小实验吗?根据你的经验,下列家庭小实验不能成功的是( )
A.用冷碟子放在蜡烛火焰上方制取炭黑
B.用食盐水浸泡菜刀除去表面的锈斑
C.用缝衣针退火处理后弯曲制鱼钩
D.用碎鸡蛋壳与醋精(主要成分是醋酸)反应制二氧化碳
11.下列物质的用途与性质不相对应的是( )
A.铝合金质轻而坚硬 B.铝有金属光泽
C.铜有导电性 D.铁有导热性
12.下列图像能正确反映对应变化关系的是
A B C D
实验室电解水 向盐酸和氯化钙的混合溶液中加入碳酸钠溶液至过量 向等质量的锌粉、镁粉中分别加入足量的相同浓度相同质量的稀硫酸 气体物质的溶解度与温度和压强的关系
A.A B.B C.C D.D
二、填空题
13.金属材料广泛应用于生产、生活中。
(1)常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是_______(填名称)。
(2)铝比铁的抗腐蚀性强,是因为_______。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是_______(填化学式)。
(4)下列实验组合不能验证铁、银、铜三种金属活动性顺序的是 (填序号)。
①将Fe、Cu分别放入稀盐酸中
②将Ag放入CuSO4溶液中
③将Cu放入AgNO3溶液中
④将Cu放入FeSO4溶液中
⑤将Fe放入AgNO3溶液中
A.①② B.①③ C.②④ D.①⑤
14.向一定质量的Cu(NO3)2、AgNO3和Mg(NO3)2的混合溶液中加入一定量的Zn,充分反应后过滤,得到固体和蓝色溶液。
(1)写出一定发生的反应的化学方程式______。
(2)若反应前混合溶液的质量和过滤后所得溶液的质量相等,请分析所得固体的成分______。
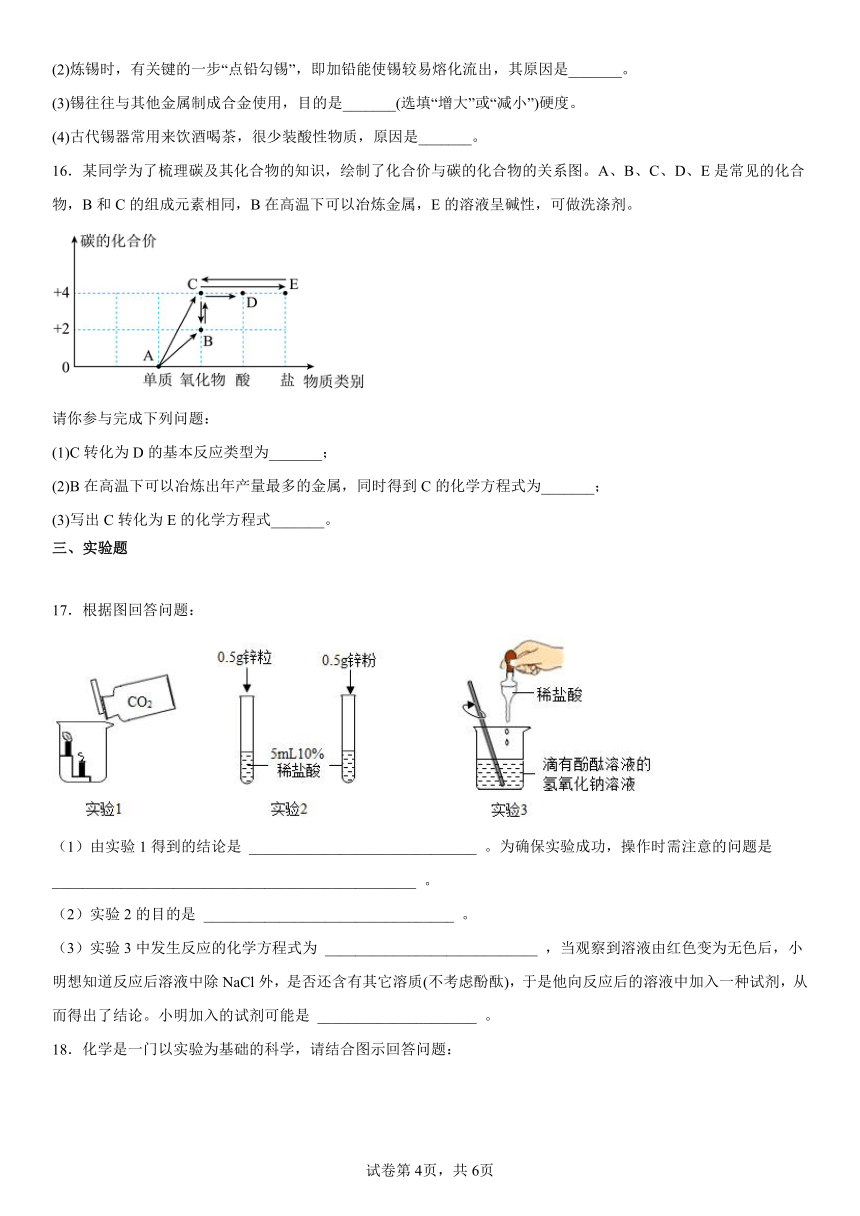
15.《天工开物》中记载了冶炼金属锡的场景(如图所示)。“凡煎炼亦用洪炉,入砂数百厅,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”
(1)鼓入足量空气能使木炭完全燃烧从而提高炉温,发生反应的化学方程式为_______。
(2)炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出,其原因是_______。
(3)锡往往与其他金属制成合金使用,目的是_______(选填“增大”或“减小”)硬度。
(4)古代锡器常用来饮酒喝茶,很少装酸性物质,原因是_______。
16.某同学为了梳理碳及其化合物的知识,绘制了化合价与碳的化合物的关系图。A、B、C、D、E是常见的化合物,B和C的组成元素相同,B在高温下可以冶炼金属,E的溶液呈碱性,可做洗涤剂。
请你参与完成下列问题:
(1)C转化为D的基本反应类型为_______;
(2)B在高温下可以冶炼出年产量最多的金属,同时得到C的化学方程式为_______;
(3)写出C转化为E的化学方程式_______。
三、实验题
17.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
18.化学是一门以实验为基础的科学,请结合图示回答问题:
(1)实验室用高锰酸钾制取氧气的化学方程式为_____。用B、E装置制取并收集氧气,实验操作步骤有:①点燃酒精灯,待气泡连续均匀放出时收集气体;②熄灭酒精灯;③装入药品,放置棉花并固定仪器;④连接好装置,检验装置的气密性;⑤从水槽中微出导管,正确的操作顺序是_____(填标号);
a.③④①②⑤b.④③①⑤②c.④③①②⑤d.③④①⑤②
(2)实验室用锌粒和稀硫酸制取氧气,应选择的发生装置是_____(填标号。下同),可选择的收集装置是_____(填一种即可)。
四、推断题
19.某固体氧化物X,经过①②两步反应后,得到红色固体单质C,溶液B只含一种溶质,且是盐,试回答:
(1)第①步盐酸是否过量___________,判断根据是___________。
(2)固体氧化物X的化学式是___________。
(3)写出生成B的化学方程式___________、___________。
20.已知A—H均为初中化学常见的物质。其中A、C是组成元素相同的气体,且C能产生温室效应;B为红棕色,是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀。根据如图所示的转化关系(图中 反应条件均已略去),请回答:
(1)写出下列物质的化学式:
B______、C______;
(2)写出下列反应的化学方程式:
①______;②______,
(3)反应②的基本反应类型是______。
(4)答出F的一种用途______。
五、计算题
21.为了测定一种钢样品的含量,小明称取了12.8g钢样品,投入装有200.0g稀盐酸的烧杯中,恰好完全反应后烧杯中剩余物质的总质量为212.4g(假设样品中的其他物质不与酸反应)。请计算:
(1)反应生成氢气的质量为___________g。
(2)所用稀盐酸的溶质的质量分数。(写出计算过程)[温馨提示:化学反应方程式为]
22.100克某种浓度的硫酸溶液和13克的Zn恰好完全反应,求硫酸溶液中溶质的质量分数?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】将铁粉加到一定量的硝酸银、硝酸铜和硝酸锌的混合溶液中,因为金属铁的活动性比金属银、铜的强,比金属锌的弱,故加入溶液后先置换金属银然后才能置换金属铜,充分反应后过滤,在滤渣中加入稀盐酸,无明显现象,说明没有剩余金属铁,则所得滤液中一定含有硝酸锌和硝酸亚铁,可能含有硝酸银和硝酸铜;故答案选择B。
2.A
【详解】A、在氧化铁中,铁元素显+3价,与酸发生复分解反应生成的盐中铁元素的化合价不变,不可能生成亚铁盐,故A错误;
B、碳酸不稳定,能分解生成二氧化碳和水,故B正确;
C、氯化铜可以被位于其前面的金属置换出来,故C正确;
D、镁可以在空气中燃烧生成氧化镁,故D正确,
故选A.
3.A
【详解】A、向氢氧化钠溶液中不断加水,溶液被稀释,所以pH减小,但终究显碱性,选项正确;
B、H2SO4和MgSO4两种物质都会与氢氧化钡反应生成硫酸钡,硫酸镁还会与氢氧化钡反应生成氢氧化镁,但是氢氧化镁会被稀硫酸反应,所以直至硫酸被完全反应,才会生成氢氧化镁,所以一开始就有沉淀产生,选项错误;
C、氧化钙与水反应生成氢氧化钙,放热,氢氧化钙与盐酸反应生成氯化钙和水,放热,两个反应都放热,压强都增大,氧化钙增加幅度大于氢氧化钙,由于两个反应都没有气体生成,反应结束,装置冷却后压强恢复至实验之前;碳酸钙与盐酸反应生成二氧化碳,压强增大,但盐酸的量一定,随着反应的进行,盐酸的浓度不断减小,产生二氧化碳的量也不断减小,因此压强随时间的变化曲线应是一条弧线,选项错误;
D、向等质量的Mg和Al中分别加入足量相同溶质质量分数的稀盐酸,加入的稀盐酸较少时,稀盐酸完全反应,生成的氢气质量相等,稀盐酸过量时,铝生成的氢气较多,选项错误。
故选:A。
4.D
【详解】A、向两瓶相等质量、相等质量分数的盐酸中,分别加入相等质量的的过量的铁和锌,因为锌比铁活泼,锌反应比铁剧烈,单位时间内产生氢气的质量锌比铁多,故产生氢气的质量随时间变化曲线应该是锌比铁要陡,因为金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等,即两条线最终重合,故A错误;
B、由A分析可知,产生氢气的质量随时间变化曲线应该是锌比铁要陡,故B错误;
C、向两瓶相等质量、相等质量分数的盐酸中,分别加入相等质量的的过量的铁和锌,根据反应方程式:若盐酸质量为m,恰好完全反应时,消耗锌的质量为x,恰好完全反应时,消耗铁的质量为y,则有和,有和,解得和,故铁先消耗完盐酸,因为金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等,即两条线最终重合,故C错误;
D、由C分析可知,铁先消耗完盐酸,因为金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等,即两条线最终重合,故D正确;
故选D。
5.D
【详解】A、石油分馏是利用其中各成分的沸点不同,通过控制温度获得汽油,过程中没有新物质生成,属于物理变化,故选项说法正确;
B、沿海地区的空气中含有大量的水蒸气与盐分,沙漠地区空气较干燥,则铁制品在沿海地区比在沙漠易生锈,故选项说法正确;
C、燃烧与缓慢氧化都需要氧气的参与,则都属于氧化反应,故选项说法正确;
D、合金的硬度比其组成中纯金属的硬度大,黄铜是含铜的合金,则黄铜的机器齿轮比纯铜的坚硬耐磨,故选项说法错误。
故选D。
6.C
【详解】A、使用点滴板,因其操作简单、效果好、用量少、易清洗、不易破损、价格低而被广泛运用于化学实验中,不符合题意;
B、在实验室练习配制一定质量分数的溶液时,所得溶液不能倒掉,应该贴上标签备用,不符合题意;
C、应该先组装好装置,再点燃酒精灯,避免浪费燃料,符合题意;
D、实验结束后的剩余物一般都要回收并利用,不符合题意。故选C。
7.B
【详解】A、该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,不符合题意;
B、根据XSO4可知,硫酸根离子显-2价,根据化合物中,正、负化合价的代数和为零可知,X元素显+2价,铝元素显+3价,故金属X不可能是铝,符合题意;
C、反应前后,X由游离态转化为化合态,化合价一定发生了改变,不符合题意;
D、X能将硫酸铜中的铜置换出来,说明X的活动性大于铜,不符合题意。
故选B。
8.C
【详解】A、高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,故选项正确;
B、氧化钙和水反应生成氢氧化钙,故选项正确;
C、铁和稀硫酸反应生成硫酸亚铁(FeSO4)和氢气,故选项错误;
D、碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,故选项正确。
故选:C。
9.B
【详解】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,有x、y、z三种金属,如果把x和z分别放入稀硫酸中,x溶解并产生氢气,而z 不反应,说明x的金属活动性比氢强,z的金属活动性比氢弱,即x>H>z。位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,如果把y和z分别放入硝酸银溶液中,过一会儿,在z表面有银析出,而y没有变化,说明z的金属活动性比银强,y的金属活动性比银弱,即z>Ag>y。则x、y和z的金属活动顺序是x>z>y。
故选:B。
10.B
【详解】A、用冷碟子放在蜡烛火焰上方制取炭黑,因为蜡烛不完全燃烧生成炭黑,能达到目的,故方法正确;
B、食盐水不能和铁锈反应,所以不能用食盐水浸泡菜刀除去表面的锈斑,故方法错误;
C、由于金属加热后能变软,所以缝衣针经退火处理后可弯曲,能制鱼钩,故方法正确;
D、鸡蛋壳的主要成分是碳酸钙,醋酸能和碳酸钙反应生成二氧化碳气体,所以可用碎鸡蛋壳与醋精(主要成分是醋酸)反应制二氧化碳,故方法正确。
故选:B。
11.B
【详解】物质的结构决定物质的性质,物质的性质决定物质的用途。A、铝合金制作奥运火炬是利用铝合金质轻而坚硬的性质,物质的用途与性质相对应,正确;B、铝制成很薄的铝箔,是利用铝有很好的延展性,物质的用途与性质不相对应,错误;C、铜用于制造电线,是利用铜的导电性,物质的用途与性质相对应,正确;D、铁用来制作铁锅,是利用铁的导热性,物质的用途与性质相对应,正确。故选B。
12.B
【详解】A、电解水实验中“正氧负氢,氢二氧一”,产生氢气和氧气的体积比为2:1,氢气和氧气的质量比为1:8,故选项图像不能正确反映对应变化关系;
B、向盐酸和氯化钙的混合溶液中不断滴加碳酸钠溶液至过量,碳酸钠先和稀盐酸反应生成氯化钠、水和二氧化碳,随着反应进行,pH增大,恰好完全反应时pH=7,继续加入碳酸钠溶液,与氯化钙反应生成碳酸钙沉淀和氯化钠,过程中pH不变,氯化钙完全反应后继续加入碳酸钠溶液,pH继续增大,故选项图像能正确反映对应变化关系;
C、由反应的质量关系、可知,向等质量的锌粉、镁粉中分别加入足量的相同浓度相同质量的稀硫酸,最终镁产生的氢气质量多,由于镁的活动性比锌强,镁完全反应所需时间短,故选项图像不能正确反映对应变化关系;
D、气体物质的溶解度随压强的增大而增大,所以温度相同时,压强越大,气体物质的溶解度越大,故选项图像不能正确反映对应变化关系。
故选B。
【点睛】本题是一道图像坐标与化学知识相结合的综合题,解题的关键是结合所涉及的化学知识,正确分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图像。
13.(1)汞
(2)常温下铝和氧气反应,表面形成一层致密的氧化膜
(3)ZnCl2、FeCl2
(4)D
【详解】(1)金属汞是唯一常温下呈液态的金属。
(2)铝比铁的抗腐蚀性强,是因为常温下铝和氧气反应,表面形成一层致密的氧化膜,阻止内部的铝被腐蚀。
(3)由金属活动性顺序表可知,锌>铁>氢>铜,在ZnCl2、CuCl2和稀盐酸混合溶液中加入过量的铁粉时,铁与盐酸反应生成氯化亚铁和氢气,铁能将氯化铜全部反应生成氯化亚铁和铜,不能与氯化锌反应;充分反应后,过滤,滤液中无氯化铜,有生成氯化亚铁和原来的氯化锌,化学式为ZnCl2、FeCl2。
(4)A、①中Fe能和稀盐酸反应,Cu不能和稀盐酸反应,证明活动性Fe>Cu;②中Ag和CuSO4不反应,证明活动性Ag<Cu,由此可知铁、银、铜三种金属活动性顺序为Fe>Cu>Ag,故A选项不符合题意;
B、①中Fe能和稀盐酸反应,Cu不能和稀盐酸反应,证明活动性Fe>Cu;③中Cu和AgNO3能反应,证明活动性Cu>Ag,由此可知铁、银、铜三种金属活动性顺序为Fe>Cu>Ag,故B选项不符合题意;
C、②中Ag和CuSO4不反应,证明活动性 Ag<Cu;④中Cu和FeSO4不反应,证明活动性 Cu<Fe,由此可知铁、银、铜三种金属活动性顺序为Fe>Cu>Ag,故C选项不符合题意;
D、①中Fe能和稀盐酸反应,Cu不能和稀盐酸反应,证明活动性Fe>Cu;⑤中Fe和AgNO3能反应,证明活动性Fe>Ag,Cu和Ag的活动性强弱无法判断,故D选项不符合题意。
故选D。
【点睛】本题考查金属的知识,根据所学知识进行分析解答。
14. Zn+2AgNO3=Zn(NO3)2+2Ag 银和铜
【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
【详解】向一定质量的Cu(NO3)2、AgNO3和Mg(NO3)2的混合溶液中加入一定量的Zn,锌不能和硝酸镁反应,先和硝酸银反应生成硝酸锌和银,后和硝酸铜反应生成硝酸锌和铜,充分反应后过滤,得到固体和蓝色溶液,说明硝酸铜没有或部分反应;
(1)一定发生的反应:锌和硝酸银反应生成硝酸锌和银,反应的化学方程式:Zn+2AgNO3=Zn(NO3)2+2Ag。故填:Zn+2AgNO3=Zn(NO3)2+2Ag。
(2)锌和硝酸银反应时:65份的铜可置换出216份的银,则固体质量增加,根据质量守恒,溶液质量减小;锌和硝酸铜反应时,65份的锌可置换出64份的铜,固体质量减少,溶液质量增大,若反应前混合溶液的质量和过滤后所得溶液的质量相等,说明固体中既有银又有铜,所得固体的成分是银和铜。
故填:银和铜。
【点睛】要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
15.(1)
(2)形成合金熔点降低
(3)增大
(4)锡器会与酸性物质反应
【详解】(1)在点燃的条件下,碳与氧气反应生成二氧化碳,化学方程式为:;
(2)合金的熔点低于其组成中纯金属的熔点,炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出,其原因是形成合金熔点降低;
(3)合金的硬度大于其组成中纯金属的硬度,锡往往与其它金属制成合金使用,目的是增大硬度;
(4)锡是一种活泼的金属,能与酸性物质反应,所以古代锡器常用来饮酒喝茶,很少装酸性物质。
16.(1)化合反应
(2)
(3)
【分析】A为单质,则A可以为石墨或金刚石;B和C的组成元素相同,且都属于氧化物,其中B中碳元素的化合价为+2价,C中碳元素的化合价为+4价,B在高温下可以冶炼金属,则B为一氧化碳,C为二氧化碳;E的溶液呈碱性,可做洗涤剂,属于盐,其中碳元素的化合价为+4价,则E为碳酸钠;D为酸,C能转化为D,则D为碳酸。
【详解】(1)由分析可知,C为二氧化碳,D为碳酸,C转化为D即二氧化碳与水反应生成碳酸,符合“多变一”的特点,属于化合反应,故填:化合反应;
(2)由分析可知,B为一氧化碳,C为二氧化碳,年产量最多的金属是铁,即一氧化碳与氧化铁在高温条件下生成铁和二氧化碳,反应的化学方程式为,故填:;
(3)由分析可知,C为二氧化碳,E为碳酸钠,C转化为E即二氧化碳与氢氧化钠反应生成碳酸钠和水,反应的化学方程式为,故填:。
17. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
【详解】(1)实验1中观察到的现象是低层的蜡烛先灭,高层的蜡烛后灭,说明二氧化碳不燃烧也不支持燃烧,密度比空气大,故填二氧化碳不燃烧也不支持燃烧,密度比空气大;
二氧化碳是气体,倾倒时不能像倒水一样,应该沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳,故填沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳。
(2)实验2中,不同的量是金属锌的形状,其它的量均相同,所以该实验的目的是探究反应物的状态对反应速率的影响,故填探究反应物的状态对反应速率的影响。
(3)实验3中的反应是氢氧化钠与盐酸反应生成氯化钠和水,故反应的化学方程式写为:;
观察到溶液由红色变为无色后,说明氢氧化钠完全参加反应,则溶液中除生成的氯化钠外,还可能剩余盐酸,盐酸呈酸性,能使紫色石蕊溶液变红,还能与锌等活泼金属反应生成氢气产生气泡,也能与碳酸钠溶液反应生成二氧化碳产生气泡,故填紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)。
18.(1) 2KMnO4K2MnO4+MnO2+O2↑ b
(2) A C/E
【详解】(1)高锰酸钾受热分解产生锰酸钾、二氧化锰与水,化学反应方程式为:2KMnO4K2MnO4+MnO2+O2↑;
用高锰酸钾受热分解制氧气实验中,实验前需要先连接好装置,并检查其气密性;确认气密性良好后装入药品,放入棉花并固定好仪器,然后点燃酒精灯,待气泡连续均匀放出时收集气体;收集完气体后为防止倒吸先将导管移出水面最后熄灭酒精灯;则实验顺序为:④③①⑤②;故选b;
(2)实验室常用锌与稀硫酸反应制取氢气,该反应中反应物为固体与液体,反应在常温下进行,则适合用A为反应的发生装置;氢气密度比空气小且不易溶于水,则适合用向下排空气法或排水集气法收集,装置为C或E。
19.(1) 稀盐酸过量 反应②中有气体产生,说明铁与过量的稀盐酸反应生成了氢气
(2)CuO
(3)
【分析】常见的红色固体单质为红磷和铜,溶液A与铁粉反应生成红色固体单质C,所以C为铜,A溶液中含有铜离子,A溶液为X和稀盐酸反应得到的,由于化学反应前后元素种类不变,则X中含有铜元素,因为X为固体氧化物,所以X为氧化铜,氧化铜与盐酸反应生成氯化铜和水,所以A溶液中溶质有氯化铜;由于铁粉与A溶液反应产生气体,铁的活动性排在氢前,氢前金属与稀盐酸反应能产生氢气,铁与溶液A反应还能产生氢气,说明A溶液中有剩余的盐酸,故盐酸过量;铁与氯化铜反应生成氯化亚铁和铜,铁与稀盐酸反应生成氯化亚铁和氢气,溶液B只含一种溶质,且是盐,说明氯化铜和盐酸都完全反应了,所以B溶液为氯化亚铁溶液,气体D为氢气。
(1)
由析析可知:盐酸过量,判断根据为:反应②中有气体产生,说明铁与过量的稀盐酸反应生成了氢气。
(2)
X为氧化铜,化学式为:CuO。
(3)
反应②分别是铁与氯化铜反应、铁和稀盐酸反应,都能生成氯化亚铁,反应的化学方程式分别:、。
20. Fe2O3 CO2 复分解反应 作导线(合理即可)
【分析】A、C是组成元素相同的气体,且C能产生温室效应,故C为二氧化碳、A为一氧化碳; B为红棕色,是赤铁矿的主要成分,B为氧化铁;一氧化碳与氧化铁反应生成铁和二氧化碳,D为铁;F是紫红色金属,H是蓝色沉淀,F为金属铜、H为氢氧化铜,E为可溶性铜盐溶液;代入检验推理正确;
【详解】(1)B为氧化铁,化学式为Fe2O3;C为二氧化碳,化学式为:CO2;
(2)①可以为铁与硫酸铜反应生成硫酸亚铁和铜,;
②可以为硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,。
(3)反应②符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应。
4)F为金属铜,具有良好的导电性,可以用于作导线。
21.(1)0.4
(2)设所用HCl的质量为x,
,
x=14.6g,
稀盐酸中溶质的质量分数:。
答:稀盐酸中溶质的质量分数为7.3%。
【分析】12.8g钢样品,投入装有200.0g稀盐酸的烧杯中(样品中的其他物质不与酸反应),发生反应Fe+2HCl=FeCl2+H2↑ ,恰好完全反应后烧杯中剩余物质的总质量为212.4g,根据质量守恒定律,反应产生氢气的质量为12.8g+200.0g-212.4g=0.4g;由氢气的质量,根据化学方程式可以计算HCl的质量,进而求得稀盐酸的溶质的质量分数。
【详解】(1)根据分析,氢气的质量为0.4g;
(2)见答案。
22.解:设硫酸溶液的溶质质量分数为x
答:硫酸溶液中溶质的质量分数为19.6%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.将铁粉加到一定量的硝酸银、硝酸铜和硝酸锌的混合溶液中,充分反应后过滤,在滤渣中加入稀盐酸,无明显现象。则所得滤液中
A.只含有硝酸锌 B.一定含有硝酸锌和硝酸亚铁
C.一定没有硝酸银 D.一定没有硝酸银和硝酸铜
2.在一定条件下,下列转化不能由一步反应实现的是
A.Fe2O3→FeCl2 B.H2CO3→CO2 C.CuCl2→Cu D.Mg→MgO
3.图像能直观表达化学反应中相关最的关系。下列图像能正确反映其对应关系的是
A.向氢氧化钠溶液中不断加水
B.向一定质量的稀H2SO4和MgSO4的混合溶液中逐滴加入Ba(OH)2溶液
C.在盛有不同固体的三个密闭容器中,分别加入等量的质量分数为10%的盐酸
D.向等质量的Mg和Al中分别加入足量相同溶质质量分数的稀盐酸
4.向两瓶相等质量、相等质量分数的盐酸中,分别加入相等质量的的过量的铁和锌,下列图像能正确反映其对应操作的是
A.B.C. D.
5.学习化学需要正确认识物质的性质及变化。下列说法不正确的是
A.石油分馏获得汽油属于物理变化 B.铁制品在沿海地区比在沙漠易生锈
C.燃烧与缓慢氧化都属于氧化反应 D.纯铜的机器齿轮比黄铜的坚硬耐磨
6.“节能减排,我有责任”,下列实验操作不符合节约原则的是
A.甲学生用白色点滴板代替试管,进行酸、碱溶液与指示剂反应的实验
B.乙学生配制50g5%的氯化钠溶液,把配好的溶液装入试剂瓶,盖好瓶塞,贴标签备用
C.丙学生用高锰酸钾分解制氧气时,先点燃酒精灯,再去组装仪器
D.丁学生做完金属与酸的反应实验后,把多余的金属和剩余的溶液回收
7.金属X可与CuSO4溶液反应:,下列说法不正确的是
A.该反应属于置换反应 B.金属X可能是铝
C.反应前后X的化合价发生改变 D.X的活动性大于铜
8.下列物质的转化在给定条件下不能实现的是
A.KMnO4O2 B.CaOCa(OH)2
C.FeFe2(SO4)3 D.Na2CO3Na2SO4
9.有x y z三种金属,如果把x和z分别放入稀硫酸中,x溶解并产生氢气,而z不反应;如果把y和z分别放入硝酸银溶液中,过一会儿,在z表面有银析出,而y没有变化。根据以上实验事实,判断x y和z的金属活动顺序正确的是
A.xyz B.xzy C.zyx D.zxy
10.你经常做家庭小实验吗?根据你的经验,下列家庭小实验不能成功的是( )
A.用冷碟子放在蜡烛火焰上方制取炭黑
B.用食盐水浸泡菜刀除去表面的锈斑
C.用缝衣针退火处理后弯曲制鱼钩
D.用碎鸡蛋壳与醋精(主要成分是醋酸)反应制二氧化碳
11.下列物质的用途与性质不相对应的是( )
A.铝合金质轻而坚硬 B.铝有金属光泽
C.铜有导电性 D.铁有导热性
12.下列图像能正确反映对应变化关系的是
A B C D
实验室电解水 向盐酸和氯化钙的混合溶液中加入碳酸钠溶液至过量 向等质量的锌粉、镁粉中分别加入足量的相同浓度相同质量的稀硫酸 气体物质的溶解度与温度和压强的关系
A.A B.B C.C D.D
二、填空题
13.金属材料广泛应用于生产、生活中。
(1)常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是_______(填名称)。
(2)铝比铁的抗腐蚀性强,是因为_______。
(3)向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是_______(填化学式)。
(4)下列实验组合不能验证铁、银、铜三种金属活动性顺序的是 (填序号)。
①将Fe、Cu分别放入稀盐酸中
②将Ag放入CuSO4溶液中
③将Cu放入AgNO3溶液中
④将Cu放入FeSO4溶液中
⑤将Fe放入AgNO3溶液中
A.①② B.①③ C.②④ D.①⑤
14.向一定质量的Cu(NO3)2、AgNO3和Mg(NO3)2的混合溶液中加入一定量的Zn,充分反应后过滤,得到固体和蓝色溶液。
(1)写出一定发生的反应的化学方程式______。
(2)若反应前混合溶液的质量和过滤后所得溶液的质量相等,请分析所得固体的成分______。
15.《天工开物》中记载了冶炼金属锡的场景(如图所示)。“凡煎炼亦用洪炉,入砂数百厅,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”
(1)鼓入足量空气能使木炭完全燃烧从而提高炉温,发生反应的化学方程式为_______。
(2)炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出,其原因是_______。
(3)锡往往与其他金属制成合金使用,目的是_______(选填“增大”或“减小”)硬度。
(4)古代锡器常用来饮酒喝茶,很少装酸性物质,原因是_______。
16.某同学为了梳理碳及其化合物的知识,绘制了化合价与碳的化合物的关系图。A、B、C、D、E是常见的化合物,B和C的组成元素相同,B在高温下可以冶炼金属,E的溶液呈碱性,可做洗涤剂。
请你参与完成下列问题:
(1)C转化为D的基本反应类型为_______;
(2)B在高温下可以冶炼出年产量最多的金属,同时得到C的化学方程式为_______;
(3)写出C转化为E的化学方程式_______。
三、实验题
17.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
18.化学是一门以实验为基础的科学,请结合图示回答问题:
(1)实验室用高锰酸钾制取氧气的化学方程式为_____。用B、E装置制取并收集氧气,实验操作步骤有:①点燃酒精灯,待气泡连续均匀放出时收集气体;②熄灭酒精灯;③装入药品,放置棉花并固定仪器;④连接好装置,检验装置的气密性;⑤从水槽中微出导管,正确的操作顺序是_____(填标号);
a.③④①②⑤b.④③①⑤②c.④③①②⑤d.③④①⑤②
(2)实验室用锌粒和稀硫酸制取氧气,应选择的发生装置是_____(填标号。下同),可选择的收集装置是_____(填一种即可)。
四、推断题
19.某固体氧化物X,经过①②两步反应后,得到红色固体单质C,溶液B只含一种溶质,且是盐,试回答:
(1)第①步盐酸是否过量___________,判断根据是___________。
(2)固体氧化物X的化学式是___________。
(3)写出生成B的化学方程式___________、___________。
20.已知A—H均为初中化学常见的物质。其中A、C是组成元素相同的气体,且C能产生温室效应;B为红棕色,是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀。根据如图所示的转化关系(图中 反应条件均已略去),请回答:
(1)写出下列物质的化学式:
B______、C______;
(2)写出下列反应的化学方程式:
①______;②______,
(3)反应②的基本反应类型是______。
(4)答出F的一种用途______。
五、计算题
21.为了测定一种钢样品的含量,小明称取了12.8g钢样品,投入装有200.0g稀盐酸的烧杯中,恰好完全反应后烧杯中剩余物质的总质量为212.4g(假设样品中的其他物质不与酸反应)。请计算:
(1)反应生成氢气的质量为___________g。
(2)所用稀盐酸的溶质的质量分数。(写出计算过程)[温馨提示:化学反应方程式为]
22.100克某种浓度的硫酸溶液和13克的Zn恰好完全反应,求硫酸溶液中溶质的质量分数?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】将铁粉加到一定量的硝酸银、硝酸铜和硝酸锌的混合溶液中,因为金属铁的活动性比金属银、铜的强,比金属锌的弱,故加入溶液后先置换金属银然后才能置换金属铜,充分反应后过滤,在滤渣中加入稀盐酸,无明显现象,说明没有剩余金属铁,则所得滤液中一定含有硝酸锌和硝酸亚铁,可能含有硝酸银和硝酸铜;故答案选择B。
2.A
【详解】A、在氧化铁中,铁元素显+3价,与酸发生复分解反应生成的盐中铁元素的化合价不变,不可能生成亚铁盐,故A错误;
B、碳酸不稳定,能分解生成二氧化碳和水,故B正确;
C、氯化铜可以被位于其前面的金属置换出来,故C正确;
D、镁可以在空气中燃烧生成氧化镁,故D正确,
故选A.
3.A
【详解】A、向氢氧化钠溶液中不断加水,溶液被稀释,所以pH减小,但终究显碱性,选项正确;
B、H2SO4和MgSO4两种物质都会与氢氧化钡反应生成硫酸钡,硫酸镁还会与氢氧化钡反应生成氢氧化镁,但是氢氧化镁会被稀硫酸反应,所以直至硫酸被完全反应,才会生成氢氧化镁,所以一开始就有沉淀产生,选项错误;
C、氧化钙与水反应生成氢氧化钙,放热,氢氧化钙与盐酸反应生成氯化钙和水,放热,两个反应都放热,压强都增大,氧化钙增加幅度大于氢氧化钙,由于两个反应都没有气体生成,反应结束,装置冷却后压强恢复至实验之前;碳酸钙与盐酸反应生成二氧化碳,压强增大,但盐酸的量一定,随着反应的进行,盐酸的浓度不断减小,产生二氧化碳的量也不断减小,因此压强随时间的变化曲线应是一条弧线,选项错误;
D、向等质量的Mg和Al中分别加入足量相同溶质质量分数的稀盐酸,加入的稀盐酸较少时,稀盐酸完全反应,生成的氢气质量相等,稀盐酸过量时,铝生成的氢气较多,选项错误。
故选:A。
4.D
【详解】A、向两瓶相等质量、相等质量分数的盐酸中,分别加入相等质量的的过量的铁和锌,因为锌比铁活泼,锌反应比铁剧烈,单位时间内产生氢气的质量锌比铁多,故产生氢气的质量随时间变化曲线应该是锌比铁要陡,因为金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等,即两条线最终重合,故A错误;
B、由A分析可知,产生氢气的质量随时间变化曲线应该是锌比铁要陡,故B错误;
C、向两瓶相等质量、相等质量分数的盐酸中,分别加入相等质量的的过量的铁和锌,根据反应方程式:若盐酸质量为m,恰好完全反应时,消耗锌的质量为x,恰好完全反应时,消耗铁的质量为y,则有和,有和,解得和,故铁先消耗完盐酸,因为金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等,即两条线最终重合,故C错误;
D、由C分析可知,铁先消耗完盐酸,因为金属与酸反应时氢气来源于酸中的氢元素,因为酸的量相同,金属过量,故生成的氢气应该相等,即两条线最终重合,故D正确;
故选D。
5.D
【详解】A、石油分馏是利用其中各成分的沸点不同,通过控制温度获得汽油,过程中没有新物质生成,属于物理变化,故选项说法正确;
B、沿海地区的空气中含有大量的水蒸气与盐分,沙漠地区空气较干燥,则铁制品在沿海地区比在沙漠易生锈,故选项说法正确;
C、燃烧与缓慢氧化都需要氧气的参与,则都属于氧化反应,故选项说法正确;
D、合金的硬度比其组成中纯金属的硬度大,黄铜是含铜的合金,则黄铜的机器齿轮比纯铜的坚硬耐磨,故选项说法错误。
故选D。
6.C
【详解】A、使用点滴板,因其操作简单、效果好、用量少、易清洗、不易破损、价格低而被广泛运用于化学实验中,不符合题意;
B、在实验室练习配制一定质量分数的溶液时,所得溶液不能倒掉,应该贴上标签备用,不符合题意;
C、应该先组装好装置,再点燃酒精灯,避免浪费燃料,符合题意;
D、实验结束后的剩余物一般都要回收并利用,不符合题意。故选C。
7.B
【详解】A、该反应符合“一种单质与一种化合物反应生成另一种单质和另一种化合物”的反应,属于置换反应,不符合题意;
B、根据XSO4可知,硫酸根离子显-2价,根据化合物中,正、负化合价的代数和为零可知,X元素显+2价,铝元素显+3价,故金属X不可能是铝,符合题意;
C、反应前后,X由游离态转化为化合态,化合价一定发生了改变,不符合题意;
D、X能将硫酸铜中的铜置换出来,说明X的活动性大于铜,不符合题意。
故选B。
8.C
【详解】A、高锰酸钾在加热的条件下生成锰酸钾、二氧化锰和氧气,故选项正确;
B、氧化钙和水反应生成氢氧化钙,故选项正确;
C、铁和稀硫酸反应生成硫酸亚铁(FeSO4)和氢气,故选项错误;
D、碳酸钠和稀硫酸反应生成硫酸钠、水和二氧化碳,故选项正确。
故选:C。
9.B
【详解】在金属活动性顺序中,位于氢前面的金属能置换出酸中的氢,有x、y、z三种金属,如果把x和z分别放入稀硫酸中,x溶解并产生氢气,而z 不反应,说明x的金属活动性比氢强,z的金属活动性比氢弱,即x>H>z。位于前面的金属能把排在它后面的金属从其盐溶液中置换出来,如果把y和z分别放入硝酸银溶液中,过一会儿,在z表面有银析出,而y没有变化,说明z的金属活动性比银强,y的金属活动性比银弱,即z>Ag>y。则x、y和z的金属活动顺序是x>z>y。
故选:B。
10.B
【详解】A、用冷碟子放在蜡烛火焰上方制取炭黑,因为蜡烛不完全燃烧生成炭黑,能达到目的,故方法正确;
B、食盐水不能和铁锈反应,所以不能用食盐水浸泡菜刀除去表面的锈斑,故方法错误;
C、由于金属加热后能变软,所以缝衣针经退火处理后可弯曲,能制鱼钩,故方法正确;
D、鸡蛋壳的主要成分是碳酸钙,醋酸能和碳酸钙反应生成二氧化碳气体,所以可用碎鸡蛋壳与醋精(主要成分是醋酸)反应制二氧化碳,故方法正确。
故选:B。
11.B
【详解】物质的结构决定物质的性质,物质的性质决定物质的用途。A、铝合金制作奥运火炬是利用铝合金质轻而坚硬的性质,物质的用途与性质相对应,正确;B、铝制成很薄的铝箔,是利用铝有很好的延展性,物质的用途与性质不相对应,错误;C、铜用于制造电线,是利用铜的导电性,物质的用途与性质相对应,正确;D、铁用来制作铁锅,是利用铁的导热性,物质的用途与性质相对应,正确。故选B。
12.B
【详解】A、电解水实验中“正氧负氢,氢二氧一”,产生氢气和氧气的体积比为2:1,氢气和氧气的质量比为1:8,故选项图像不能正确反映对应变化关系;
B、向盐酸和氯化钙的混合溶液中不断滴加碳酸钠溶液至过量,碳酸钠先和稀盐酸反应生成氯化钠、水和二氧化碳,随着反应进行,pH增大,恰好完全反应时pH=7,继续加入碳酸钠溶液,与氯化钙反应生成碳酸钙沉淀和氯化钠,过程中pH不变,氯化钙完全反应后继续加入碳酸钠溶液,pH继续增大,故选项图像能正确反映对应变化关系;
C、由反应的质量关系、可知,向等质量的锌粉、镁粉中分别加入足量的相同浓度相同质量的稀硫酸,最终镁产生的氢气质量多,由于镁的活动性比锌强,镁完全反应所需时间短,故选项图像不能正确反映对应变化关系;
D、气体物质的溶解度随压强的增大而增大,所以温度相同时,压强越大,气体物质的溶解度越大,故选项图像不能正确反映对应变化关系。
故选B。
【点睛】本题是一道图像坐标与化学知识相结合的综合题,解题的关键是结合所涉及的化学知识,正确分析各变化的过程,注意分析坐标轴表示的意义、曲线的起点、折点及变化趋势,进而确定正确的图像。
13.(1)汞
(2)常温下铝和氧气反应,表面形成一层致密的氧化膜
(3)ZnCl2、FeCl2
(4)D
【详解】(1)金属汞是唯一常温下呈液态的金属。
(2)铝比铁的抗腐蚀性强,是因为常温下铝和氧气反应,表面形成一层致密的氧化膜,阻止内部的铝被腐蚀。
(3)由金属活动性顺序表可知,锌>铁>氢>铜,在ZnCl2、CuCl2和稀盐酸混合溶液中加入过量的铁粉时,铁与盐酸反应生成氯化亚铁和氢气,铁能将氯化铜全部反应生成氯化亚铁和铜,不能与氯化锌反应;充分反应后,过滤,滤液中无氯化铜,有生成氯化亚铁和原来的氯化锌,化学式为ZnCl2、FeCl2。
(4)A、①中Fe能和稀盐酸反应,Cu不能和稀盐酸反应,证明活动性Fe>Cu;②中Ag和CuSO4不反应,证明活动性Ag<Cu,由此可知铁、银、铜三种金属活动性顺序为Fe>Cu>Ag,故A选项不符合题意;
B、①中Fe能和稀盐酸反应,Cu不能和稀盐酸反应,证明活动性Fe>Cu;③中Cu和AgNO3能反应,证明活动性Cu>Ag,由此可知铁、银、铜三种金属活动性顺序为Fe>Cu>Ag,故B选项不符合题意;
C、②中Ag和CuSO4不反应,证明活动性 Ag<Cu;④中Cu和FeSO4不反应,证明活动性 Cu<Fe,由此可知铁、银、铜三种金属活动性顺序为Fe>Cu>Ag,故C选项不符合题意;
D、①中Fe能和稀盐酸反应,Cu不能和稀盐酸反应,证明活动性Fe>Cu;⑤中Fe和AgNO3能反应,证明活动性Fe>Ag,Cu和Ag的活动性强弱无法判断,故D选项不符合题意。
故选D。
【点睛】本题考查金属的知识,根据所学知识进行分析解答。
14. Zn+2AgNO3=Zn(NO3)2+2Ag 银和铜
【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
【详解】向一定质量的Cu(NO3)2、AgNO3和Mg(NO3)2的混合溶液中加入一定量的Zn,锌不能和硝酸镁反应,先和硝酸银反应生成硝酸锌和银,后和硝酸铜反应生成硝酸锌和铜,充分反应后过滤,得到固体和蓝色溶液,说明硝酸铜没有或部分反应;
(1)一定发生的反应:锌和硝酸银反应生成硝酸锌和银,反应的化学方程式:Zn+2AgNO3=Zn(NO3)2+2Ag。故填:Zn+2AgNO3=Zn(NO3)2+2Ag。
(2)锌和硝酸银反应时:65份的铜可置换出216份的银,则固体质量增加,根据质量守恒,溶液质量减小;锌和硝酸铜反应时,65份的锌可置换出64份的铜,固体质量减少,溶液质量增大,若反应前混合溶液的质量和过滤后所得溶液的质量相等,说明固体中既有银又有铜,所得固体的成分是银和铜。
故填:银和铜。
【点睛】要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来。
15.(1)
(2)形成合金熔点降低
(3)增大
(4)锡器会与酸性物质反应
【详解】(1)在点燃的条件下,碳与氧气反应生成二氧化碳,化学方程式为:;
(2)合金的熔点低于其组成中纯金属的熔点,炼锡时,有关键的一步“点铅勾锡”,即加铅能使锡较易熔化流出,其原因是形成合金熔点降低;
(3)合金的硬度大于其组成中纯金属的硬度,锡往往与其它金属制成合金使用,目的是增大硬度;
(4)锡是一种活泼的金属,能与酸性物质反应,所以古代锡器常用来饮酒喝茶,很少装酸性物质。
16.(1)化合反应
(2)
(3)
【分析】A为单质,则A可以为石墨或金刚石;B和C的组成元素相同,且都属于氧化物,其中B中碳元素的化合价为+2价,C中碳元素的化合价为+4价,B在高温下可以冶炼金属,则B为一氧化碳,C为二氧化碳;E的溶液呈碱性,可做洗涤剂,属于盐,其中碳元素的化合价为+4价,则E为碳酸钠;D为酸,C能转化为D,则D为碳酸。
【详解】(1)由分析可知,C为二氧化碳,D为碳酸,C转化为D即二氧化碳与水反应生成碳酸,符合“多变一”的特点,属于化合反应,故填:化合反应;
(2)由分析可知,B为一氧化碳,C为二氧化碳,年产量最多的金属是铁,即一氧化碳与氧化铁在高温条件下生成铁和二氧化碳,反应的化学方程式为,故填:;
(3)由分析可知,C为二氧化碳,E为碳酸钠,C转化为E即二氧化碳与氢氧化钠反应生成碳酸钠和水,反应的化学方程式为,故填:。
17. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
【详解】(1)实验1中观察到的现象是低层的蜡烛先灭,高层的蜡烛后灭,说明二氧化碳不燃烧也不支持燃烧,密度比空气大,故填二氧化碳不燃烧也不支持燃烧,密度比空气大;
二氧化碳是气体,倾倒时不能像倒水一样,应该沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳,故填沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳。
(2)实验2中,不同的量是金属锌的形状,其它的量均相同,所以该实验的目的是探究反应物的状态对反应速率的影响,故填探究反应物的状态对反应速率的影响。
(3)实验3中的反应是氢氧化钠与盐酸反应生成氯化钠和水,故反应的化学方程式写为:;
观察到溶液由红色变为无色后,说明氢氧化钠完全参加反应,则溶液中除生成的氯化钠外,还可能剩余盐酸,盐酸呈酸性,能使紫色石蕊溶液变红,还能与锌等活泼金属反应生成氢气产生气泡,也能与碳酸钠溶液反应生成二氧化碳产生气泡,故填紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)。
18.(1) 2KMnO4K2MnO4+MnO2+O2↑ b
(2) A C/E
【详解】(1)高锰酸钾受热分解产生锰酸钾、二氧化锰与水,化学反应方程式为:2KMnO4K2MnO4+MnO2+O2↑;
用高锰酸钾受热分解制氧气实验中,实验前需要先连接好装置,并检查其气密性;确认气密性良好后装入药品,放入棉花并固定好仪器,然后点燃酒精灯,待气泡连续均匀放出时收集气体;收集完气体后为防止倒吸先将导管移出水面最后熄灭酒精灯;则实验顺序为:④③①⑤②;故选b;
(2)实验室常用锌与稀硫酸反应制取氢气,该反应中反应物为固体与液体,反应在常温下进行,则适合用A为反应的发生装置;氢气密度比空气小且不易溶于水,则适合用向下排空气法或排水集气法收集,装置为C或E。
19.(1) 稀盐酸过量 反应②中有气体产生,说明铁与过量的稀盐酸反应生成了氢气
(2)CuO
(3)
【分析】常见的红色固体单质为红磷和铜,溶液A与铁粉反应生成红色固体单质C,所以C为铜,A溶液中含有铜离子,A溶液为X和稀盐酸反应得到的,由于化学反应前后元素种类不变,则X中含有铜元素,因为X为固体氧化物,所以X为氧化铜,氧化铜与盐酸反应生成氯化铜和水,所以A溶液中溶质有氯化铜;由于铁粉与A溶液反应产生气体,铁的活动性排在氢前,氢前金属与稀盐酸反应能产生氢气,铁与溶液A反应还能产生氢气,说明A溶液中有剩余的盐酸,故盐酸过量;铁与氯化铜反应生成氯化亚铁和铜,铁与稀盐酸反应生成氯化亚铁和氢气,溶液B只含一种溶质,且是盐,说明氯化铜和盐酸都完全反应了,所以B溶液为氯化亚铁溶液,气体D为氢气。
(1)
由析析可知:盐酸过量,判断根据为:反应②中有气体产生,说明铁与过量的稀盐酸反应生成了氢气。
(2)
X为氧化铜,化学式为:CuO。
(3)
反应②分别是铁与氯化铜反应、铁和稀盐酸反应,都能生成氯化亚铁,反应的化学方程式分别:、。
20. Fe2O3 CO2 复分解反应 作导线(合理即可)
【分析】A、C是组成元素相同的气体,且C能产生温室效应,故C为二氧化碳、A为一氧化碳; B为红棕色,是赤铁矿的主要成分,B为氧化铁;一氧化碳与氧化铁反应生成铁和二氧化碳,D为铁;F是紫红色金属,H是蓝色沉淀,F为金属铜、H为氢氧化铜,E为可溶性铜盐溶液;代入检验推理正确;
【详解】(1)B为氧化铁,化学式为Fe2O3;C为二氧化碳,化学式为:CO2;
(2)①可以为铁与硫酸铜反应生成硫酸亚铁和铜,;
②可以为硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,。
(3)反应②符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应。
4)F为金属铜,具有良好的导电性,可以用于作导线。
21.(1)0.4
(2)设所用HCl的质量为x,
,
x=14.6g,
稀盐酸中溶质的质量分数:。
答:稀盐酸中溶质的质量分数为7.3%。
【分析】12.8g钢样品,投入装有200.0g稀盐酸的烧杯中(样品中的其他物质不与酸反应),发生反应Fe+2HCl=FeCl2+H2↑ ,恰好完全反应后烧杯中剩余物质的总质量为212.4g,根据质量守恒定律,反应产生氢气的质量为12.8g+200.0g-212.4g=0.4g;由氢气的质量,根据化学方程式可以计算HCl的质量,进而求得稀盐酸的溶质的质量分数。
【详解】(1)根据分析,氢气的质量为0.4g;
(2)见答案。
22.解:设硫酸溶液的溶质质量分数为x
答:硫酸溶液中溶质的质量分数为19.6%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
