化学苏教版(2019)必修第一册 3.3.2从海水中提取镁从海带中提取碘 课件(共21张PPT)
文档属性
| 名称 | 化学苏教版(2019)必修第一册 3.3.2从海水中提取镁从海带中提取碘 课件(共21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-02 14:52:52 | ||
图片预览







文档简介
(共21张PPT)
3.3.1 从海水中提取镁
从海带中提取碘
碘的生理功能
碘与人类的健康息息相关。成年人体内含有20-50mg的碘,碘是维持人体甲状腺正常功能所必需的元素。当人体缺碘时就会患甲状腺肿。因此碘化物可以防止和治疗甲状腺肿大。多食海带、海鱼等含碘丰富的食品,对于防治甲状腺肿大也很有效。碘的放射性同位素I可用于甲状腺肿瘤的早期诊断和治疗。碘是人体的必需微量元素之一,有“智力元素”之称。健康成人体内的碘的总量约为30mg(20~50mg),其中70%~80%存在于甲状腺。
碘及其化合物可被用来作为防腐剂、消毒剂、药物等。碘化银(AgI)除用作照相底片的感光剂外,还可作人工降雨时造云的晶种。I2和KI的酒精溶液即碘酒,是常用的消毒剂;碘仿(CHI3)用作防腐剂。
碘单质是紫黑色固体,易升华,在水中溶解度较小,但易溶于酒精、四氯化碳等有机溶剂。
一、从海水中提取碘
1.碘的性质
(1)物理性质
实验探究
在一支试管中加入2~3mLKI溶液,滴加少量新制氯水,再滴加少量CCl4,振荡,静置。
现象:溶液分层,下层为紫红色。
Cl2+2KI=2KCl+I2
Cl2、I2的氧化性顺序:
Cl2
>I2
>Br2
(2)碘的化学性质
Cl2+2KI=2KCl+I2
Cl2、Br2、I2的氧化性顺序:Cl2>Br2>I2
Br2+2KI=2KBr+I2
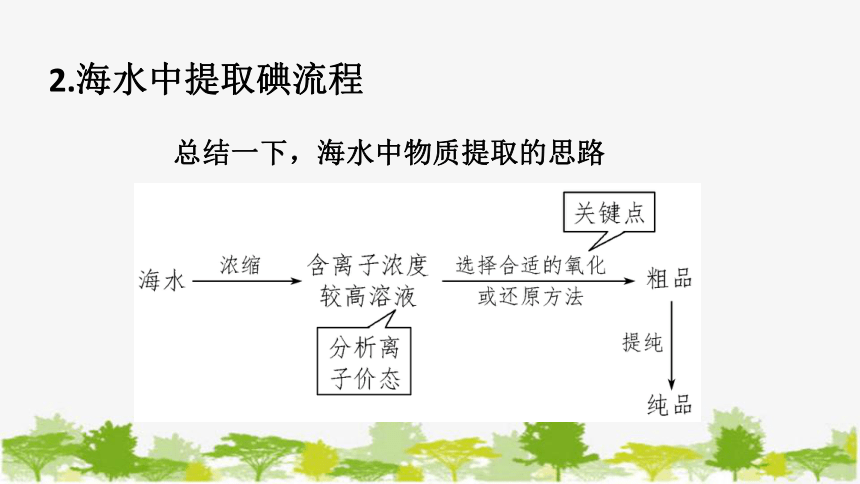
2.海水中提取碘流程
总结一下,海水中物质提取的思路
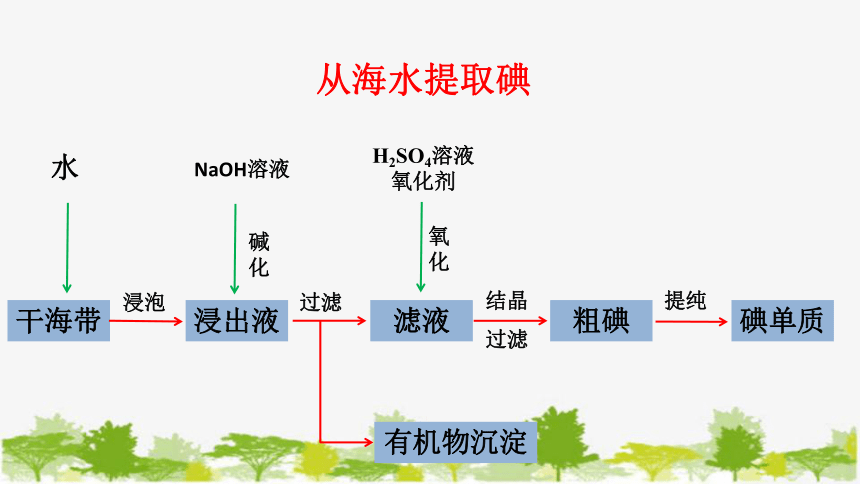
从海水提取碘
干海带
浸出液
滤液
粗碘
碘单质
有机物沉淀
水
NaOH溶液
H2SO4溶液
氧化剂
浸泡
过滤
碱
化
氧
化
结晶
过滤
提纯
实验探究:碘在加碘盐中碘元素的检验
碘在加碘盐中以IO3-的形式存在。已知在酸性条件下,IO3-会和I-发生如下反应:IO3-+5I-+6H+=3I2+3H2O,根据该反应,我们可以用试纸和生活中常见的物质检验加碘盐中碘的存在。
实验可选物质有:自来水,碘化钾淀粉试纸,白糖,白醋,白酒
请设计实验方案,检验加碘盐中碘的存在
二、从海水中提取镁
1.从海水中提取镁工艺流程
请大家总结上述的方程式
CaCO3===CaO+CO2↑
CaO+H2O=Ca(OH)2
MgCl2+2Ca(OH)2=Mg(OH)2 +CaCl2
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2===Mg+Cl2↑
高温
通电
2.镁的性质
(1)镁的物理性质
镁是银白色固体、密度较小 、质地柔软 ,是电和热的良导体 ,镁合金的硬度和强度较大 。
镁的原子结构
易失去2e-
化学性质活泼,表现出还原性
(2)实验探究镁的化学性质
发出耀眼的白光,放出大量热量,产生白色固体
2Mg+O2===2MgO
点燃
产生大量气泡,试管壁发热
Mg+H2SO4=MgSO4+H2↑
镁条剧烈燃烧,生成白色固体,在瓶的内壁有黑色物质附着
2Mg+CO2===2MgO+C
点燃
(2)镁的化学性质
①与非金属单质反应
②与酸反应
Mg+H2SO4=MgSO4+H2↑
③与二氧化碳反应
2Mg+O2===2MgO
点燃
3Mg+2N2===Mg3N4
点燃
2Mg+CO2===2MgO+C
点燃
镁在空气中点燃,发生哪些反应?
2Mg+O2===2MgO
点燃
3Mg+2N2===Mg3N4
点燃
2Mg+CO2===2MgO+C
点燃
3.镁的用途
①镁合金(约含镁80%),密度小,硬度和强度大,被大量用于火箭、导弹和飞机等制造业,美名为“国防金属”。
②镁元素能维护心肌纤维正常舒缩功能和冠状动脉弹性,有“心脏保护神”的美称,镁还可以用来制药。
③镁可以用来制造导弹和焰火。
④MgO熔点高,可做耐高温材料
3.3.1 从海水中提取镁
从海带中提取碘
碘的生理功能
碘与人类的健康息息相关。成年人体内含有20-50mg的碘,碘是维持人体甲状腺正常功能所必需的元素。当人体缺碘时就会患甲状腺肿。因此碘化物可以防止和治疗甲状腺肿大。多食海带、海鱼等含碘丰富的食品,对于防治甲状腺肿大也很有效。碘的放射性同位素I可用于甲状腺肿瘤的早期诊断和治疗。碘是人体的必需微量元素之一,有“智力元素”之称。健康成人体内的碘的总量约为30mg(20~50mg),其中70%~80%存在于甲状腺。
碘及其化合物可被用来作为防腐剂、消毒剂、药物等。碘化银(AgI)除用作照相底片的感光剂外,还可作人工降雨时造云的晶种。I2和KI的酒精溶液即碘酒,是常用的消毒剂;碘仿(CHI3)用作防腐剂。
碘单质是紫黑色固体,易升华,在水中溶解度较小,但易溶于酒精、四氯化碳等有机溶剂。
一、从海水中提取碘
1.碘的性质
(1)物理性质
实验探究
在一支试管中加入2~3mLKI溶液,滴加少量新制氯水,再滴加少量CCl4,振荡,静置。
现象:溶液分层,下层为紫红色。
Cl2+2KI=2KCl+I2
Cl2、I2的氧化性顺序:
Cl2
>I2
>Br2
(2)碘的化学性质
Cl2+2KI=2KCl+I2
Cl2、Br2、I2的氧化性顺序:Cl2>Br2>I2
Br2+2KI=2KBr+I2
2.海水中提取碘流程
总结一下,海水中物质提取的思路
从海水提取碘
干海带
浸出液
滤液
粗碘
碘单质
有机物沉淀
水
NaOH溶液
H2SO4溶液
氧化剂
浸泡
过滤
碱
化
氧
化
结晶
过滤
提纯
实验探究:碘在加碘盐中碘元素的检验
碘在加碘盐中以IO3-的形式存在。已知在酸性条件下,IO3-会和I-发生如下反应:IO3-+5I-+6H+=3I2+3H2O,根据该反应,我们可以用试纸和生活中常见的物质检验加碘盐中碘的存在。
实验可选物质有:自来水,碘化钾淀粉试纸,白糖,白醋,白酒
请设计实验方案,检验加碘盐中碘的存在
二、从海水中提取镁
1.从海水中提取镁工艺流程
请大家总结上述的方程式
CaCO3===CaO+CO2↑
CaO+H2O=Ca(OH)2
MgCl2+2Ca(OH)2=Mg(OH)2 +CaCl2
Mg(OH)2+2HCl=MgCl2+2H2O
MgCl2===Mg+Cl2↑
高温
通电
2.镁的性质
(1)镁的物理性质
镁是银白色固体、密度较小 、质地柔软 ,是电和热的良导体 ,镁合金的硬度和强度较大 。
镁的原子结构
易失去2e-
化学性质活泼,表现出还原性
(2)实验探究镁的化学性质
发出耀眼的白光,放出大量热量,产生白色固体
2Mg+O2===2MgO
点燃
产生大量气泡,试管壁发热
Mg+H2SO4=MgSO4+H2↑
镁条剧烈燃烧,生成白色固体,在瓶的内壁有黑色物质附着
2Mg+CO2===2MgO+C
点燃
(2)镁的化学性质
①与非金属单质反应
②与酸反应
Mg+H2SO4=MgSO4+H2↑
③与二氧化碳反应
2Mg+O2===2MgO
点燃
3Mg+2N2===Mg3N4
点燃
2Mg+CO2===2MgO+C
点燃
镁在空气中点燃,发生哪些反应?
2Mg+O2===2MgO
点燃
3Mg+2N2===Mg3N4
点燃
2Mg+CO2===2MgO+C
点燃
3.镁的用途
①镁合金(约含镁80%),密度小,硬度和强度大,被大量用于火箭、导弹和飞机等制造业,美名为“国防金属”。
②镁元素能维护心肌纤维正常舒缩功能和冠状动脉弹性,有“心脏保护神”的美称,镁还可以用来制药。
③镁可以用来制造导弹和焰火。
④MgO熔点高,可做耐高温材料
