化学人教版(2019)必修第一册 第二章复习(1)课件(共20张PPT)
文档属性
| 名称 | 化学人教版(2019)必修第一册 第二章复习(1)课件(共20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 623.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-03 00:00:00 | ||
图片预览




文档简介
(共20张PPT)
第二章· 海水中的重要元素
——钠和氯
复 习 课
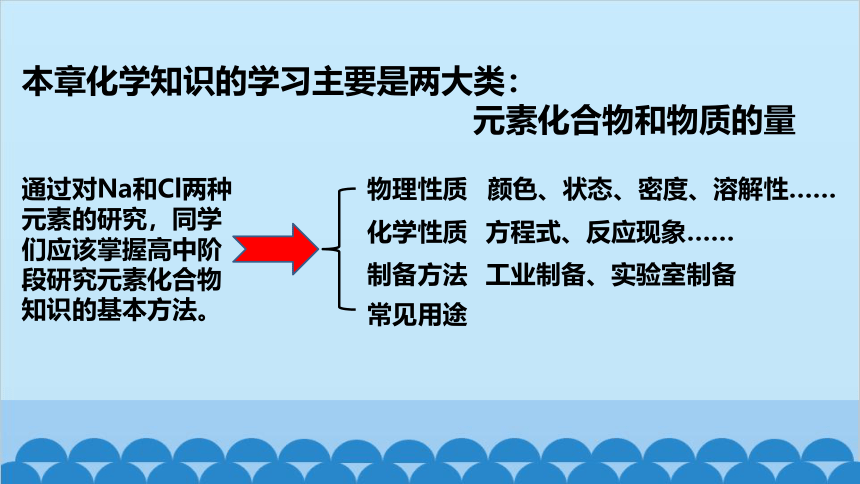
本章化学知识的学习主要是两大类:
元素化合物和物质的量
通过对Na和Cl两种元素的研究,同学们应该掌握高中阶段研究元素化合物知识的基本方法。
物理性质
化学性质
制备方法
常见用途
颜色、状态、密度、溶解性……
方程式、反应现象……
工业制备、实验室制备
一、单质钠
物理性质:银白色有金属光泽的固体,硬度较小,熔点低(97.8℃),密度小于水大于煤油(0.971g·cm-3)
化学性质:
强还原性金属单质
1、与氧气的反应:4Na + O2 = 2Na2O
2Na + O2 Na2O2
2、与水的反应:
2Na + 2H2O = 2NaOH + H2↑
变暗
先熔化后燃烧,发出黄色火焰,生成淡黄色固体
浮、熔、游、响、红
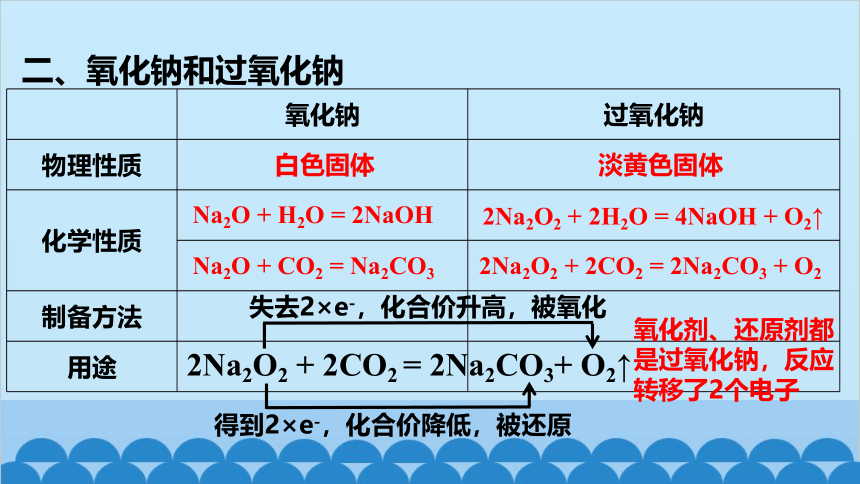
二、氧化钠和过氧化钠
氧化钠 过氧化钠
物理性质
化学性质
制备方法
用途
白色固体
淡黄色固体
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 2CO2 = 2Na2CO3+ O2↑
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
氧化剂、还原剂都是过氧化钠,反应转移了2个电子
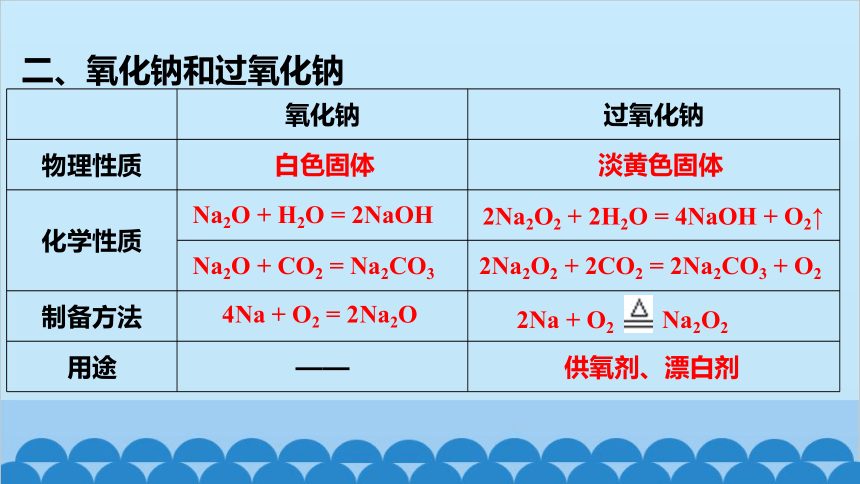
二、氧化钠和过氧化钠
氧化钠 过氧化钠
物理性质
化学性质
制备方法
用途 ——
白色固体
淡黄色固体
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
4Na + O2 = 2Na2O
2Na + O2 Na2O2
供氧剂、漂白剂
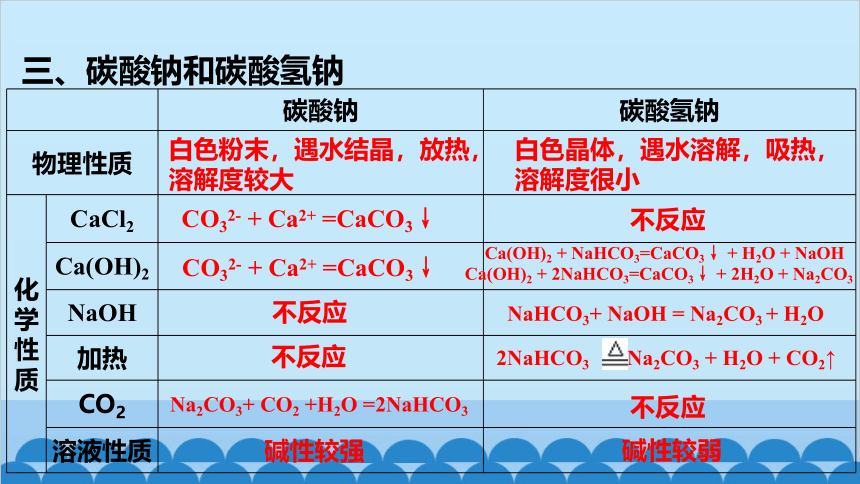
三、碳酸钠和碳酸氢钠
碳酸钠 碳酸氢钠
物理性质
化学性质 CaCl2
Ca(OH)2
NaOH
加热
CO2
溶液性质
Ca(OH)2 + NaHCO3=CaCO3↓ + H2O + NaOH
CO32- + Ca2+ =CaCO3↓
白色粉末,遇水结晶,放热,溶解度较大
白色晶体,遇水溶解,吸热,溶解度很小
不反应
CO32- + Ca2+ =CaCO3↓
Ca(OH)2 + 2NaHCO3=CaCO3↓ + 2H2O + Na2CO3
不反应
NaHCO3+ NaOH = Na2CO3 + H2O
不反应
2NaHCO3 Na2CO3 + H2O + CO2↑
Na2CO3+ CO2 +H2O =2NaHCO3
不反应
碱性较强
碱性较弱
三、碳酸钠和碳酸氢钠
碳酸钠 碳酸氢钠
制备
用途
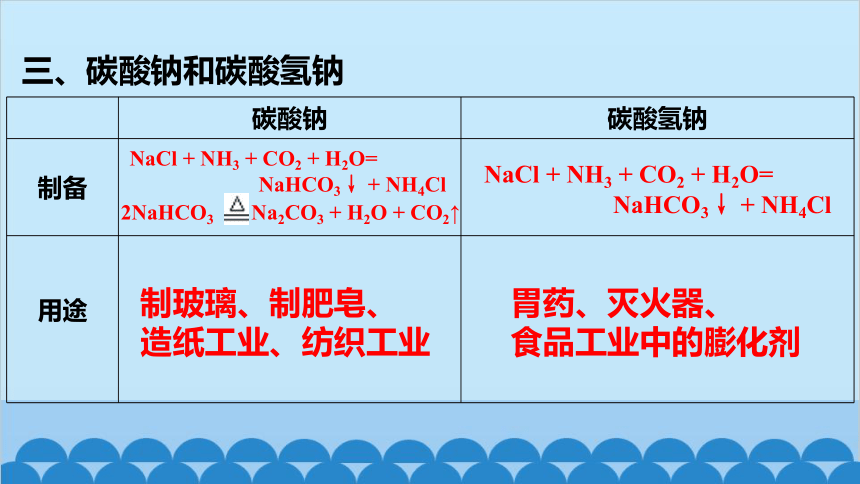
NaCl + NH3 + CO2 + H2O=
NaHCO3↓ + NH4Cl
NaCl + NH3 + CO2 + H2O=
NaHCO3↓ + NH4Cl
2NaHCO3 Na2CO3 + H2O + CO2↑
制玻璃、制肥皂、
造纸工业、纺织工业
胃药、灭火器、
食品工业中的膨化剂
思考与交流:如何区分碳酸钠和碳酸氢钠固体?
1、加热,将生成的气体通入澄清石灰水
2、直接观察外观
3、溶于水加酚酞
4、溶于水加氯化钙溶液
溶于水加氢氧化钙溶液?加氢氧化钠溶液?
思考与交流:在灭火器中不使用碳酸钠而使用碳酸氢钠的原因是什么?
1、相同质量,碳酸氢钠生成的二氧化碳更多
2、生成同样的二氧化碳,碳酸氢钠消耗的酸性物质更少
3、碳酸氢钠成本更低
四、焰色试验:
很多金属及其化合物在灼烧时会使火焰呈现出特征颜色,根据这种现象可以定性判断试样中所含的金属元素,这种操作称为焰色试验。
Na的焰色为黄色,K的焰色为紫色
透过蓝色钴玻璃观察
(滤去可能存在的钠盐的黄光)
五、氯气:
物理性质:氯气是黄绿色有刺激性气味的气体,有毒,可溶于水,易液化,密度大于空气
化学性质:强氧化性非金属单质
2Na + Cl2 2NaCl
Cu + Cl2 CuCl2
2Fe + 3Cl2 2FeCl3
H2 + Cl2 2HCl
氢气在氯气中安静的燃烧,发出苍白色火焰,在集气瓶口形成白雾。
五、氯气:
化学性质:强氧化性非金属单质
2Na + Cl2 2NaCl
Cu + Cl2 CuCl2
2Fe + 3Cl2 2FeCl3
H2 + Cl2 2HCl
Cl2 + H2O = HCl + HClO
形成氯水,氯水具有的性质是:
酸性、强氧化性和漂白性
Cl2 + 2NaOH= NaCl + NaClO + H2O
制漂白液
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
制漂白粉
漂粉精
H+ Cl2 HClO
五、氯气:
制备方法:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
五、氯气:
用途:
自来水消毒、制漂白液、制漂白粉和漂粉精、制HCl
六、次氯酸:
HClO:一元弱酸,酸性弱于碳酸,见光易分解,具有强氧化性和漂白性
所以氯水应该保存在
2HClO 2HCl + O2↑
棕色试剂瓶
物质的量
1、物质的量是衡量物质所含微观粒子数目的物理量
一、物质的量:
符号是n 单位是mol
1mol任何物质所含的粒子数量为阿伏加德罗常数(符号为NA),NA大约为6.02×1023mol-1
2、摩尔质量:单位物质的量的物质所具有的质量
符号为M,单位为g/mol
物质的摩尔质量与其相对原子质量或相对分子质量的数值相同
3、气体摩尔体积:同温同压下,任何气体一定具有相同的气体摩尔体积
阿伏加德罗定律:相同温度和相同压强下,相同体积的任何气体一定具有相同的分子数(物质的量)
推论:同温同压下,气体的体积比等于其物质的量的比
标准状况下,任何气体的摩尔体积都约为22.4L/mol
0℃、101 kPa
4、物质的量浓度:单位体积溶液里所含溶质B的物质的量
符号为cB
单位为mol/L
物质的量
N(mol)
物质的质量
m(g)
÷M
×M
粒子数
N
×NA
÷NA
标准状况下
气体的体积
V (L)
×22.4L·mol-1
÷22.4L·mol-1
物质的
量浓度
CB(mol·L-1)
×V液
÷V液
关系式
方程式中的
系数比等于
物质的量之比
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
溶质的质量分数
5、配制一定物质的量浓度的溶液:
以固体配制为例,用到的仪器有:
一定规格的容量瓶、天平、烧杯、量筒、玻璃棒、胶头滴管
⑴容量瓶要先检漏
⑵计算
⑶称量
⑷溶解(少量水,搅拌)
⑸移液(玻璃棒引流)
⑹洗涤(洗涤液一并转移到容量瓶中)
⑺定容(利用胶头滴管进行定容)
⑻摇匀
无影响
不变
不变
容量瓶或烧杯中未干燥
偏大
减小
不变
定容时俯视读数
偏小
增大
不变
定容时仰视读数
偏小
增大
不变
定容时加水多,用滴管吸出
偏大
减小
不变
未冷却到室温就注入容量瓶
偏小
不变
减小
未洗烧杯和玻璃棒
偏小
不变
减小
向容量瓶中注液时少量流出
溶液浓度
溶液体积
溶质质量
引起误差的一些操作
第二章· 海水中的重要元素
——钠和氯
复 习 课
本章化学知识的学习主要是两大类:
元素化合物和物质的量
通过对Na和Cl两种元素的研究,同学们应该掌握高中阶段研究元素化合物知识的基本方法。
物理性质
化学性质
制备方法
常见用途
颜色、状态、密度、溶解性……
方程式、反应现象……
工业制备、实验室制备
一、单质钠
物理性质:银白色有金属光泽的固体,硬度较小,熔点低(97.8℃),密度小于水大于煤油(0.971g·cm-3)
化学性质:
强还原性金属单质
1、与氧气的反应:4Na + O2 = 2Na2O
2Na + O2 Na2O2
2、与水的反应:
2Na + 2H2O = 2NaOH + H2↑
变暗
先熔化后燃烧,发出黄色火焰,生成淡黄色固体
浮、熔、游、响、红
二、氧化钠和过氧化钠
氧化钠 过氧化钠
物理性质
化学性质
制备方法
用途
白色固体
淡黄色固体
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 2CO2 = 2Na2CO3+ O2↑
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
氧化剂、还原剂都是过氧化钠,反应转移了2个电子
二、氧化钠和过氧化钠
氧化钠 过氧化钠
物理性质
化学性质
制备方法
用途 ——
白色固体
淡黄色固体
Na2O + H2O = 2NaOH
Na2O + CO2 = Na2CO3
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
4Na + O2 = 2Na2O
2Na + O2 Na2O2
供氧剂、漂白剂
三、碳酸钠和碳酸氢钠
碳酸钠 碳酸氢钠
物理性质
化学性质 CaCl2
Ca(OH)2
NaOH
加热
CO2
溶液性质
Ca(OH)2 + NaHCO3=CaCO3↓ + H2O + NaOH
CO32- + Ca2+ =CaCO3↓
白色粉末,遇水结晶,放热,溶解度较大
白色晶体,遇水溶解,吸热,溶解度很小
不反应
CO32- + Ca2+ =CaCO3↓
Ca(OH)2 + 2NaHCO3=CaCO3↓ + 2H2O + Na2CO3
不反应
NaHCO3+ NaOH = Na2CO3 + H2O
不反应
2NaHCO3 Na2CO3 + H2O + CO2↑
Na2CO3+ CO2 +H2O =2NaHCO3
不反应
碱性较强
碱性较弱
三、碳酸钠和碳酸氢钠
碳酸钠 碳酸氢钠
制备
用途
NaCl + NH3 + CO2 + H2O=
NaHCO3↓ + NH4Cl
NaCl + NH3 + CO2 + H2O=
NaHCO3↓ + NH4Cl
2NaHCO3 Na2CO3 + H2O + CO2↑
制玻璃、制肥皂、
造纸工业、纺织工业
胃药、灭火器、
食品工业中的膨化剂
思考与交流:如何区分碳酸钠和碳酸氢钠固体?
1、加热,将生成的气体通入澄清石灰水
2、直接观察外观
3、溶于水加酚酞
4、溶于水加氯化钙溶液
溶于水加氢氧化钙溶液?加氢氧化钠溶液?
思考与交流:在灭火器中不使用碳酸钠而使用碳酸氢钠的原因是什么?
1、相同质量,碳酸氢钠生成的二氧化碳更多
2、生成同样的二氧化碳,碳酸氢钠消耗的酸性物质更少
3、碳酸氢钠成本更低
四、焰色试验:
很多金属及其化合物在灼烧时会使火焰呈现出特征颜色,根据这种现象可以定性判断试样中所含的金属元素,这种操作称为焰色试验。
Na的焰色为黄色,K的焰色为紫色
透过蓝色钴玻璃观察
(滤去可能存在的钠盐的黄光)
五、氯气:
物理性质:氯气是黄绿色有刺激性气味的气体,有毒,可溶于水,易液化,密度大于空气
化学性质:强氧化性非金属单质
2Na + Cl2 2NaCl
Cu + Cl2 CuCl2
2Fe + 3Cl2 2FeCl3
H2 + Cl2 2HCl
氢气在氯气中安静的燃烧,发出苍白色火焰,在集气瓶口形成白雾。
五、氯气:
化学性质:强氧化性非金属单质
2Na + Cl2 2NaCl
Cu + Cl2 CuCl2
2Fe + 3Cl2 2FeCl3
H2 + Cl2 2HCl
Cl2 + H2O = HCl + HClO
形成氯水,氯水具有的性质是:
酸性、强氧化性和漂白性
Cl2 + 2NaOH= NaCl + NaClO + H2O
制漂白液
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
制漂白粉
漂粉精
H+ Cl2 HClO
五、氯气:
制备方法:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
五、氯气:
用途:
自来水消毒、制漂白液、制漂白粉和漂粉精、制HCl
六、次氯酸:
HClO:一元弱酸,酸性弱于碳酸,见光易分解,具有强氧化性和漂白性
所以氯水应该保存在
2HClO 2HCl + O2↑
棕色试剂瓶
物质的量
1、物质的量是衡量物质所含微观粒子数目的物理量
一、物质的量:
符号是n 单位是mol
1mol任何物质所含的粒子数量为阿伏加德罗常数(符号为NA),NA大约为6.02×1023mol-1
2、摩尔质量:单位物质的量的物质所具有的质量
符号为M,单位为g/mol
物质的摩尔质量与其相对原子质量或相对分子质量的数值相同
3、气体摩尔体积:同温同压下,任何气体一定具有相同的气体摩尔体积
阿伏加德罗定律:相同温度和相同压强下,相同体积的任何气体一定具有相同的分子数(物质的量)
推论:同温同压下,气体的体积比等于其物质的量的比
标准状况下,任何气体的摩尔体积都约为22.4L/mol
0℃、101 kPa
4、物质的量浓度:单位体积溶液里所含溶质B的物质的量
符号为cB
单位为mol/L
物质的量
N(mol)
物质的质量
m(g)
÷M
×M
粒子数
N
×NA
÷NA
标准状况下
气体的体积
V (L)
×22.4L·mol-1
÷22.4L·mol-1
物质的
量浓度
CB(mol·L-1)
×V液
÷V液
关系式
方程式中的
系数比等于
物质的量之比
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
溶质的质量分数
5、配制一定物质的量浓度的溶液:
以固体配制为例,用到的仪器有:
一定规格的容量瓶、天平、烧杯、量筒、玻璃棒、胶头滴管
⑴容量瓶要先检漏
⑵计算
⑶称量
⑷溶解(少量水,搅拌)
⑸移液(玻璃棒引流)
⑹洗涤(洗涤液一并转移到容量瓶中)
⑺定容(利用胶头滴管进行定容)
⑻摇匀
无影响
不变
不变
容量瓶或烧杯中未干燥
偏大
减小
不变
定容时俯视读数
偏小
增大
不变
定容时仰视读数
偏小
增大
不变
定容时加水多,用滴管吸出
偏大
减小
不变
未冷却到室温就注入容量瓶
偏小
不变
减小
未洗烧杯和玻璃棒
偏小
不变
减小
向容量瓶中注液时少量流出
溶液浓度
溶液体积
溶质质量
引起误差的一些操作
