化学人教版(2019)必修第一册3.1.2铁及其氧化物、氢氧化物 课件(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.2铁及其氧化物、氢氧化物 课件(共39张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 53.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-03 15:22:46 | ||
图片预览









文档简介
(共39张PPT)
§3.1.2 铁及其氧化物、氢氧化物
§3.1 铁的多样性
【问题】铁有哪些物理性质?
铁是一种银白色、有金属光泽的固体,具有良好的导电、导热和延展性,具有磁性;
纯铁的抗腐蚀能力很强。
物理性质
一、铁的主要性质
铁的化学性质
(1)与非氧化性酸反应
思考讨论:以钠为例,分析活泼金属单质一般能与哪些物质反应?
与酸反应放出H2、与盐发生置换反应,与非金属单质如Cl2、与水反应
Fe+H2SO4 == FeSO4+H2↑
铁丝与稀硫酸反应
Fe+H+ == Fe2++H2↑
2.与盐反应
Fe+CuSO4 == Cu+FeSO4
铁丝与硫酸铜反应
Fe+Cu2+ == Cu+Fe2+
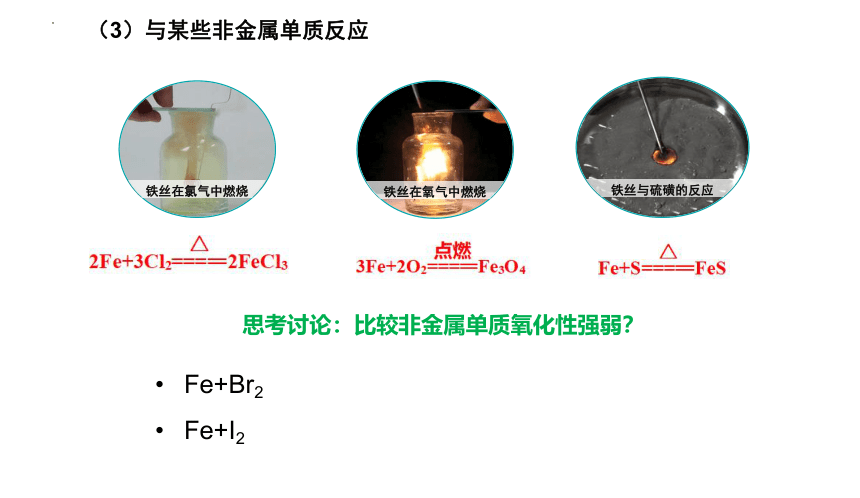
(3)与某些非金属单质反应
铁丝在氧气中燃烧
铁丝在氯气中燃烧
铁丝与硫磺的反应
思考讨论:比较非金属单质氧化性强弱?
Fe+Br2
Fe+I2
在Fe与Cl2的反应、Fe与盐酸的反应、Fe与CuSO4溶液的反应中,铁元素化合价的变化有何异同?为什么会有这样的异同?
(4)与氧化性酸(如稀硝酸)反应得不到H2
Fe+4HNO3(稀) == Fe(NO3)3+NO↑+2H2O
Fe在冷的浓硫酸、浓硝酸中会发生钝化
生活经验告诉我们,在常温下,铁与水是不发生反应的。那么,在高温下,铁能否与水发生反应呢
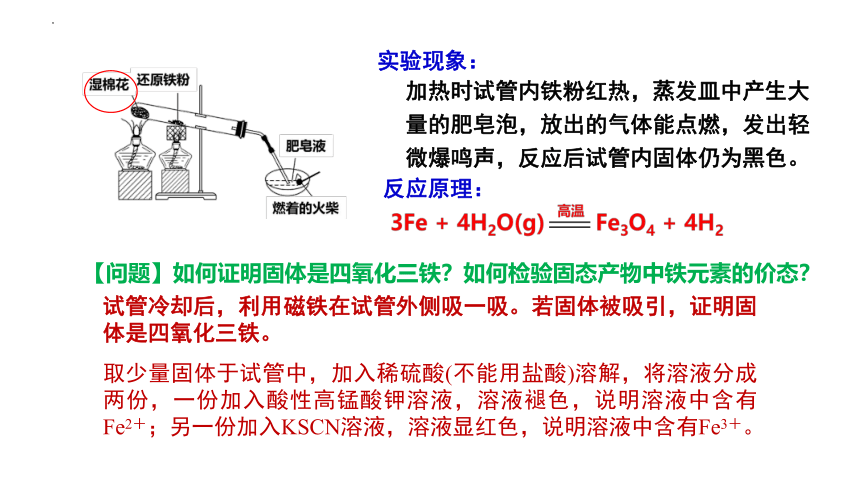
探究:有人设计了如图所示的装置,进行还原铁粉与水蒸气反应的实验。请讨论该装置的实验原理,并根据实验现象,分析可能的生成物。
(5)与水反应
试管冷却后,利用磁铁在试管外侧吸一吸。若固体被吸引,证明固体是四氧化三铁。
取少量固体于试管中,加入稀硫酸(不能用盐酸)溶解,将溶液分成两份,一份加入酸性高锰酸钾溶液,溶液褪色,说明溶液中含有Fe2+;另一份加入KSCN溶液,溶液显红色,说明溶液中含有Fe3+。
加热时试管内铁粉红热,蒸发皿中产生大量的肥皂泡,放出的气体能点燃,发出轻微爆鸣声,反应后试管内固体仍为黑色。
【问题】如何证明固体是四氧化三铁?如何检验固态产物中铁元素的价态?
实验现象:
反应原理:
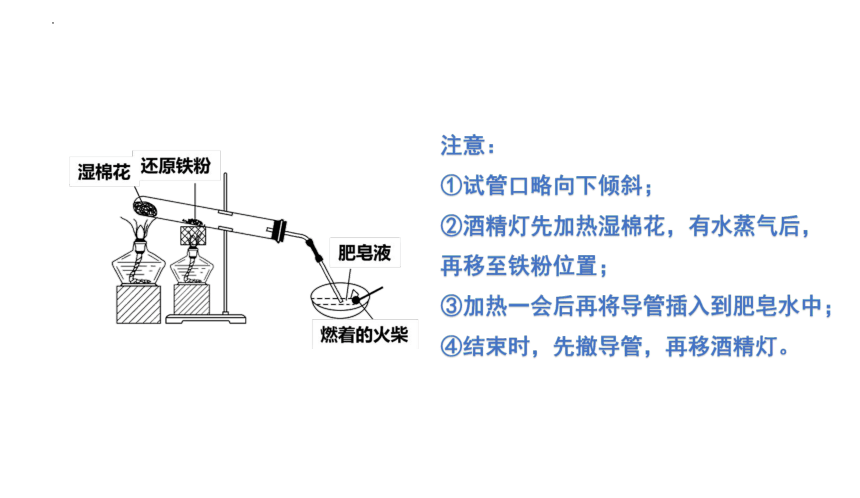
注意:
①试管口略向下倾斜;
②酒精灯先加热湿棉花,有水蒸气后,再移至铁粉位置;
③加热一会后再将导管插入到肥皂水中;
④结束时,先撤导管,再移酒精灯。
思考:在钢铁厂的生产中,炽热的铁水或者是钢水注入模具之前,模具必须进行充分的干燥,这样操作的原因是什么?
避免高温下铁与水反应,生成四氧化三铁
3Fe + 4H2O(g) Fe3O4 + 4H2
高温
(1)反应开始时,应先点燃___处的酒精灯,其目的是_____________________,若点燃顺序反了,可能有什么后果?
【例】利用如图装置也可以实现Fe与水蒸气的反应
b
用水蒸气排装置内的空气
答案:①Fe与O2生成了Fe3O4,无法与水蒸气反应;
②Fe与水蒸气反应生成H2,在高温下与空气中的O2反应可能发生爆炸。
(2)此装置如何检验Fe与水蒸气反应生成的气体产物?
答案:用小试管收集一试管气体,点燃,听到轻微爆鸣声,证明生成了H2。
铁粉与水蒸气反应的几种装置
水蒸气的发生装置
水蒸气与铁粉反应装置
产物收集装置
A.反应生成FeO
B.湿棉花的主要作用是冷却试管,防止炸裂
C.肥皂液的主要作用是检验生成的H2
D.铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来
【学习评价】还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( )
C
Fe
Fe2O3
FeO
Fe3O4
FeCl3
FeCl2
弱氧化剂(HCl)
Fe - 2e─→Fe2+
强氧
化
剂
O2 (缓慢氧化)
Cl2/加热
H2O/高温
O2/点燃
Fe - 3e─→Fe3+
课堂总结——价类二维图
氧化亚铁
(FeO)
氧化铁
(Fe2O3)
四氧化三铁
(Fe3O4)
三、铁的氧化物
【问题】铁元素能形成哪些氧化物?并说说它们的颜色。
名称 氧化亚铁 氧化铁 四氧化三铁
化学式
铁元素化合价
俗称
色、态
水溶性 1.铁的氧化物的物理性质
FeO
Fe2O3
Fe3O4
+2
+3
+2、+3
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
均不溶于水
特殊氧化物
有固定组成,纯净物
碱性氧化物
2.铁的氧化物的化学性质
名称 氧化亚铁 氧化铁 四氧化三铁
稳定性
类别
与酸反应(离子方程式) 氧化性 与CO、C、H2反应生成单质铁及CO2或H2O 用途
不稳定,受热转化为四氧化三铁。
稳定
稳定
碱性氧化物
复杂氧化物
红色油漆和涂料、炼铁原料
制录音磁带、作打印机墨粉
Fe3O4+8H+=2Fe3++Fe2++4H2O
3CO+Fe2O3== 2Fe+3CO2
高温
铁的冶炼
FeO、Fe2O3、Fe3O4、MnO2、WO3、V2O5等难熔金属氧化物与铝粉的反应叫铝热反应,常用KClO3和镁条引发该反应,反应放出大量热。
3.铝热反应
铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序中铝后的金属的氧化物反应。
铝热剂
实验装置 Al与MgO能否高温时反应?
实验现象 实验原理
应用
①镁带剧烈燃烧,放出一定的热,并发出耀眼的白光,氧化铁和铝粉在较高温度下发生剧烈的反应;②纸漏斗的下部被烧穿,有红热熔融物落入沙中;熔融物冷却后变黑,能被磁铁吸引。
高温下,铝与氧化铁发生反应,放出大量的热,反应的化学方程式为:
2Al+Fe2O3 Al2O3+2Fe
高温
①制取熔点较高、活泼性弱于Al的金属铬、锰、钨等;②金属焊接,如野外焊接钢轨等
镁条燃烧放热达到反应所需要的高温条件,氯酸钾受热分解产生氧气,促进燃烧。
Ⅰ.作为冶炼金属的原料,如赤铁矿
Ⅱ.氧化铁常用于制造红色油漆和涂料
Ⅲ.特制的磁性氧化铁可做录音磁带和电信器材。
4.铁的氧化物的用途
IV.铝热反应:焊接钢轨、制备金属纳米材料。
Fe2O3+2Al ═ 2 Fe+Al2O3
高温
砖的颜色为何有青有红?
为什么用相同的材料制成的砖的颜色会不相同呢?
在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成________而制得红色的砖瓦。若烘烧后期从窑顶慢慢浇水,窑内会产生大量的________气体,它们把红色的物质还原成的黑色化合物是___________,同时还有没烧完的碳颗粒,从而制得了青色砖瓦。
Fe2O3
H2、CO
FeO 、Fe3O4
砖瓦的颜色为何有青有红?
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
四、铁的氢氧化物
实验探究
现象:
离子方程式:
有红褐色沉淀生成
Fe3++3OH-=Fe(OH)3↓
白色沉淀 灰绿色 红褐色
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
四、铁的氢氧化物
FeCl3中滴入NaOH
Fe2(SO4)3中滴入NaOH
利用可溶性铁盐、亚铁盐与碱溶液反应制备
化学式 Fe(OH)2 Fe(OH)3
物质类别 二元弱碱 三元弱碱
颜色状态
制备
与O2反应
碱性 (与酸反应)
稳定性
白色固体
红褐色固体
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
2Fe(OH)3 Fe2O3+3H2O
四、铁的氢氧化物
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe3++3OH- =Fe(OH)3↓
Fe2++2OH- =Fe(OH)2↓
Fe(OH)2 FeO+H2O
(隔绝空气)
1. 用新配制的FeSO4溶液(如含有Fe3+,加入铁丝或铁粉,再加入几滴稀硫酸。
2.用不含O2的蒸馏水配制的NaOH溶液,配制过程中不摇动容器,减少空气溶入(除去蒸馏水中溶解的O2常采用煮沸的方法)。
1.生成白色Fe(OH)2沉淀的操作可采用长滴管吸满不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。不要将滴管中的溶液全部挤出,以防空气进入溶液引起氧化。
2.用苯、植物油将反应体系与空气隔离。
反应物:
反应环境:
【学习评价】有关铁的化合物的说法中,错误的是( )
A. 由图示操作可制取Fe(OH)2
B. Fe3O4、Fe(OH)3都可以由化合反应制得
C. Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
D. Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化为红褐色
D
还原性气体保护法
有机覆盖层法
总结:Fe2+、Fe3+、Fe之间的相互转化关系——铁三角
金属单质(Zn到Cu)、H2S、S2-、I-
等还原剂
Cl2、Br2、HNO3、H2O2、KMnO4
等氧化剂
S、I2、非氧化性酸等
弱氧化剂
金属单质、H2、CO等
还原剂
金属单质、H2、CO等
还原剂
Cl2、Br2、HNO3等强氧化剂
Fe
0
Fe
+3
Fe
2+
只有还原性
有氧化性、还原性
只有氧化性
营养学家建议:补铁剂与Vc同服可以增加对铁元素的吸收。
维生素C具有还原性还是还原性?
加2滴
KSCN溶液
FeCl3
加入维C
红色消失
Fe3+ Fe2+
加入Vc
活动 探究
补铁剂中铁元素价态的检验
实验用品:某补铁口服液、H2SO4溶液、NaOH溶液、酸性KMnO4溶液、氯水、KSCN溶液
若同时含有Fe2+和Fe3+,如何检验?
能否将KMnO4和KSCN滴入同一试管验证?
能否用NaOH?
【课后习题】
1.为除去FeCl2溶液中含有的少量的FeCl3杂质,可选用的最佳药品是 ( )
A.滴入KSCN溶液 B.通入氯气
C.加入铜粉 D.加入铁粉
D
2.有NaCl、FeCl3、FeCl2、MgCl2四种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.硫氰酸钾溶液 D.硝酸银溶液
B
【课后习题】
3.离子方程式:Fe(OH)3溶于HI溶液中
4.铁生锈过程中发生反应的化学方程式
5.离子方程式:Fe3+与Fe、Cu的混合物作用
6.过量的Fe与Cl2反应
总结
有关铁及铁的化合物的计算
§3.1.2 铁及其氧化物、氢氧化物
§3.1 铁的多样性
【问题】铁有哪些物理性质?
铁是一种银白色、有金属光泽的固体,具有良好的导电、导热和延展性,具有磁性;
纯铁的抗腐蚀能力很强。
物理性质
一、铁的主要性质
铁的化学性质
(1)与非氧化性酸反应
思考讨论:以钠为例,分析活泼金属单质一般能与哪些物质反应?
与酸反应放出H2、与盐发生置换反应,与非金属单质如Cl2、与水反应
Fe+H2SO4 == FeSO4+H2↑
铁丝与稀硫酸反应
Fe+H+ == Fe2++H2↑
2.与盐反应
Fe+CuSO4 == Cu+FeSO4
铁丝与硫酸铜反应
Fe+Cu2+ == Cu+Fe2+
(3)与某些非金属单质反应
铁丝在氧气中燃烧
铁丝在氯气中燃烧
铁丝与硫磺的反应
思考讨论:比较非金属单质氧化性强弱?
Fe+Br2
Fe+I2
在Fe与Cl2的反应、Fe与盐酸的反应、Fe与CuSO4溶液的反应中,铁元素化合价的变化有何异同?为什么会有这样的异同?
(4)与氧化性酸(如稀硝酸)反应得不到H2
Fe+4HNO3(稀) == Fe(NO3)3+NO↑+2H2O
Fe在冷的浓硫酸、浓硝酸中会发生钝化
生活经验告诉我们,在常温下,铁与水是不发生反应的。那么,在高温下,铁能否与水发生反应呢
探究:有人设计了如图所示的装置,进行还原铁粉与水蒸气反应的实验。请讨论该装置的实验原理,并根据实验现象,分析可能的生成物。
(5)与水反应
试管冷却后,利用磁铁在试管外侧吸一吸。若固体被吸引,证明固体是四氧化三铁。
取少量固体于试管中,加入稀硫酸(不能用盐酸)溶解,将溶液分成两份,一份加入酸性高锰酸钾溶液,溶液褪色,说明溶液中含有Fe2+;另一份加入KSCN溶液,溶液显红色,说明溶液中含有Fe3+。
加热时试管内铁粉红热,蒸发皿中产生大量的肥皂泡,放出的气体能点燃,发出轻微爆鸣声,反应后试管内固体仍为黑色。
【问题】如何证明固体是四氧化三铁?如何检验固态产物中铁元素的价态?
实验现象:
反应原理:
注意:
①试管口略向下倾斜;
②酒精灯先加热湿棉花,有水蒸气后,再移至铁粉位置;
③加热一会后再将导管插入到肥皂水中;
④结束时,先撤导管,再移酒精灯。
思考:在钢铁厂的生产中,炽热的铁水或者是钢水注入模具之前,模具必须进行充分的干燥,这样操作的原因是什么?
避免高温下铁与水反应,生成四氧化三铁
3Fe + 4H2O(g) Fe3O4 + 4H2
高温
(1)反应开始时,应先点燃___处的酒精灯,其目的是_____________________,若点燃顺序反了,可能有什么后果?
【例】利用如图装置也可以实现Fe与水蒸气的反应
b
用水蒸气排装置内的空气
答案:①Fe与O2生成了Fe3O4,无法与水蒸气反应;
②Fe与水蒸气反应生成H2,在高温下与空气中的O2反应可能发生爆炸。
(2)此装置如何检验Fe与水蒸气反应生成的气体产物?
答案:用小试管收集一试管气体,点燃,听到轻微爆鸣声,证明生成了H2。
铁粉与水蒸气反应的几种装置
水蒸气的发生装置
水蒸气与铁粉反应装置
产物收集装置
A.反应生成FeO
B.湿棉花的主要作用是冷却试管,防止炸裂
C.肥皂液的主要作用是检验生成的H2
D.铁粉与水蒸气反应后,可立即用磁铁将剩余铁粉分离出来
【学习评价】还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( )
C
Fe
Fe2O3
FeO
Fe3O4
FeCl3
FeCl2
弱氧化剂(HCl)
Fe - 2e─→Fe2+
强氧
化
剂
O2 (缓慢氧化)
Cl2/加热
H2O/高温
O2/点燃
Fe - 3e─→Fe3+
课堂总结——价类二维图
氧化亚铁
(FeO)
氧化铁
(Fe2O3)
四氧化三铁
(Fe3O4)
三、铁的氧化物
【问题】铁元素能形成哪些氧化物?并说说它们的颜色。
名称 氧化亚铁 氧化铁 四氧化三铁
化学式
铁元素化合价
俗称
色、态
水溶性 1.铁的氧化物的物理性质
FeO
Fe2O3
Fe3O4
+2
+3
+2、+3
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
均不溶于水
特殊氧化物
有固定组成,纯净物
碱性氧化物
2.铁的氧化物的化学性质
名称 氧化亚铁 氧化铁 四氧化三铁
稳定性
类别
与酸反应(离子方程式) 氧化性 与CO、C、H2反应生成单质铁及CO2或H2O 用途
不稳定,受热转化为四氧化三铁。
稳定
稳定
碱性氧化物
复杂氧化物
红色油漆和涂料、炼铁原料
制录音磁带、作打印机墨粉
Fe3O4+8H+=2Fe3++Fe2++4H2O
3CO+Fe2O3== 2Fe+3CO2
高温
铁的冶炼
FeO、Fe2O3、Fe3O4、MnO2、WO3、V2O5等难熔金属氧化物与铝粉的反应叫铝热反应,常用KClO3和镁条引发该反应,反应放出大量热。
3.铝热反应
铝热反应是在高温干态下进行的置换反应,铝只能与排在金属活动性顺序中铝后的金属的氧化物反应。
铝热剂
实验装置 Al与MgO能否高温时反应?
实验现象 实验原理
应用
①镁带剧烈燃烧,放出一定的热,并发出耀眼的白光,氧化铁和铝粉在较高温度下发生剧烈的反应;②纸漏斗的下部被烧穿,有红热熔融物落入沙中;熔融物冷却后变黑,能被磁铁吸引。
高温下,铝与氧化铁发生反应,放出大量的热,反应的化学方程式为:
2Al+Fe2O3 Al2O3+2Fe
高温
①制取熔点较高、活泼性弱于Al的金属铬、锰、钨等;②金属焊接,如野外焊接钢轨等
镁条燃烧放热达到反应所需要的高温条件,氯酸钾受热分解产生氧气,促进燃烧。
Ⅰ.作为冶炼金属的原料,如赤铁矿
Ⅱ.氧化铁常用于制造红色油漆和涂料
Ⅲ.特制的磁性氧化铁可做录音磁带和电信器材。
4.铁的氧化物的用途
IV.铝热反应:焊接钢轨、制备金属纳米材料。
Fe2O3+2Al ═ 2 Fe+Al2O3
高温
砖的颜色为何有青有红?
为什么用相同的材料制成的砖的颜色会不相同呢?
在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成________而制得红色的砖瓦。若烘烧后期从窑顶慢慢浇水,窑内会产生大量的________气体,它们把红色的物质还原成的黑色化合物是___________,同时还有没烧完的碳颗粒,从而制得了青色砖瓦。
Fe2O3
H2、CO
FeO 、Fe3O4
砖瓦的颜色为何有青有红?
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
四、铁的氢氧化物
实验探究
现象:
离子方程式:
有红褐色沉淀生成
Fe3++3OH-=Fe(OH)3↓
白色沉淀 灰绿色 红褐色
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
四、铁的氢氧化物
FeCl3中滴入NaOH
Fe2(SO4)3中滴入NaOH
利用可溶性铁盐、亚铁盐与碱溶液反应制备
化学式 Fe(OH)2 Fe(OH)3
物质类别 二元弱碱 三元弱碱
颜色状态
制备
与O2反应
碱性 (与酸反应)
稳定性
白色固体
红褐色固体
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3++3H2O
2Fe(OH)3 Fe2O3+3H2O
四、铁的氢氧化物
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe3++3OH- =Fe(OH)3↓
Fe2++2OH- =Fe(OH)2↓
Fe(OH)2 FeO+H2O
(隔绝空气)
1. 用新配制的FeSO4溶液(如含有Fe3+,加入铁丝或铁粉,再加入几滴稀硫酸。
2.用不含O2的蒸馏水配制的NaOH溶液,配制过程中不摇动容器,减少空气溶入(除去蒸馏水中溶解的O2常采用煮沸的方法)。
1.生成白色Fe(OH)2沉淀的操作可采用长滴管吸满不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。不要将滴管中的溶液全部挤出,以防空气进入溶液引起氧化。
2.用苯、植物油将反应体系与空气隔离。
反应物:
反应环境:
【学习评价】有关铁的化合物的说法中,错误的是( )
A. 由图示操作可制取Fe(OH)2
B. Fe3O4、Fe(OH)3都可以由化合反应制得
C. Fe(OH)3胶体呈红褐色、透明,能发生丁达尔效应
D. Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化为红褐色
D
还原性气体保护法
有机覆盖层法
总结:Fe2+、Fe3+、Fe之间的相互转化关系——铁三角
金属单质(Zn到Cu)、H2S、S2-、I-
等还原剂
Cl2、Br2、HNO3、H2O2、KMnO4
等氧化剂
S、I2、非氧化性酸等
弱氧化剂
金属单质、H2、CO等
还原剂
金属单质、H2、CO等
还原剂
Cl2、Br2、HNO3等强氧化剂
Fe
0
Fe
+3
Fe
2+
只有还原性
有氧化性、还原性
只有氧化性
营养学家建议:补铁剂与Vc同服可以增加对铁元素的吸收。
维生素C具有还原性还是还原性?
加2滴
KSCN溶液
FeCl3
加入维C
红色消失
Fe3+ Fe2+
加入Vc
活动 探究
补铁剂中铁元素价态的检验
实验用品:某补铁口服液、H2SO4溶液、NaOH溶液、酸性KMnO4溶液、氯水、KSCN溶液
若同时含有Fe2+和Fe3+,如何检验?
能否将KMnO4和KSCN滴入同一试管验证?
能否用NaOH?
【课后习题】
1.为除去FeCl2溶液中含有的少量的FeCl3杂质,可选用的最佳药品是 ( )
A.滴入KSCN溶液 B.通入氯气
C.加入铜粉 D.加入铁粉
D
2.有NaCl、FeCl3、FeCl2、MgCl2四种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.硫氰酸钾溶液 D.硝酸银溶液
B
【课后习题】
3.离子方程式:Fe(OH)3溶于HI溶液中
4.铁生锈过程中发生反应的化学方程式
5.离子方程式:Fe3+与Fe、Cu的混合物作用
6.过量的Fe与Cl2反应
总结
有关铁及铁的化合物的计算
