化学人教版(2019)必修第一册2.2.2氯气的实验室制法 课件(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.2.2氯气的实验室制法 课件(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 21.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-04 13:48:43 | ||
图片预览







文档简介
(共30张PPT)
氯及其化合物
氧化
漂白
消毒
课时二
氯气
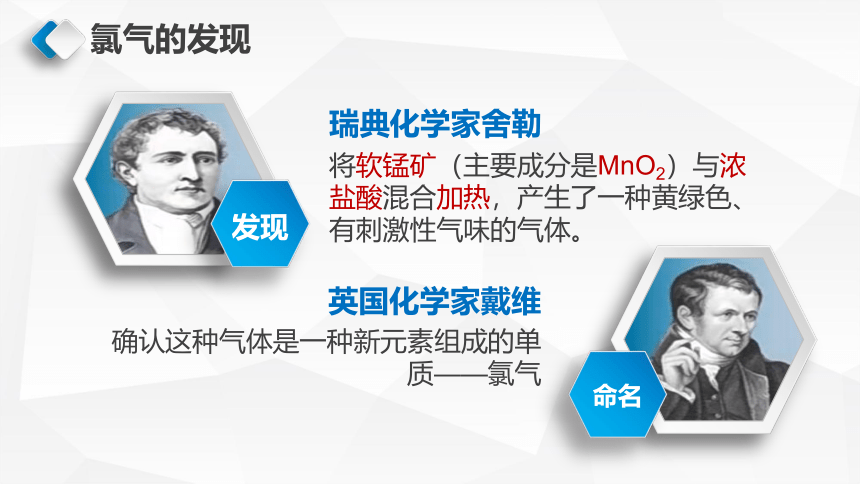
氯气的发现
将软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。
瑞典化学家舍勒
发现
命名
确认这种气体是一种新元素组成的单质——氯气
英国化学家戴维
氯气的实验室制法
01
氯气的实验室制法
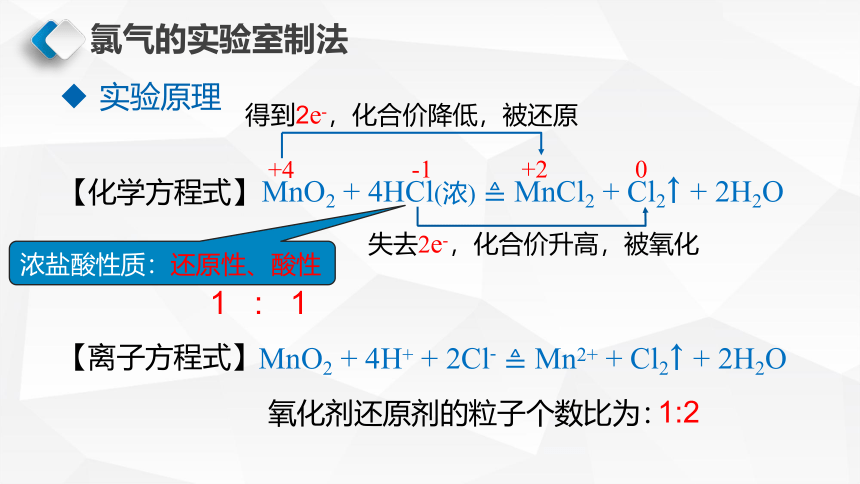
实验原理
【化学方程式】
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
【离子方程式】
+4
0
+2
得到2e-,化合价降低,被还原
失去2e-,化合价升高,被氧化
-1
浓盐酸性质:还原性、酸性
MnO2 + 4H+ + 2Cl- Mn2+ + Cl2↑ + 2H2O
氧化剂还原剂的粒子个数比为:
1:2
1 : 1
氯气的实验室制法
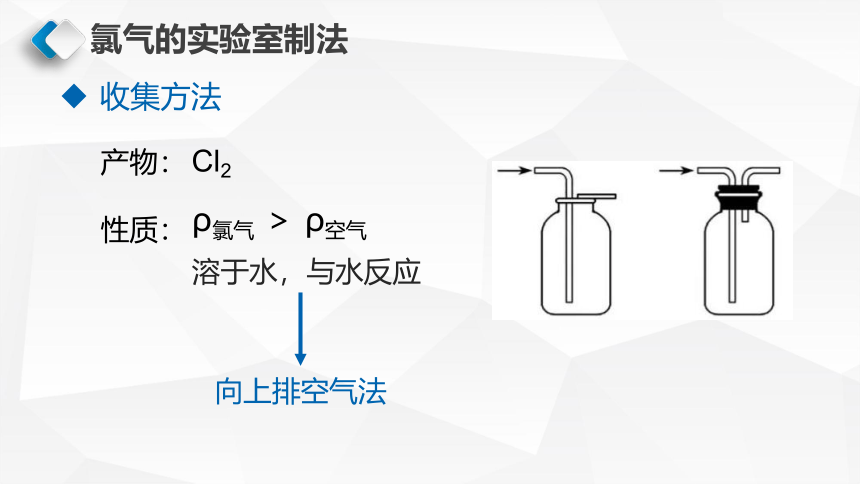
收集方法
产物:
性质:
溶于水,与水反应
Cl2
ρ氯气 > ρ空气
向上排空气法
氯气的实验室制法
验满方法
(1)观察集气瓶口呈黄绿色,则收集满
(2)将湿润的淀粉-KI试纸放在集气瓶口,观察到试纸变蓝,则证明已集满。
用NaOH溶液吸收过量的Cl2,防止污染空气
Cl2 + 2I- = 2Cl- + I2
尾气处理
(3)将湿润的蓝色石蕊试纸放在集气瓶口,观察到试纸立即先变红后褪色,则证明已集满。
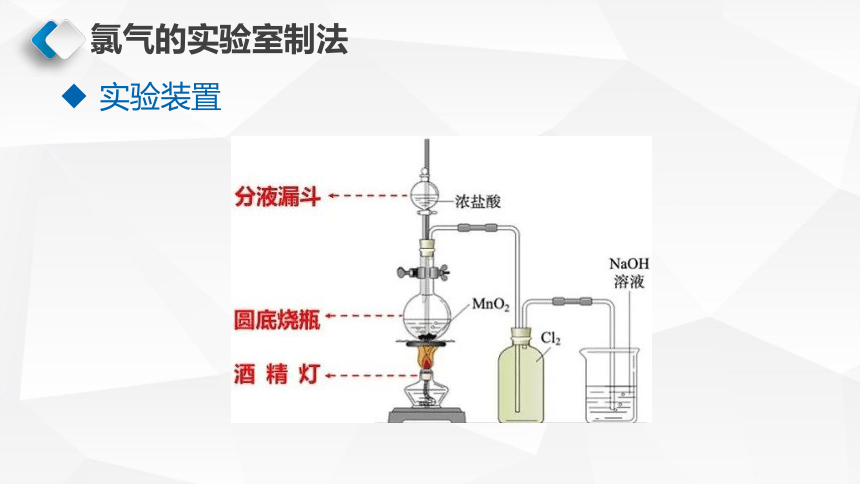
氯气的实验室制法
实验装置
氯气的实验室制法
氯气的实验室制法
注意事项
(1)必须用浓盐酸,MnO2与稀盐酸不反应。
(2)实际称取MnO2质量必须适当多于理论值,因为有一部分Cl2会滞留在发生装置中。
(4)实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。
(3)尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全。
氯气的实验室制法
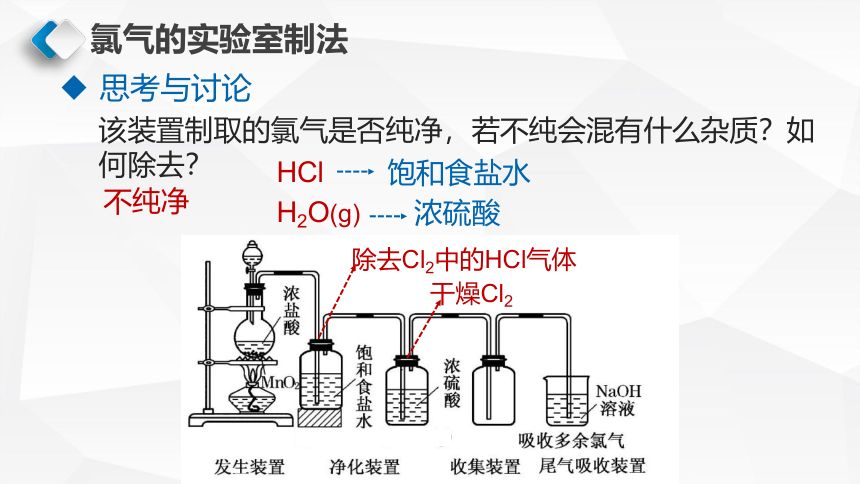
思考与讨论
该装置制取的氯气是否纯净,若不纯会混有什么杂质?如何除去?
不纯净
HCl
H2O(g)
饱和食盐水
浓硫酸
干燥Cl2
除去Cl2中的HCl气体
氯气的其他实验室制法
固液不加热
2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
KClO3 + 5HCl(浓) = KCl + 3Cl2↑ + 3H2O
氯气的工业制法
02
氯气的工业制法
电解饱和食盐水
2NaCl + 2H2O 2NaOH + Cl2↑ + H2↑
氯碱工业
Cl-的检验
03
Cl-的检验
【实验探究】在三只试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
Cl-的检验
试液2~3mL 实验现象 离子方程式
滴入几滴硝酸银溶液 加入少量稀硝酸 稀盐酸
氯化钠溶液
碳酸钠溶液
生成白色沉淀
Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O
Cl- + Ag+ = AgCl
生成白色沉淀
沉淀不溶解
沉淀不溶解
生成白色沉淀
沉淀溶解,有气泡产生
Cl- + Ag+ = AgCl
CO2- + 2Ag+ = Ag2CO3
3
Cl-的检验
方法总结
试剂:稀硝酸、AgNO3溶液
排除的 干扰
CO2-
3
现象:有白色沉淀生成
Cl-的检验答题模板
取少量试液于试管中,先滴加适量稀硝酸,再滴入AgNO3溶液,若产生白色沉淀,则含有Cl-。
实验室制气体的基本思路
04
设计气体制备装置的基本思路
第一步
第二步
第三步
第四步
明确气体制备的原理,写出相应的化学方程式
根据药品状态 反应条件,选择合适的反应装置
分析气体是否含有杂质, 根据气体和杂质性质的差异选择除杂、净化方法
根据气体性质选择收集装置,分析是否需要尾气处理装置
气体制备装置的连接顺序
气体发生装置
01
02
03
04
气体净化装置
气体干燥装置
气体收集或性质检验装置
05
尾气收集装置
气体发生装置的选择
反应原理、反应物的状态、反应条件等。
选择依据
发生装置的基本类型
固+液―→气
气体净化装置的选择
不减少被净化气体的量,不引入新杂质。
净化原则
净化装置的基本类型
盛液体除杂试剂
气流:长进短出
洗气瓶
U形管
球形干燥管
盛固体除杂试剂
气流:粗进细出
气体净化装置的选择
不能与被干燥气体反应
干燥剂的选择原则
干燥剂分类
酸性干燥剂:P2O5(粉末)、硅胶(固体颗粒)、浓硫酸
碱性干燥剂:碱石灰(粉末)
中性干燥剂:无水CaCl2(白色多孔固体)
强氧化性,不能干燥还原性气体,如H2S
不能干燥NH3
酸性气体:CO2、NO2、SO2、Cl2、HCl、H2S
碱性气体:NH3
中性气体:N2、O2、H2
气体收集装置的选择
气体的密度、水溶性以及是否与水或氧气发生反应
选择依据
方法选择
排水法
向上排空气法
向下排空气法
尾气处理装置的选择
根据气体的物理、化学性质,将其转化成无毒物质或吸收
选择依据
方法选择
点燃法:如CO、H2、CH4等易燃气体可用此法,必须先验纯,再点燃。
吸收法:如Cl2、SO2、H2S、HCl等可用碱液吸收。
尾气处理装置的选择
吸收法:如Cl2、SO2、H2S、HCl等可用碱液吸收。
用于吸收溶解或反应速率不是很快的气体,如用NaOH溶液吸收Cl2、CO2等。
用于吸收极易溶且溶解很快的气体,如HCl、HBr、NH3等。
防倒吸
随堂练习
例1:某小组同学利用如图1装置制备NaClO溶液,并设计实验(如图2所示)探究NaClO的性质。
关于图2,下列说法不正确的是( )A.I中溶液褪色的原因是:稀硫酸的加入,减弱了溶液的碱性B.II中使溶液褪色的物质是HClOC.III中产生黄绿色气体的可能原因是:ClO-+Cl-+2H+=Cl2+H2OD.对比I和III可知,加入的酸的浓度不同,发生的反应不同
A
随堂练习
例2:如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)
已知:装置A是氯气的发生装置,反应的化学方程式为:
Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O据此回答下列问题:(1)装置B中饱和食盐水的作用是 。
(2)装置D的作用是 ,则烧杯中的溶液是 ,写出所发生反应的化学方程式: 。
答案:(1)除去Cl2中的HCl
(2)吸收多余的氯气,防止污染空气;NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O
随堂练习
例3:氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。某化学兴趣小组用氯气和相应的碱溶液反应制取NaClO和KClO3,制备装置如图所示(部分加持仪器略去),并研究KClO3的氧化性。已知:氯气与碱反应,温度较高时生成ClO3-,温度较低时生成ClO-。
(1)盛装浓盐酸的仪器名称是 。(2)装置A烧瓶中反应的化学方程式为 。(3)装置D中Cl2与试剂B反应的离子方程式为 。(4)E中最好选用试剂为 (填标号),其作用是 。A.Na2SO4溶液 B.浓H2SO4 C.饱和NaCl溶液 D.NaOH溶液
氧化
漂白
消毒
氯气
THANKS
谢谢观看
氯及其化合物
氧化
漂白
消毒
课时二
氯气
氯气的发现
将软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了一种黄绿色、有刺激性气味的气体。
瑞典化学家舍勒
发现
命名
确认这种气体是一种新元素组成的单质——氯气
英国化学家戴维
氯气的实验室制法
01
氯气的实验室制法
实验原理
【化学方程式】
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
【离子方程式】
+4
0
+2
得到2e-,化合价降低,被还原
失去2e-,化合价升高,被氧化
-1
浓盐酸性质:还原性、酸性
MnO2 + 4H+ + 2Cl- Mn2+ + Cl2↑ + 2H2O
氧化剂还原剂的粒子个数比为:
1:2
1 : 1
氯气的实验室制法
收集方法
产物:
性质:
溶于水,与水反应
Cl2
ρ氯气 > ρ空气
向上排空气法
氯气的实验室制法
验满方法
(1)观察集气瓶口呈黄绿色,则收集满
(2)将湿润的淀粉-KI试纸放在集气瓶口,观察到试纸变蓝,则证明已集满。
用NaOH溶液吸收过量的Cl2,防止污染空气
Cl2 + 2I- = 2Cl- + I2
尾气处理
(3)将湿润的蓝色石蕊试纸放在集气瓶口,观察到试纸立即先变红后褪色,则证明已集满。
氯气的实验室制法
实验装置
氯气的实验室制法
氯气的实验室制法
注意事项
(1)必须用浓盐酸,MnO2与稀盐酸不反应。
(2)实际称取MnO2质量必须适当多于理论值,因为有一部分Cl2会滞留在发生装置中。
(4)实验结束后,先使反应停止并排出装置中残留的Cl2,再拆卸装置,避免污染空气。
(3)尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全。
氯气的实验室制法
思考与讨论
该装置制取的氯气是否纯净,若不纯会混有什么杂质?如何除去?
不纯净
HCl
H2O(g)
饱和食盐水
浓硫酸
干燥Cl2
除去Cl2中的HCl气体
氯气的其他实验室制法
固液不加热
2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
KClO3 + 5HCl(浓) = KCl + 3Cl2↑ + 3H2O
氯气的工业制法
02
氯气的工业制法
电解饱和食盐水
2NaCl + 2H2O 2NaOH + Cl2↑ + H2↑
氯碱工业
Cl-的检验
03
Cl-的检验
【实验探究】在三只试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
Cl-的检验
试液2~3mL 实验现象 离子方程式
滴入几滴硝酸银溶液 加入少量稀硝酸 稀盐酸
氯化钠溶液
碳酸钠溶液
生成白色沉淀
Ag2CO3 + 2H+ = 2Ag+ + CO2↑ + H2O
Cl- + Ag+ = AgCl
生成白色沉淀
沉淀不溶解
沉淀不溶解
生成白色沉淀
沉淀溶解,有气泡产生
Cl- + Ag+ = AgCl
CO2- + 2Ag+ = Ag2CO3
3
Cl-的检验
方法总结
试剂:稀硝酸、AgNO3溶液
排除的 干扰
CO2-
3
现象:有白色沉淀生成
Cl-的检验答题模板
取少量试液于试管中,先滴加适量稀硝酸,再滴入AgNO3溶液,若产生白色沉淀,则含有Cl-。
实验室制气体的基本思路
04
设计气体制备装置的基本思路
第一步
第二步
第三步
第四步
明确气体制备的原理,写出相应的化学方程式
根据药品状态 反应条件,选择合适的反应装置
分析气体是否含有杂质, 根据气体和杂质性质的差异选择除杂、净化方法
根据气体性质选择收集装置,分析是否需要尾气处理装置
气体制备装置的连接顺序
气体发生装置
01
02
03
04
气体净化装置
气体干燥装置
气体收集或性质检验装置
05
尾气收集装置
气体发生装置的选择
反应原理、反应物的状态、反应条件等。
选择依据
发生装置的基本类型
固+液―→气
气体净化装置的选择
不减少被净化气体的量,不引入新杂质。
净化原则
净化装置的基本类型
盛液体除杂试剂
气流:长进短出
洗气瓶
U形管
球形干燥管
盛固体除杂试剂
气流:粗进细出
气体净化装置的选择
不能与被干燥气体反应
干燥剂的选择原则
干燥剂分类
酸性干燥剂:P2O5(粉末)、硅胶(固体颗粒)、浓硫酸
碱性干燥剂:碱石灰(粉末)
中性干燥剂:无水CaCl2(白色多孔固体)
强氧化性,不能干燥还原性气体,如H2S
不能干燥NH3
酸性气体:CO2、NO2、SO2、Cl2、HCl、H2S
碱性气体:NH3
中性气体:N2、O2、H2
气体收集装置的选择
气体的密度、水溶性以及是否与水或氧气发生反应
选择依据
方法选择
排水法
向上排空气法
向下排空气法
尾气处理装置的选择
根据气体的物理、化学性质,将其转化成无毒物质或吸收
选择依据
方法选择
点燃法:如CO、H2、CH4等易燃气体可用此法,必须先验纯,再点燃。
吸收法:如Cl2、SO2、H2S、HCl等可用碱液吸收。
尾气处理装置的选择
吸收法:如Cl2、SO2、H2S、HCl等可用碱液吸收。
用于吸收溶解或反应速率不是很快的气体,如用NaOH溶液吸收Cl2、CO2等。
用于吸收极易溶且溶解很快的气体,如HCl、HBr、NH3等。
防倒吸
随堂练习
例1:某小组同学利用如图1装置制备NaClO溶液,并设计实验(如图2所示)探究NaClO的性质。
关于图2,下列说法不正确的是( )A.I中溶液褪色的原因是:稀硫酸的加入,减弱了溶液的碱性B.II中使溶液褪色的物质是HClOC.III中产生黄绿色气体的可能原因是:ClO-+Cl-+2H+=Cl2+H2OD.对比I和III可知,加入的酸的浓度不同,发生的反应不同
A
随堂练习
例2:如图是实验室制备氯气并验证氯气性质的装置(其中夹持装置已省略)
已知:装置A是氯气的发生装置,反应的化学方程式为:
Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O据此回答下列问题:(1)装置B中饱和食盐水的作用是 。
(2)装置D的作用是 ,则烧杯中的溶液是 ,写出所发生反应的化学方程式: 。
答案:(1)除去Cl2中的HCl
(2)吸收多余的氯气,防止污染空气;NaOH溶液;Cl2+2NaOH=NaCl+NaClO+H2O
随堂练习
例3:氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。某化学兴趣小组用氯气和相应的碱溶液反应制取NaClO和KClO3,制备装置如图所示(部分加持仪器略去),并研究KClO3的氧化性。已知:氯气与碱反应,温度较高时生成ClO3-,温度较低时生成ClO-。
(1)盛装浓盐酸的仪器名称是 。(2)装置A烧瓶中反应的化学方程式为 。(3)装置D中Cl2与试剂B反应的离子方程式为 。(4)E中最好选用试剂为 (填标号),其作用是 。A.Na2SO4溶液 B.浓H2SO4 C.饱和NaCl溶液 D.NaOH溶液
氧化
漂白
消毒
氯气
THANKS
谢谢观看
