第六单元碳和碳的氧化物强化训练(含答案)-2023-2024学年九年级化学人教版上册
文档属性
| 名称 | 第六单元碳和碳的氧化物强化训练(含答案)-2023-2024学年九年级化学人教版上册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-04 17:06:37 | ||
图片预览


文档简介
第六单元《碳和碳的氧化物》强化训练
附相对原子质量:H-1;C-12;N-14;O-16;Ca-40;
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、央视栏目《典籍里的中国》展现了中国智慧。用墨书写的典籍保存至今仍不变色,体现了碳单质具有的性质是( )
A.质软 B.导电性 C.可燃性 D.常温稳定性
2、“碳中和”是指通过一定方式抵消人类活动产生的二氧化碳等温室气体排放量,达到相对“零排放”。下列做法中,有利于实现“碳中和”的是( )
A.大力开发新能源,禁止使用化石燃料
B.倡导植树造林,促进自然界中二氧化碳的循环
C.提倡多建造以煤为燃料的火力发电厂
D.加高烟囱,将燃烧产生的气体排向高空
3、物质的性质决定其用途,用途反映物质的性质。下列关于“物质—用途一性质”的说法不正确的是( )
A.氧气—火箭发射—可燃性
B.石墨—电极—导电性
C.稀有气体—霓虹灯——通电能发出不同颜色的光
D.氮气—食品防腐—常温下化学性质稳定
4、下列关于的实验室制取及检验的说法不正确的是( )
A.制的药品 B.发生装置 C.收集方法 D.检验
A.A B.B C.C D.D
5、下列实验现象的描述正确的是( )
A.木炭在空气中燃烧:黑色固体燃烧,发白光,放热
B.将二氧化碳通入澄清石灰水:液面下导管口处有气泡冒出,澄清石灰水变白色浑浊
C.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的二氧化硫气体
D.加热氧化汞粉末,银白色液体变为红色粉末
6、依据下列实验事实得出的结论,正确的是( )
选项 实验实施 结论
A 10g水结成冰质量依然是10g 遵循质量守恒定律
B 5mL水和5mL酒精混合后总体积小于10mL 分子的体积很小
C 往某水样中滴加肥皂水后振荡,产生大量泡沫 该水样属于硬水
D 澄清石灰水敞口放置,表面出现一层白膜 二氧化碳使石灰水变质
A.A B.B C.C D.D
7、现有空气、氧气和二氧化碳三瓶无色气体。能将它们鉴别开来的方法是( )
A.用燃着的木条分别插入三个集气瓶中 B.用带火星的木条分别插入三个集气瓶中
C.向三个集气瓶中分别滴加少量澄清石灰水 D.分别闻它们的气味
8、归纳与推理是学习化学的重要方法。下列归纳与推理正确的是( )
A.化合物是含有不同种元素的纯净物,含有不同种元素的纯净物一定是化合物
B.同种元素的粒子有相同的质子数,具有相同质子数的粒子一定属于同种元素
C.单质由同种元素组成,由同种元素组成的物质一定是单质
D.二氧化碳能使燃烧的木条熄灭,能使燃烧的木条熄灭的气体一定是二氧化碳
9、下列碳和碳的氧化物有关的说法中,正确的是( )
A.煤炉上放一盆水可防止CO中毒
B.CO2中混有少量CO,可将气体通过灼热的氧化铜的方法除去
C.CO2无毒,当空气中的CO2超过正常含量时,不会对人体健康产生影响
D.清明上河图至今图案清晰可见,说明碳不与任何物质反应
10、宏观、微观、符号相结合是化学学科特有的思维方式。下图为汽车尾气净化装置内发生反应的微观示意图。下列说法正确的是( )
A.参加反应的甲与丁的分子个数比为1:1
B.化学反应中甲与丁的质量比为2:1
C.该反应不符合质量守恒定律
D.该装置的应用能减少CO2对空气的污染
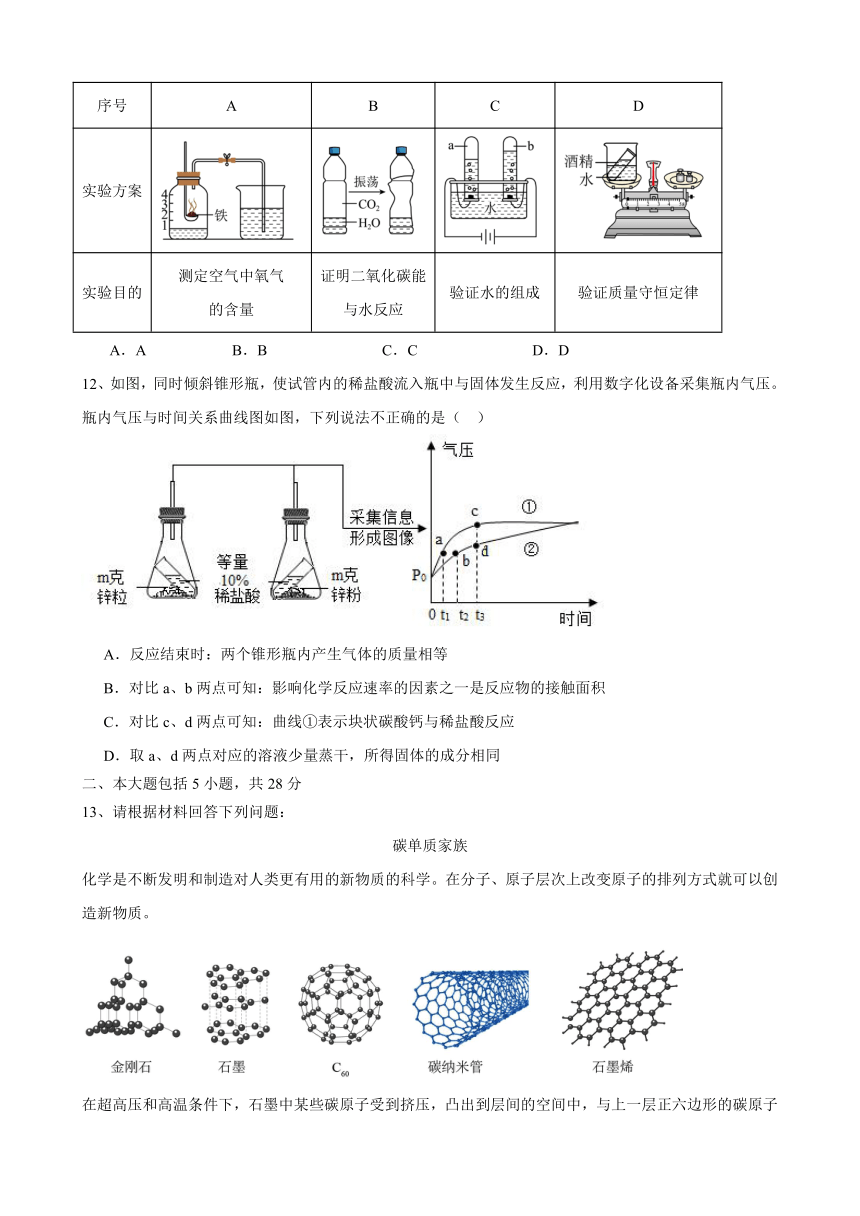
11、根据下列实验方案进行实验,能达到相应实验目的的是( )
序号 A B C D
实验方案
实验目的 测定空气中氧气 的含量 证明二氧化碳能 与水反应 验证水的组成 验证质量守恒定律
A.A B.B C.C D.D
12、如图,同时倾斜锥形瓶,使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压。瓶内气压与时间关系曲线图如图,下列说法不正确的是( )
A.反应结束时:两个锥形瓶内产生气体的质量相等
B.对比a、b两点可知:影响化学反应速率的因素之一是反应物的接触面积
C.对比c、d两点可知:曲线①表示块状碳酸钙与稀盐酸反应
D.取a、d两点对应的溶液少量蒸干,所得固体的成分相同
二、本大题包括5小题,共28分
13、请根据材料回答下列问题:
碳单质家族
化学是不断发明和制造对人类更有用的新物质的科学。在分子、原子层次上改变原子的排列方式就可以创造新物质。
在超高压和高温条件下,石墨中某些碳原子受到挤压,凸出到层间的空间中,与上一层正六边形的碳原子形成正四面体的排列方式,就得到金刚石。
分子是由12个正五边形和20个正六边形构成的完美对称的笼状分子。分子形似足球,被形象地称为“足球烯”。在常温下是紫红色晶体,具有金属光泽,可用于超导、催化等领域,使用中要远离火源。
碳纳米管的直径一般为几纳米到几十纳米,其中碳原子以正六边形排列形成管状结构。其管状结构决定了它的弹性和弯曲性优异,可制作金属催化载体,用于计算机芯片等前沿领域。
石墨烯中的碳原子是以正六边形紧密排列的单层结构。石墨烯具有比表面积大、透光率高、导电性强等优异性能,因而在透明电极、太阳能电池、传感器、手机屏幕等方面有良好的应用前景。
科学家在一定条件下可以选取石墨烯片段包裹成足球烯,也可以将片段卷起来得到碳纳米管。
请根据上述材料回答下列问题:
(1)在一定条件下,石墨可转变为金刚石。这一变化是 变化。
(2)写出的一种物理性质 。
(3)碳纳米管的弹性较好、易于弯曲,这些性质都源于它是 结构。
(4)石墨烯的优良性能决定它的用途是 (写出一条)。
(5)文中涉及的碳单质家族中各物质物理性质存在差异,可能的原因是 。
14、结合图示实验装置,回答下列问题。
(1)写出图中标号仪器的名称:① 。
(2)加热高锰酸钾制取并收集一瓶干燥的氧气,应选用的装置组合是 (填序号),该反应的化学方程式为 。反应刚开始,试管的口有小水珠出现,此现象是 (选填“物理”或“化学”)变化引起的。
(3)图G所示装置可用来测量生成的CO2的体积,其中在水面上放一层植物油的目的是 。
15、发展利用太阳能可以推进节能减排,晶体硅是制造太阳能电池板的重要原料,如图是工业上以石英砂为主要原料制取纯硅的一种方法,请回答以下问题。
(1)将石英砂粉碎的目的是 。
(2)流程①中发生反应的化学方程式为,该反应中属于氧化物的是 (填化学式,写一种即可)。
(3)写出流程②的化学方程式: 。流程②要在无氧气的环境中进行,原因是 。(答出一种即可)
(4)写出副产品的一种用途: 。
16、为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物进行系列实验。
【实验一】取质量比1:11的木炭粉和氧化铜混合物,进行实验。
序号 A实验 B实验
装置
反应后物质的颜色、状态 黑色粉末中混有少量红色固体 红色固体有金属光泽,混有极少量黑色物质
【解释与结论】
(1)A实验加网罩的作用是 。
(2)木炭还原氧化铜的化学方程式为 。
(3)做A实验和B实验对比的目的是 。
(4)B实验中说明有二氧化碳生成的现象是 。
(5)上述两个实验完毕后,如果先停止加热,可能引起的后果是 。
【实验二】取一定量的混合物,采用上述B实验装置进行实验。
序号 木炭粉与氧化铜的质量比 反应后物质的颜色、状态
1 1:9 红色固体有金属光泽 混有少量黑色物质
2 1:10 混有很少量黑色物质
3 1:11 混有极少量黑色物质
4 1:12 无黑色物质
5 1:13 混有较多黑色物质
【解释与结论】
(6)实验二探究的结论是 。
17、学习小组同学为测定某品牌钙片中含碳酸钙的质量分数,向盛有12g钙片的烧杯中加入过量稀盐酸,充分反应后,测得烧杯内混合物的总质量比反应前稀盐酸与钙片的总质量减少了4.4g。(钙片中其他成分不与稀盐酸反应放出气体)
(1)反应中生成二氧化碳的质量是 g。
(2)计算该品牌钙片中含碳酸钙的质量分数。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
D B A C B D A A B B
11 12
C C
二、本大题包括5小题,共28分
13、(1)化学; (2)常温下是紫红色晶体/具有金属光泽; (3)管状结构;
(4)用于透明电极(或太阳能电池、传感器、手机屏幕等); (5)碳原子的排列方式不同。
14、(1)酒精灯;(2) AD;2KMnO4K2MnO4+MnO2+O2↑ ;物理;
(3)防止二氧化碳溶于水导致测量的二氧化碳体积不准确。
15、(1)增大反应物的接触面积,使反应更快、更充分; (2) SiO2或CO;
(3) SiCl4+2H2Si+4HCl;防止发生爆炸; (4)冶炼金属或作燃料。
16、(1)集中火焰,提高温度; (2) 2CuO+C2Cu+CO2↑;
(3)探究哪种加热方法效果更好; (4)澄清石灰水变浑浊;
(5)液体倒流,炸裂试管; (6)木炭粉和氧化铜质量比为1:12时,效果最佳。
17、(1)4.4
(2)解:设该品牌钙片中含碳酸钙的质量分数为x
x=83.3%
答:该品牌钙片中含碳酸钙的质量分数为83.3%。
附相对原子质量:H-1;C-12;N-14;O-16;Ca-40;
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1、央视栏目《典籍里的中国》展现了中国智慧。用墨书写的典籍保存至今仍不变色,体现了碳单质具有的性质是( )
A.质软 B.导电性 C.可燃性 D.常温稳定性
2、“碳中和”是指通过一定方式抵消人类活动产生的二氧化碳等温室气体排放量,达到相对“零排放”。下列做法中,有利于实现“碳中和”的是( )
A.大力开发新能源,禁止使用化石燃料
B.倡导植树造林,促进自然界中二氧化碳的循环
C.提倡多建造以煤为燃料的火力发电厂
D.加高烟囱,将燃烧产生的气体排向高空
3、物质的性质决定其用途,用途反映物质的性质。下列关于“物质—用途一性质”的说法不正确的是( )
A.氧气—火箭发射—可燃性
B.石墨—电极—导电性
C.稀有气体—霓虹灯——通电能发出不同颜色的光
D.氮气—食品防腐—常温下化学性质稳定
4、下列关于的实验室制取及检验的说法不正确的是( )
A.制的药品 B.发生装置 C.收集方法 D.检验
A.A B.B C.C D.D
5、下列实验现象的描述正确的是( )
A.木炭在空气中燃烧:黑色固体燃烧,发白光,放热
B.将二氧化碳通入澄清石灰水:液面下导管口处有气泡冒出,澄清石灰水变白色浑浊
C.硫在氧气中燃烧:发出明亮的蓝紫色火焰,放热,生成有刺激性气味的二氧化硫气体
D.加热氧化汞粉末,银白色液体变为红色粉末
6、依据下列实验事实得出的结论,正确的是( )
选项 实验实施 结论
A 10g水结成冰质量依然是10g 遵循质量守恒定律
B 5mL水和5mL酒精混合后总体积小于10mL 分子的体积很小
C 往某水样中滴加肥皂水后振荡,产生大量泡沫 该水样属于硬水
D 澄清石灰水敞口放置,表面出现一层白膜 二氧化碳使石灰水变质
A.A B.B C.C D.D
7、现有空气、氧气和二氧化碳三瓶无色气体。能将它们鉴别开来的方法是( )
A.用燃着的木条分别插入三个集气瓶中 B.用带火星的木条分别插入三个集气瓶中
C.向三个集气瓶中分别滴加少量澄清石灰水 D.分别闻它们的气味
8、归纳与推理是学习化学的重要方法。下列归纳与推理正确的是( )
A.化合物是含有不同种元素的纯净物,含有不同种元素的纯净物一定是化合物
B.同种元素的粒子有相同的质子数,具有相同质子数的粒子一定属于同种元素
C.单质由同种元素组成,由同种元素组成的物质一定是单质
D.二氧化碳能使燃烧的木条熄灭,能使燃烧的木条熄灭的气体一定是二氧化碳
9、下列碳和碳的氧化物有关的说法中,正确的是( )
A.煤炉上放一盆水可防止CO中毒
B.CO2中混有少量CO,可将气体通过灼热的氧化铜的方法除去
C.CO2无毒,当空气中的CO2超过正常含量时,不会对人体健康产生影响
D.清明上河图至今图案清晰可见,说明碳不与任何物质反应
10、宏观、微观、符号相结合是化学学科特有的思维方式。下图为汽车尾气净化装置内发生反应的微观示意图。下列说法正确的是( )
A.参加反应的甲与丁的分子个数比为1:1
B.化学反应中甲与丁的质量比为2:1
C.该反应不符合质量守恒定律
D.该装置的应用能减少CO2对空气的污染
11、根据下列实验方案进行实验,能达到相应实验目的的是( )
序号 A B C D
实验方案
实验目的 测定空气中氧气 的含量 证明二氧化碳能 与水反应 验证水的组成 验证质量守恒定律
A.A B.B C.C D.D
12、如图,同时倾斜锥形瓶,使试管内的稀盐酸流入瓶中与固体发生反应,利用数字化设备采集瓶内气压。瓶内气压与时间关系曲线图如图,下列说法不正确的是( )
A.反应结束时:两个锥形瓶内产生气体的质量相等
B.对比a、b两点可知:影响化学反应速率的因素之一是反应物的接触面积
C.对比c、d两点可知:曲线①表示块状碳酸钙与稀盐酸反应
D.取a、d两点对应的溶液少量蒸干,所得固体的成分相同
二、本大题包括5小题,共28分
13、请根据材料回答下列问题:
碳单质家族
化学是不断发明和制造对人类更有用的新物质的科学。在分子、原子层次上改变原子的排列方式就可以创造新物质。
在超高压和高温条件下,石墨中某些碳原子受到挤压,凸出到层间的空间中,与上一层正六边形的碳原子形成正四面体的排列方式,就得到金刚石。
分子是由12个正五边形和20个正六边形构成的完美对称的笼状分子。分子形似足球,被形象地称为“足球烯”。在常温下是紫红色晶体,具有金属光泽,可用于超导、催化等领域,使用中要远离火源。
碳纳米管的直径一般为几纳米到几十纳米,其中碳原子以正六边形排列形成管状结构。其管状结构决定了它的弹性和弯曲性优异,可制作金属催化载体,用于计算机芯片等前沿领域。
石墨烯中的碳原子是以正六边形紧密排列的单层结构。石墨烯具有比表面积大、透光率高、导电性强等优异性能,因而在透明电极、太阳能电池、传感器、手机屏幕等方面有良好的应用前景。
科学家在一定条件下可以选取石墨烯片段包裹成足球烯,也可以将片段卷起来得到碳纳米管。
请根据上述材料回答下列问题:
(1)在一定条件下,石墨可转变为金刚石。这一变化是 变化。
(2)写出的一种物理性质 。
(3)碳纳米管的弹性较好、易于弯曲,这些性质都源于它是 结构。
(4)石墨烯的优良性能决定它的用途是 (写出一条)。
(5)文中涉及的碳单质家族中各物质物理性质存在差异,可能的原因是 。
14、结合图示实验装置,回答下列问题。
(1)写出图中标号仪器的名称:① 。
(2)加热高锰酸钾制取并收集一瓶干燥的氧气,应选用的装置组合是 (填序号),该反应的化学方程式为 。反应刚开始,试管的口有小水珠出现,此现象是 (选填“物理”或“化学”)变化引起的。
(3)图G所示装置可用来测量生成的CO2的体积,其中在水面上放一层植物油的目的是 。
15、发展利用太阳能可以推进节能减排,晶体硅是制造太阳能电池板的重要原料,如图是工业上以石英砂为主要原料制取纯硅的一种方法,请回答以下问题。
(1)将石英砂粉碎的目的是 。
(2)流程①中发生反应的化学方程式为,该反应中属于氧化物的是 (填化学式,写一种即可)。
(3)写出流程②的化学方程式: 。流程②要在无氧气的环境中进行,原因是 。(答出一种即可)
(4)写出副产品的一种用途: 。
16、为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物进行系列实验。
【实验一】取质量比1:11的木炭粉和氧化铜混合物,进行实验。
序号 A实验 B实验
装置
反应后物质的颜色、状态 黑色粉末中混有少量红色固体 红色固体有金属光泽,混有极少量黑色物质
【解释与结论】
(1)A实验加网罩的作用是 。
(2)木炭还原氧化铜的化学方程式为 。
(3)做A实验和B实验对比的目的是 。
(4)B实验中说明有二氧化碳生成的现象是 。
(5)上述两个实验完毕后,如果先停止加热,可能引起的后果是 。
【实验二】取一定量的混合物,采用上述B实验装置进行实验。
序号 木炭粉与氧化铜的质量比 反应后物质的颜色、状态
1 1:9 红色固体有金属光泽 混有少量黑色物质
2 1:10 混有很少量黑色物质
3 1:11 混有极少量黑色物质
4 1:12 无黑色物质
5 1:13 混有较多黑色物质
【解释与结论】
(6)实验二探究的结论是 。
17、学习小组同学为测定某品牌钙片中含碳酸钙的质量分数,向盛有12g钙片的烧杯中加入过量稀盐酸,充分反应后,测得烧杯内混合物的总质量比反应前稀盐酸与钙片的总质量减少了4.4g。(钙片中其他成分不与稀盐酸反应放出气体)
(1)反应中生成二氧化碳的质量是 g。
(2)计算该品牌钙片中含碳酸钙的质量分数。
参考答案
一、本大题包括12小题,每小题1分,共12分。每小题的4个备选答案中只有一个答案符合题意。
1 2 3 4 5 6 7 8 9 10
D B A C B D A A B B
11 12
C C
二、本大题包括5小题,共28分
13、(1)化学; (2)常温下是紫红色晶体/具有金属光泽; (3)管状结构;
(4)用于透明电极(或太阳能电池、传感器、手机屏幕等); (5)碳原子的排列方式不同。
14、(1)酒精灯;(2) AD;2KMnO4K2MnO4+MnO2+O2↑ ;物理;
(3)防止二氧化碳溶于水导致测量的二氧化碳体积不准确。
15、(1)增大反应物的接触面积,使反应更快、更充分; (2) SiO2或CO;
(3) SiCl4+2H2Si+4HCl;防止发生爆炸; (4)冶炼金属或作燃料。
16、(1)集中火焰,提高温度; (2) 2CuO+C2Cu+CO2↑;
(3)探究哪种加热方法效果更好; (4)澄清石灰水变浑浊;
(5)液体倒流,炸裂试管; (6)木炭粉和氧化铜质量比为1:12时,效果最佳。
17、(1)4.4
(2)解:设该品牌钙片中含碳酸钙的质量分数为x
x=83.3%
答:该品牌钙片中含碳酸钙的质量分数为83.3%。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
