3.1.3.铁及化合物的转化 课件(共25张PPT) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.1.3.铁及化合物的转化 课件(共25张PPT) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-04 22:37:52 | ||
图片预览






文档简介
(共25张PPT)
化学必修一
第三章 物质的性质与转化
第1节铁的多样性
第3课时铁及其化合物的转化
核心素养发展目标
1、宏观辨识与微观探析:基于元素的价态和物质的所属类别,完整有序地写出含有铁元素的物质的化学式。
2、科学探究与创新意识:根据生产、生活中的应用实例或通过实验探究,掌握亚铁盐和铁盐的物理性质、化学性质、典型实验现象,能书写主要的化学方程式和离子方程式。
3、证据推理与模型认知:知道含有铁元素的物质在生产、生活中的应用,知道Fe3+的检验方法,能独立或与同学合作完成实验,记录实验现象和数据,完成实验报告,并能主动进行交流。
学业目标
1.认识铁元素在物质中可以具有不同价态,可通过氧化还原反应实现含
有不同价态铁元素的物质的相互转化。
2.认识一定条件下铁及其化合物之间可以相互转化。能从物质类别和元
素价态变化的视角说明物质的转化路径。
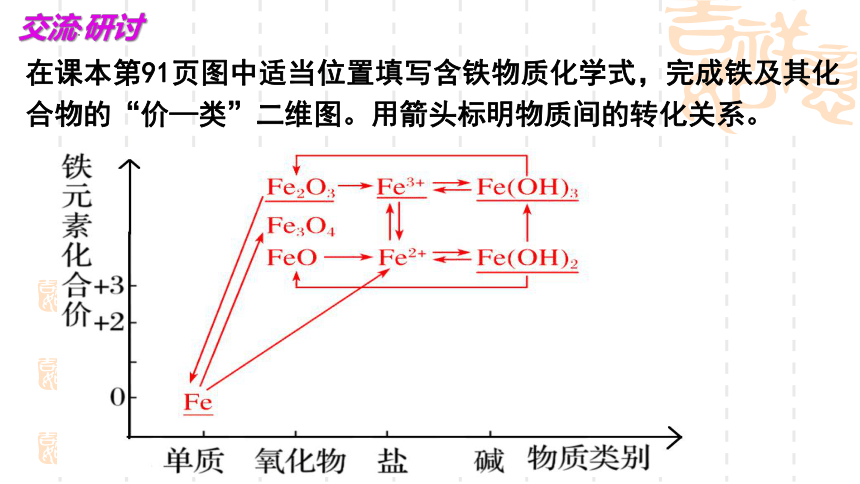
在课本第91页图中适当位置填写含铁物质化学式,完成铁及其化合物的“价—类”二维图。用箭头标明物质间的转化关系。
交流·研讨
⑤Fe(OH)3→Fe2O3
FeO+2H+=Fe2++H2O
Fe2++2OH-=Fe(OH)2↓
Fe2O3+6H+=2Fe3++3H2O
多数是复分解反应
络合反应:
Fe3++3SCN-=Fe(SCN)3
1、同价态转化
Fe(OH)3+3H+=Fe3++3H2O
①FeO→Fe2+
③Fe2O3→Fe3+
②Fe2+ Fe(OH)2
Fe(OH)2+2H+=Fe2++2H2O
④Fe3+ Fe(OH)3
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3 Fe2O3+3H2O
一、铁及其化合物的转化
①
②
③
④
⑤
2、不同价态转化
氧化还原反应
①Fe→Fe2+:
Fe→Fe3O4:
④Fe(OH)2→Fe(OH)3:
Fe+2H+=Fe2++H2↑
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe3++Fe=3Fe2+
Fe→FeCl3:
②Fe2O3→Fe:
2Fe2++Cl2=2Fe3++2Cl-
③Fe2+ Fe3+:
Fe2O3+3CO 2Fe+3CO2
2Fe+3Cl2 2FeCl3
3Fe+2O2 Fe3O4
①
②
③
④
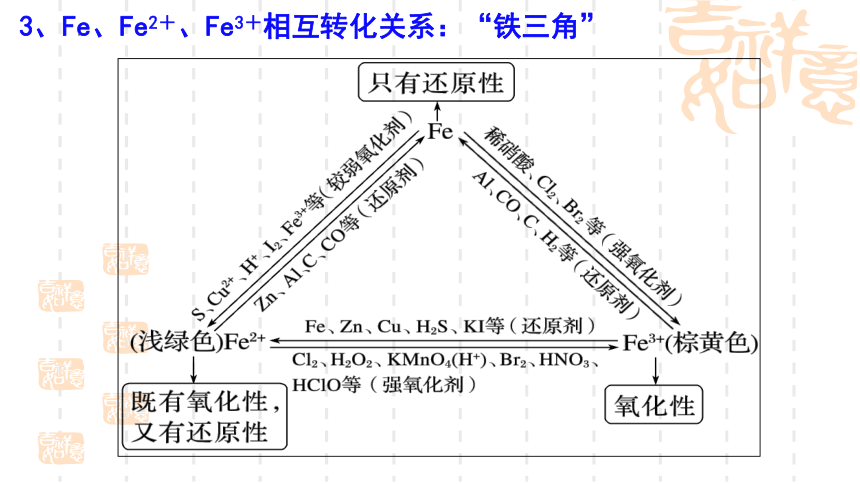
3、Fe、Fe2+、Fe3+相互转化关系:“铁三角”
写出下列转化相关的离子(或化学)方程式
①Fe→Fe2+,加弱氧化剂
如Fe和I2:_________________,
Fe和CuSO4溶液:_______________________。
②Fe→Fe3+,加强氧化剂
如Fe和稀硝酸:Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O,
Fe和Cl2:______________________ 。
Fe+Cu2+=Fe2++Cu
⑴常见的转化反应
③Fe2+→Fe3+,加强氧化剂
如FeCl2溶液和Cl2:_________________________,
Fe(OH)2被O2氧化:________________________________。
④Fe3+→Fe2+,加还原剂
如FeCl3溶液和Cu:__________________________,
FeCl3和KI溶液:_______________________。
2Fe2++Cl2=2Fe3++2Cl-
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I-=I2+2Fe2+
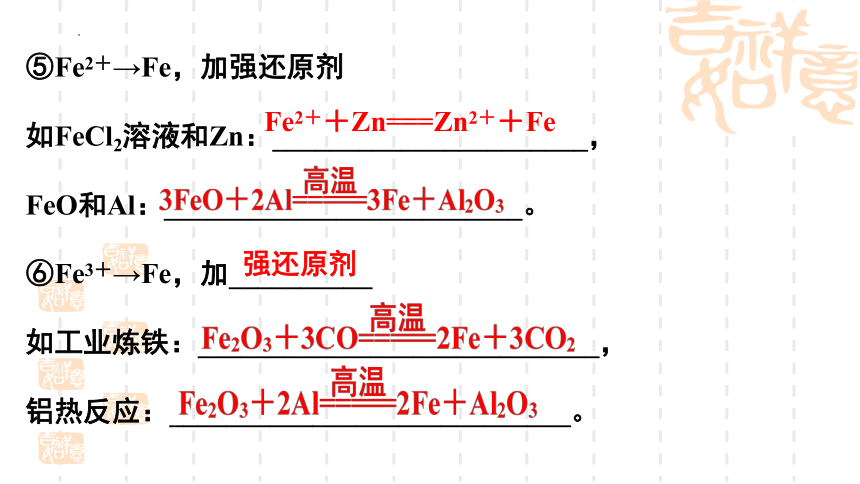
⑤Fe2+→Fe,加强还原剂
如FeCl2溶液和Zn:______________________,
FeO和Al:_________________________。
⑥Fe3+→Fe,加__________
如工业炼铁:____________________________,
铝热反应:____________________________。
Fe2++Zn===Zn2++Fe
强还原剂
(1)分离或除杂(括号内物质为杂质)
①FeCl3溶液(FeCl2):
加足量氯水或双氧水或通入足量Cl2,FeCl2溶液(酸性)和H2O2反应的离子方程式:______________________。
②FeCl2溶液(FeCl3):
加足量铁粉,充分反应后过滤,离子方程式:________________。
③FeSO4溶液(CuSO4):
加足量铁粉,充分反应后过滤,离子方程式:_______________。
4.“铁三角”转化的应用
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe3++Fe=3Fe2+
Cu2++Fe=Fe2++Cu
(2)与Fe3+、Fe2+有关的离子共存问题①Fe3+与I-、S2-、HS-、SO32-、HSO3-等因发生氧化还原反应而不能大量共存。②Fe2+与MnO4-(H+)、NO3-(H+)、ClO-等因发生氧化还原反应而不能大量共存。
(4)实验室或工业制备含铁物质
如制备Fe(OH)2时应注意隔绝空气防氧化;生产中用“铝热剂”焊接钢轨等。
(3)盐溶液的配制与保存
配制或保存含Fe2+的溶液时,常加入少量铁粉防止其氧化。
1.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
随堂训练
FeCl3
FeCl2
Fe
Fe(OH)2
Fe(OH)3
C
2、已知以下几种物质之间相互转化,其中A是中学化学中常见的金属单质:
试回答:
(1)写出下列物质的化学式:
A______;B________。
(2)写出由B转变成G的化学方程式:______________________。
(3)写出用KSCN鉴别G溶液的现象:_____________。向G溶液中加入A反应的离子方程式为__________________。
(4)将金属A浸入G的溶液中,当转移0.1 mol电子时,金属A减少的质量为___ g。
Fe
FeCl2
2FeCl2+Cl2=2FeCl3
溶液变红色
2Fe3++Fe=3Fe2+
2.8
2FeCl3+Fe=3FeCl2
Fe
Fe(OH)2
Fe(OH)3
FeCl3
FeCl2
NaOH
NaCl
AgCl
NaNO3
3.用铁泥(主要成分为Fe2O3、FeO和Fe)制备纳米Fe3O4(平均直径25 nm)的流程示意图如下:
下列叙述错误的是
A.步骤①中,生产车间要禁止烟火
B.步骤②中,主要反应的离子方程式是 Fe3++Fe=2Fe2+
C.步骤④中H2O2应该过量
D.步骤⑤中,为验证得到的固体是纳米态Fe3O4粒子,可将其形成分散系,做丁达尔效应实验
BC
铁与盐酸会反应放出氢气
2Fe3++Fe=3Fe2+
过量的H2O2在步骤⑤中会继续氧化+2价的铁元素
二、补铁剂中铁元素价态的检验
铁元素是人体中含量最高的生命必需微量元素,人体中起着重要的作用。如果人体缺铁,就会出现贫血症状。轻度缺铁性贫血可以用饮食疗法治疗,严重缺铁时则需要服用补铁剂,血红蛋白中含有+2价铁离子,具有载氧功能。补铁口服液是常见的补铁剂,其中除了含有铁元素的物质外,还常添加抗氧化物质(如维生素C)、甜味剂、香精等。例如,某补铁口服液100mL中含铁元素20 30mg、维生素C200 300mg。
1.铁元素与人体健康
补铁剂中铁元素价态有以下3种可能
①可能为 ;
②可能为 ;
③可能 ;
2.实验探究:补血剂中铁元素价态检验
实验目的:检验某补铁口服液中铁元素的价态。
实验用品:某补铁口服液,H2SO4,NaOH溶液,酸性 KmnO4 溶液,氯水,KSCN 溶液; 试管,胶头滴管。
实验方案的设计及实施:
(1)预测补铁剂中铁元素价态
+2价(Fe2+)
+3价(Fe3+)
既有+2价,又有+3价(Fe2+和Fe3+)
⑵设计实验方案
(3)实验操作、现象及结论
方案一:
实验操作 实验现象 实验结论
加入硫氰酸钾溶液,溶液颜色无变化;加入氯水后,溶液变为_____ 含有Fe2+,不含____
红色
Fe3+
方案二:
实验操作 实验现象 实验结论
溶液颜色无变化 ___________
紫红色褪去 含Fe2+
不含Fe3+
(4)实验结论分析
经过实验验证,补铁剂中铁元素价态为+2价,请写出相关反应的离子方程式: , 。
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
(1)血红蛋白分子中的铁元素价态为+2价( )
(2)食用富含维生素C的食物利于人体对铁元素吸收,是利用维生素C的氧化性( )
(3)向补铁口服液中滴加KSCN溶液,溶液变为红色,则补血口服液中铁的价态只有+3价( )
(4)可用NaOH溶液直接验证补铁口服液中铁元素的价态( )
(5)为防止补铁口服液中的Fe2+被氧化为Fe3+,在饮用前,可向口服液中加入铁粉( )
4、判断正误:
√
×
×
×
随堂训练
×
5、简答题:
⑴为什么补铁剂与维生素C一起服用效果更好?
补铁剂中铁元素的化合价是+2价,具有还原性,因维生素C的还原性比Fe2+强,因此补铁剂与维生素C一起服用,可以防止补铁剂中的Fe2+被氧化。
⑵在验证补铁口服液中是否含有Fe2+的实验中,向溶液中加入酸性KMnO4溶液,紫红色褪色,则一定证明含有Fe2+吗?
不一定,因为补铁口服液中的抗氧化剂(维生素C)有还原性,也可以使酸性KMnO4溶液褪色。
⑶可否用NaOH溶液检验补铁剂中铁元素的价态?为什么?
不能。若补铁剂中含有Fe3+,加入NaOH溶液立即产生红褐色沉淀,则无法检验Fe2+的存在。
(1)补铁剂的有效成分是亚铁盐(如FeSO4),Fe2+易被氧化为Fe3+而失去补铁作用,因此需密封、隔绝O2存放。服用补铁剂时搭配维生素C可以增强补铁效果,这是因为维生素C可将Fe3+还原为Fe2+。
知识总结
(2)服用补铁剂时不能和茶水同饮,因为茶水中含大量的鞣酸,鞣酸与Fe2+反应生成鞣酸亚铁,它的性质不稳定,很快被氧化成鞣酸铁而呈蓝黑色。
6.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁中含有Cu2+
C.苹果汁中含有OH-
D.苹果汁中含有Fe3+
A
随堂训练
7.下列说法不正确的是
A.为防止FeSO4溶液变质,可在溶液中加少量铁粉
B.FeO不稳定,在空气中受热时能迅速被氧化为Fe3O4
C.除去FeCl3溶液中少量FeCl2,可加H2O2溶液或通氯气
D.欲检验某还原铁粉是否变质,可取少量样品溶于盐酸并加入KSCN溶液
D
8.(双选)下列说法正确的是
A.Fe在一定条件下与水反应生成H2和Fe3O4
B.Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液不会显红色
C.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
D.Fe3+具有氧化性,据此可用KSCN溶液鉴别Fe3+
AC
9.下列有关铁及其化合物的说法正确的是
A.可以采用加热的方法除去Fe2O3中的Fe(OH)3
B.铁只有与水蒸气反应才能得到Fe3O4
C.不能通过化合反应生成FeCl2和Fe(OH)3
D.氯化铁溶液有较强的氧化性,故可用作净水剂
A
化学必修一
第三章 物质的性质与转化
第1节铁的多样性
第3课时铁及其化合物的转化
核心素养发展目标
1、宏观辨识与微观探析:基于元素的价态和物质的所属类别,完整有序地写出含有铁元素的物质的化学式。
2、科学探究与创新意识:根据生产、生活中的应用实例或通过实验探究,掌握亚铁盐和铁盐的物理性质、化学性质、典型实验现象,能书写主要的化学方程式和离子方程式。
3、证据推理与模型认知:知道含有铁元素的物质在生产、生活中的应用,知道Fe3+的检验方法,能独立或与同学合作完成实验,记录实验现象和数据,完成实验报告,并能主动进行交流。
学业目标
1.认识铁元素在物质中可以具有不同价态,可通过氧化还原反应实现含
有不同价态铁元素的物质的相互转化。
2.认识一定条件下铁及其化合物之间可以相互转化。能从物质类别和元
素价态变化的视角说明物质的转化路径。
在课本第91页图中适当位置填写含铁物质化学式,完成铁及其化合物的“价—类”二维图。用箭头标明物质间的转化关系。
交流·研讨
⑤Fe(OH)3→Fe2O3
FeO+2H+=Fe2++H2O
Fe2++2OH-=Fe(OH)2↓
Fe2O3+6H+=2Fe3++3H2O
多数是复分解反应
络合反应:
Fe3++3SCN-=Fe(SCN)3
1、同价态转化
Fe(OH)3+3H+=Fe3++3H2O
①FeO→Fe2+
③Fe2O3→Fe3+
②Fe2+ Fe(OH)2
Fe(OH)2+2H+=Fe2++2H2O
④Fe3+ Fe(OH)3
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3 Fe2O3+3H2O
一、铁及其化合物的转化
①
②
③
④
⑤
2、不同价态转化
氧化还原反应
①Fe→Fe2+:
Fe→Fe3O4:
④Fe(OH)2→Fe(OH)3:
Fe+2H+=Fe2++H2↑
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe3++Fe=3Fe2+
Fe→FeCl3:
②Fe2O3→Fe:
2Fe2++Cl2=2Fe3++2Cl-
③Fe2+ Fe3+:
Fe2O3+3CO 2Fe+3CO2
2Fe+3Cl2 2FeCl3
3Fe+2O2 Fe3O4
①
②
③
④
3、Fe、Fe2+、Fe3+相互转化关系:“铁三角”
写出下列转化相关的离子(或化学)方程式
①Fe→Fe2+,加弱氧化剂
如Fe和I2:_________________,
Fe和CuSO4溶液:_______________________。
②Fe→Fe3+,加强氧化剂
如Fe和稀硝酸:Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O,
Fe和Cl2:______________________ 。
Fe+Cu2+=Fe2++Cu
⑴常见的转化反应
③Fe2+→Fe3+,加强氧化剂
如FeCl2溶液和Cl2:_________________________,
Fe(OH)2被O2氧化:________________________________。
④Fe3+→Fe2+,加还原剂
如FeCl3溶液和Cu:__________________________,
FeCl3和KI溶液:_______________________。
2Fe2++Cl2=2Fe3++2Cl-
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I-=I2+2Fe2+
⑤Fe2+→Fe,加强还原剂
如FeCl2溶液和Zn:______________________,
FeO和Al:_________________________。
⑥Fe3+→Fe,加__________
如工业炼铁:____________________________,
铝热反应:____________________________。
Fe2++Zn===Zn2++Fe
强还原剂
(1)分离或除杂(括号内物质为杂质)
①FeCl3溶液(FeCl2):
加足量氯水或双氧水或通入足量Cl2,FeCl2溶液(酸性)和H2O2反应的离子方程式:______________________。
②FeCl2溶液(FeCl3):
加足量铁粉,充分反应后过滤,离子方程式:________________。
③FeSO4溶液(CuSO4):
加足量铁粉,充分反应后过滤,离子方程式:_______________。
4.“铁三角”转化的应用
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe3++Fe=3Fe2+
Cu2++Fe=Fe2++Cu
(2)与Fe3+、Fe2+有关的离子共存问题①Fe3+与I-、S2-、HS-、SO32-、HSO3-等因发生氧化还原反应而不能大量共存。②Fe2+与MnO4-(H+)、NO3-(H+)、ClO-等因发生氧化还原反应而不能大量共存。
(4)实验室或工业制备含铁物质
如制备Fe(OH)2时应注意隔绝空气防氧化;生产中用“铝热剂”焊接钢轨等。
(3)盐溶液的配制与保存
配制或保存含Fe2+的溶液时,常加入少量铁粉防止其氧化。
1.部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
随堂训练
FeCl3
FeCl2
Fe
Fe(OH)2
Fe(OH)3
C
2、已知以下几种物质之间相互转化,其中A是中学化学中常见的金属单质:
试回答:
(1)写出下列物质的化学式:
A______;B________。
(2)写出由B转变成G的化学方程式:______________________。
(3)写出用KSCN鉴别G溶液的现象:_____________。向G溶液中加入A反应的离子方程式为__________________。
(4)将金属A浸入G的溶液中,当转移0.1 mol电子时,金属A减少的质量为___ g。
Fe
FeCl2
2FeCl2+Cl2=2FeCl3
溶液变红色
2Fe3++Fe=3Fe2+
2.8
2FeCl3+Fe=3FeCl2
Fe
Fe(OH)2
Fe(OH)3
FeCl3
FeCl2
NaOH
NaCl
AgCl
NaNO3
3.用铁泥(主要成分为Fe2O3、FeO和Fe)制备纳米Fe3O4(平均直径25 nm)的流程示意图如下:
下列叙述错误的是
A.步骤①中,生产车间要禁止烟火
B.步骤②中,主要反应的离子方程式是 Fe3++Fe=2Fe2+
C.步骤④中H2O2应该过量
D.步骤⑤中,为验证得到的固体是纳米态Fe3O4粒子,可将其形成分散系,做丁达尔效应实验
BC
铁与盐酸会反应放出氢气
2Fe3++Fe=3Fe2+
过量的H2O2在步骤⑤中会继续氧化+2价的铁元素
二、补铁剂中铁元素价态的检验
铁元素是人体中含量最高的生命必需微量元素,人体中起着重要的作用。如果人体缺铁,就会出现贫血症状。轻度缺铁性贫血可以用饮食疗法治疗,严重缺铁时则需要服用补铁剂,血红蛋白中含有+2价铁离子,具有载氧功能。补铁口服液是常见的补铁剂,其中除了含有铁元素的物质外,还常添加抗氧化物质(如维生素C)、甜味剂、香精等。例如,某补铁口服液100mL中含铁元素20 30mg、维生素C200 300mg。
1.铁元素与人体健康
补铁剂中铁元素价态有以下3种可能
①可能为 ;
②可能为 ;
③可能 ;
2.实验探究:补血剂中铁元素价态检验
实验目的:检验某补铁口服液中铁元素的价态。
实验用品:某补铁口服液,H2SO4,NaOH溶液,酸性 KmnO4 溶液,氯水,KSCN 溶液; 试管,胶头滴管。
实验方案的设计及实施:
(1)预测补铁剂中铁元素价态
+2价(Fe2+)
+3价(Fe3+)
既有+2价,又有+3价(Fe2+和Fe3+)
⑵设计实验方案
(3)实验操作、现象及结论
方案一:
实验操作 实验现象 实验结论
加入硫氰酸钾溶液,溶液颜色无变化;加入氯水后,溶液变为_____ 含有Fe2+,不含____
红色
Fe3+
方案二:
实验操作 实验现象 实验结论
溶液颜色无变化 ___________
紫红色褪去 含Fe2+
不含Fe3+
(4)实验结论分析
经过实验验证,补铁剂中铁元素价态为+2价,请写出相关反应的离子方程式: , 。
2Fe2++Cl2=2Fe3++2Cl-
Fe3++3SCN-=Fe(SCN)3
(1)血红蛋白分子中的铁元素价态为+2价( )
(2)食用富含维生素C的食物利于人体对铁元素吸收,是利用维生素C的氧化性( )
(3)向补铁口服液中滴加KSCN溶液,溶液变为红色,则补血口服液中铁的价态只有+3价( )
(4)可用NaOH溶液直接验证补铁口服液中铁元素的价态( )
(5)为防止补铁口服液中的Fe2+被氧化为Fe3+,在饮用前,可向口服液中加入铁粉( )
4、判断正误:
√
×
×
×
随堂训练
×
5、简答题:
⑴为什么补铁剂与维生素C一起服用效果更好?
补铁剂中铁元素的化合价是+2价,具有还原性,因维生素C的还原性比Fe2+强,因此补铁剂与维生素C一起服用,可以防止补铁剂中的Fe2+被氧化。
⑵在验证补铁口服液中是否含有Fe2+的实验中,向溶液中加入酸性KMnO4溶液,紫红色褪色,则一定证明含有Fe2+吗?
不一定,因为补铁口服液中的抗氧化剂(维生素C)有还原性,也可以使酸性KMnO4溶液褪色。
⑶可否用NaOH溶液检验补铁剂中铁元素的价态?为什么?
不能。若补铁剂中含有Fe3+,加入NaOH溶液立即产生红褐色沉淀,则无法检验Fe2+的存在。
(1)补铁剂的有效成分是亚铁盐(如FeSO4),Fe2+易被氧化为Fe3+而失去补铁作用,因此需密封、隔绝O2存放。服用补铁剂时搭配维生素C可以增强补铁效果,这是因为维生素C可将Fe3+还原为Fe2+。
知识总结
(2)服用补铁剂时不能和茶水同饮,因为茶水中含大量的鞣酸,鞣酸与Fe2+反应生成鞣酸亚铁,它的性质不稳定,很快被氧化成鞣酸铁而呈蓝黑色。
6.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁中含有Cu2+
C.苹果汁中含有OH-
D.苹果汁中含有Fe3+
A
随堂训练
7.下列说法不正确的是
A.为防止FeSO4溶液变质,可在溶液中加少量铁粉
B.FeO不稳定,在空气中受热时能迅速被氧化为Fe3O4
C.除去FeCl3溶液中少量FeCl2,可加H2O2溶液或通氯气
D.欲检验某还原铁粉是否变质,可取少量样品溶于盐酸并加入KSCN溶液
D
8.(双选)下列说法正确的是
A.Fe在一定条件下与水反应生成H2和Fe3O4
B.Fe3O4溶于盐酸后加入几滴KSCN溶液,溶液不会显红色
C.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
D.Fe3+具有氧化性,据此可用KSCN溶液鉴别Fe3+
AC
9.下列有关铁及其化合物的说法正确的是
A.可以采用加热的方法除去Fe2O3中的Fe(OH)3
B.铁只有与水蒸气反应才能得到Fe3O4
C.不能通过化合反应生成FeCl2和Fe(OH)3
D.氯化铁溶液有较强的氧化性,故可用作净水剂
A
