3.1.2.铁、铁的氧化物和铁的氢氧化物 课件 (共18张PPT)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.1.2.铁、铁的氧化物和铁的氢氧化物 课件 (共18张PPT)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-04 22:38:19 | ||
图片预览





文档简介
(共18张PPT)
化学必修一
第三章 物质的性质与转化
第1节铁的多样性
第2课时铁、铁的氧化物和铁的氢氧化物
核心素养发展目标
1、宏观辨识与微观探析:基于元素的价态和物质的所属类别,完整有序地写出含有铁元素的物质的化学式。
2、科学探究与创新意识:根据生产、生活中的应用实例或通过实验探究,掌握亚铁盐和铁盐的物理性质、化学性质、典型实验现象,能书写主要的化学方程式和离子方程式。
3、证据推理与模型认知:知道含有铁元素的物质在生产、生活中的应用,知道Fe3+的检验方法,能独立或与同学合作完成实验,记录实验现象和数据,完成实验报告,并能主动进行交流。
学业目标
1、掌握铁单质、铁的氧化物、铁的氢氧化物的性质,能利用物质的性质和反应,设计Fe(OH)2的制备方案,培养科学探究与创新意识能力。
2.能从物质类别和价态两个视角研究物质,认识含铁物质在生产和生活中的应用,建立含铁物质性质和应用间的关系。
一、铁的单质
纯净的铁是光亮的银白色金属固体,密度较大(7.86 g·cm-3),熔点较高(1538 ℃),纯铁的抗腐蚀能力很强,具有良好的延展性、导热性、导电性,导电性比铜铝差,能被磁铁吸引。
1.物理性质
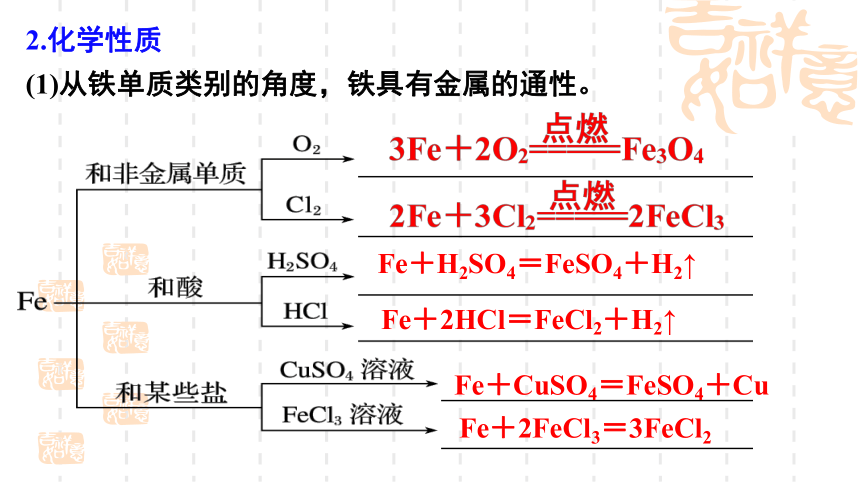
(1)从铁单质类别的角度,铁具有金属的通性。
2.化学性质
Fe+H2SO4=FeSO4+H2↑
Fe+2HCl=FeCl2+H2↑
Fe+CuSO4=FeSO4+Cu
Fe+2FeCl3=3FeCl2
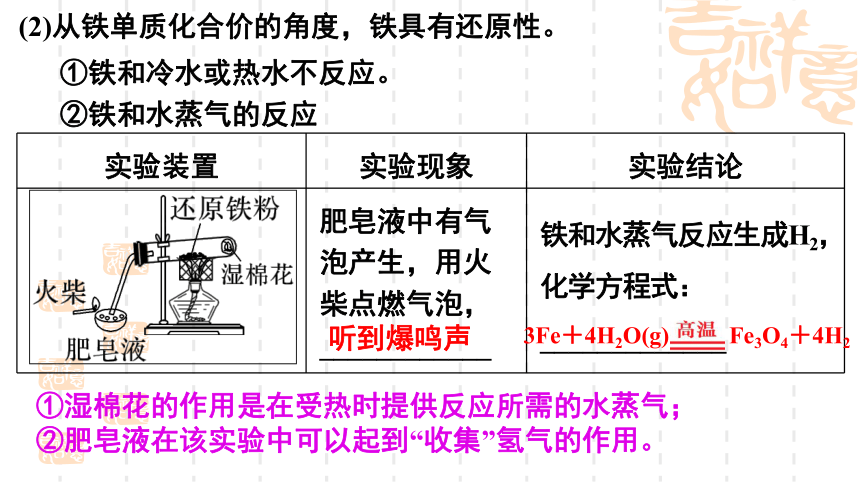
(2)从铁单质化合价的角度,铁具有还原性。
①铁和冷水或热水不反应。
②铁和水蒸气的反应
实验装置 实验现象 实验结论
肥皂液中有气泡产生,用火柴点燃气泡,____________ 铁和水蒸气反应生成H2,化学方程式:_____________
听到爆鸣声
3Fe+4H2O(g) Fe3O4+4H2
①湿棉花的作用是在受热时提供反应所需的水蒸气;
②肥皂液在该实验中可以起到“收集”氢气的作用。
1.如何检验铁和水蒸气反应的固态产物中铁元素的价态?
取少量固体于试管中,加入稀硫酸(不能用盐酸)溶解,将溶液分成两份,一份加入酸性高锰酸钾溶液,溶液褪色,说明溶液中含有Fe2+;另一份加入 KSCN 溶液,溶液显红色,说明溶液中含有Fe3+。
MnO4-+5Fe2++8H+ == Mn2++5Fe3++ 4H2O
Fe3O4+8H+===Fe2++2Fe3++4H2O
2[Fe(CN)6]3-+3Fe2+===Fe3[Fe(CN)6]2↓
K3[Fe(CN)6] 六氰和铁酸钾,可用来检验亚铁离子,现象是生成蓝色沉淀。
随堂训练
2.有下列物质:
①O2 ②AgNO3溶液 ③CuCl2溶液 ④稀硫酸 ⑤FeCl3溶液 ⑥Cl2 ⑦水蒸气(高温)
与Fe反应时只生成+2价铁的化合物的是__________(填序号,下同),只生成+3价铁的化合物的是____,既生成+2价又生成+3价铁的化合物的是______。
②③④⑤
⑥
①⑦
二、铁的氧化物
1.铁的氧化物的物理性质及用途
名称 氧化亚铁 氧化铁 四氧化三铁
化学式
俗名
铁元素的化合价
颜色、状态
溶解性
用途
FeO
Fe2O3
Fe3O4
+2
+3
+2、+3
红棕色粉末
黑色固体
铁红
磁性氧化铁
黑色粉末
都不溶于水
用作色素
用作油漆、涂料、油墨的红色颜料
磁性材料
写出下列氧化物和稀盐酸反应的离子方程式:
①FeO:_________________________。
②Fe2O3:___________________________。
③Fe3O4:___________________________。
FeO+2H+=Fe2++H2O
Fe2O3+6H+=2Fe3++3H2O
2.铁的氧化物的化学性质
⑴从物质类别的角度,铁的氧化物都能和酸反应生成相应的盐和水
Fe3O4+8H+=Fe2++2Fe3++4H2O
Fe3O4是一种复杂的化合物,可以看做氧化亚铁和氧化铁形成的化合物:FeO Fe2O3
(2)从化合价的角度,铁的氧化物都具有 ,其中FeO中Fe元素价态为+2价,化合价还可以升高,具有 。
①FeO不稳定,在空气中受热被氧化生成 ,FeO在反应中表现_________。
②铁的氧化物与铝粉在高温下可发生反应,写出Fe2O3和Al发生反应的化学方程式:___________________________,反应放出 ,常用于___________、制备金属纳米复合材料等,Fe2O3在反应中表现 。
还原性
氧化性
Fe3O4
还原性
大量热
焊接钢轨
氧化性
随堂训练
3、野外焊接铁轨常利用铝粉和氧化铁反应进行,该反应称为“铝热反应”。
操作步骤为:①将铝粉和氧化铁充分混合;②撒上氯酸钾,插入镁条;③点燃镁条。现场与原理如图:
(1)氯酸钾和镁条分别起什么作用?
镁条燃烧放热达到反应所需要的高温条件,氯酸钾受热分解产生氧气,促进燃烧。
(2)将氧化铁换成氧化亚铁或四氧化三铁能否反应?若能,请写出和四氧化三铁反应的化学方程式,并标出电子转移。
能
反应的化学方程式及电子转移:
(3)若将氧化铁换成氧化镁能否反应呢?若不能,说明原因。
否。因为金属的活泼性:Mg>Al,故Al不能和MgO发生铝热反应置换出金属Mg。
4、FeO中Fe元素价态为+2价,有升高的趋势,如和稀硝酸反应,+2价Fe元素被氧化成+3价,若硝酸的还原产物只有NO,请写出以上反应的离子方程式。
FeO + H++ NO3- = Fe3++ NO↑+ H2O
+2 +5 +3 +2
3
↓3
↑1
×3
×1
3
10
1
1
5
化学式 Fe(OH)2 Fe(OH)3
颜色、状态
水溶性
酸碱性
稳定性
与稀盐酸、稀硫酸反应
制备
转化
Fe(OH)2 +2H+=Fe2++2H2O
白色固体
红褐色固体
不溶
不溶
Fe(OH)3 +3H+=Fe3++3H2O
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓
在空气中易被氧化为Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
现象:白色沉淀迅速变为灰绿色,最终变为红褐色
弱碱性
弱碱性
三、铁的氢氧化物
2Fe(OH)3 Fe2O3+3H2O
5、下列各图示中 能较长时间看到Fe(OH)2白色沉淀。
①②④
随堂训练
6、Fe(OH)2是一种白色沉淀,极易被氧化生成Fe(OH)3,为长时间观察到生成的Fe(OH)2沉淀,某小组设计如下两套方案。
方案一:覆盖层法
方案二:还原性气体保护法
根据以上两种方案,回答下列问题:
(1)在实验方案一中,为防止Fe(OH)2被氧化,常采用以下措施。
①用新制的FeSO4溶液和经过加热煮沸的NaOH溶液制Fe(OH)2,目的是__________________________________。
排除溶解的氧气,防止Fe(OH)2被氧化
(3)将制得的含Fe(OH)2沉淀的混合液置于空气中,沉淀会发生怎样的变化?_______________________________________,写出反应的化学方程式:________________________________。
②在FeSO4溶液表面覆盖一层煤油,目的是_________________。
③将吸有NaOH溶液的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液,目的是________________。
隔绝空气中的氧气
防止带入氧气
(2)方案二要制得Fe(OH)2沉淀,操作方法为
______________________________________
__________________________。相关反应的
离子方程式为_______
____________________________________。
打开止水夹a,待A中反应生成的H2排尽装置中的空气后,再关闭止水夹a
Fe+2H+= Fe2++H2↑、
Fe2++2OH-=Fe(OH)2↓
白色沉淀迅速变为灰绿色,最终变为红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。
(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物(如苯),以隔绝空气。
(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
(2)为了防止Fe2+被氧化,配制FeSO4溶液所用的蒸馏水和制备Fe(OH)2所用的NaOH溶液都要煮沸,尽可能除去O2。
制备氢氧化亚铁实验的四个关键点
化学必修一
第三章 物质的性质与转化
第1节铁的多样性
第2课时铁、铁的氧化物和铁的氢氧化物
核心素养发展目标
1、宏观辨识与微观探析:基于元素的价态和物质的所属类别,完整有序地写出含有铁元素的物质的化学式。
2、科学探究与创新意识:根据生产、生活中的应用实例或通过实验探究,掌握亚铁盐和铁盐的物理性质、化学性质、典型实验现象,能书写主要的化学方程式和离子方程式。
3、证据推理与模型认知:知道含有铁元素的物质在生产、生活中的应用,知道Fe3+的检验方法,能独立或与同学合作完成实验,记录实验现象和数据,完成实验报告,并能主动进行交流。
学业目标
1、掌握铁单质、铁的氧化物、铁的氢氧化物的性质,能利用物质的性质和反应,设计Fe(OH)2的制备方案,培养科学探究与创新意识能力。
2.能从物质类别和价态两个视角研究物质,认识含铁物质在生产和生活中的应用,建立含铁物质性质和应用间的关系。
一、铁的单质
纯净的铁是光亮的银白色金属固体,密度较大(7.86 g·cm-3),熔点较高(1538 ℃),纯铁的抗腐蚀能力很强,具有良好的延展性、导热性、导电性,导电性比铜铝差,能被磁铁吸引。
1.物理性质
(1)从铁单质类别的角度,铁具有金属的通性。
2.化学性质
Fe+H2SO4=FeSO4+H2↑
Fe+2HCl=FeCl2+H2↑
Fe+CuSO4=FeSO4+Cu
Fe+2FeCl3=3FeCl2
(2)从铁单质化合价的角度,铁具有还原性。
①铁和冷水或热水不反应。
②铁和水蒸气的反应
实验装置 实验现象 实验结论
肥皂液中有气泡产生,用火柴点燃气泡,____________ 铁和水蒸气反应生成H2,化学方程式:_____________
听到爆鸣声
3Fe+4H2O(g) Fe3O4+4H2
①湿棉花的作用是在受热时提供反应所需的水蒸气;
②肥皂液在该实验中可以起到“收集”氢气的作用。
1.如何检验铁和水蒸气反应的固态产物中铁元素的价态?
取少量固体于试管中,加入稀硫酸(不能用盐酸)溶解,将溶液分成两份,一份加入酸性高锰酸钾溶液,溶液褪色,说明溶液中含有Fe2+;另一份加入 KSCN 溶液,溶液显红色,说明溶液中含有Fe3+。
MnO4-+5Fe2++8H+ == Mn2++5Fe3++ 4H2O
Fe3O4+8H+===Fe2++2Fe3++4H2O
2[Fe(CN)6]3-+3Fe2+===Fe3[Fe(CN)6]2↓
K3[Fe(CN)6] 六氰和铁酸钾,可用来检验亚铁离子,现象是生成蓝色沉淀。
随堂训练
2.有下列物质:
①O2 ②AgNO3溶液 ③CuCl2溶液 ④稀硫酸 ⑤FeCl3溶液 ⑥Cl2 ⑦水蒸气(高温)
与Fe反应时只生成+2价铁的化合物的是__________(填序号,下同),只生成+3价铁的化合物的是____,既生成+2价又生成+3价铁的化合物的是______。
②③④⑤
⑥
①⑦
二、铁的氧化物
1.铁的氧化物的物理性质及用途
名称 氧化亚铁 氧化铁 四氧化三铁
化学式
俗名
铁元素的化合价
颜色、状态
溶解性
用途
FeO
Fe2O3
Fe3O4
+2
+3
+2、+3
红棕色粉末
黑色固体
铁红
磁性氧化铁
黑色粉末
都不溶于水
用作色素
用作油漆、涂料、油墨的红色颜料
磁性材料
写出下列氧化物和稀盐酸反应的离子方程式:
①FeO:_________________________。
②Fe2O3:___________________________。
③Fe3O4:___________________________。
FeO+2H+=Fe2++H2O
Fe2O3+6H+=2Fe3++3H2O
2.铁的氧化物的化学性质
⑴从物质类别的角度,铁的氧化物都能和酸反应生成相应的盐和水
Fe3O4+8H+=Fe2++2Fe3++4H2O
Fe3O4是一种复杂的化合物,可以看做氧化亚铁和氧化铁形成的化合物:FeO Fe2O3
(2)从化合价的角度,铁的氧化物都具有 ,其中FeO中Fe元素价态为+2价,化合价还可以升高,具有 。
①FeO不稳定,在空气中受热被氧化生成 ,FeO在反应中表现_________。
②铁的氧化物与铝粉在高温下可发生反应,写出Fe2O3和Al发生反应的化学方程式:___________________________,反应放出 ,常用于___________、制备金属纳米复合材料等,Fe2O3在反应中表现 。
还原性
氧化性
Fe3O4
还原性
大量热
焊接钢轨
氧化性
随堂训练
3、野外焊接铁轨常利用铝粉和氧化铁反应进行,该反应称为“铝热反应”。
操作步骤为:①将铝粉和氧化铁充分混合;②撒上氯酸钾,插入镁条;③点燃镁条。现场与原理如图:
(1)氯酸钾和镁条分别起什么作用?
镁条燃烧放热达到反应所需要的高温条件,氯酸钾受热分解产生氧气,促进燃烧。
(2)将氧化铁换成氧化亚铁或四氧化三铁能否反应?若能,请写出和四氧化三铁反应的化学方程式,并标出电子转移。
能
反应的化学方程式及电子转移:
(3)若将氧化铁换成氧化镁能否反应呢?若不能,说明原因。
否。因为金属的活泼性:Mg>Al,故Al不能和MgO发生铝热反应置换出金属Mg。
4、FeO中Fe元素价态为+2价,有升高的趋势,如和稀硝酸反应,+2价Fe元素被氧化成+3价,若硝酸的还原产物只有NO,请写出以上反应的离子方程式。
FeO + H++ NO3- = Fe3++ NO↑+ H2O
+2 +5 +3 +2
3
↓3
↑1
×3
×1
3
10
1
1
5
化学式 Fe(OH)2 Fe(OH)3
颜色、状态
水溶性
酸碱性
稳定性
与稀盐酸、稀硫酸反应
制备
转化
Fe(OH)2 +2H+=Fe2++2H2O
白色固体
红褐色固体
不溶
不溶
Fe(OH)3 +3H+=Fe3++3H2O
Fe2++2OH-=Fe(OH)2↓
Fe3++3OH-=Fe(OH)3↓
在空气中易被氧化为Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
现象:白色沉淀迅速变为灰绿色,最终变为红褐色
弱碱性
弱碱性
三、铁的氢氧化物
2Fe(OH)3 Fe2O3+3H2O
5、下列各图示中 能较长时间看到Fe(OH)2白色沉淀。
①②④
随堂训练
6、Fe(OH)2是一种白色沉淀,极易被氧化生成Fe(OH)3,为长时间观察到生成的Fe(OH)2沉淀,某小组设计如下两套方案。
方案一:覆盖层法
方案二:还原性气体保护法
根据以上两种方案,回答下列问题:
(1)在实验方案一中,为防止Fe(OH)2被氧化,常采用以下措施。
①用新制的FeSO4溶液和经过加热煮沸的NaOH溶液制Fe(OH)2,目的是__________________________________。
排除溶解的氧气,防止Fe(OH)2被氧化
(3)将制得的含Fe(OH)2沉淀的混合液置于空气中,沉淀会发生怎样的变化?_______________________________________,写出反应的化学方程式:________________________________。
②在FeSO4溶液表面覆盖一层煤油,目的是_________________。
③将吸有NaOH溶液的长滴管伸入FeSO4溶液液面下,再挤出NaOH溶液,目的是________________。
隔绝空气中的氧气
防止带入氧气
(2)方案二要制得Fe(OH)2沉淀,操作方法为
______________________________________
__________________________。相关反应的
离子方程式为_______
____________________________________。
打开止水夹a,待A中反应生成的H2排尽装置中的空气后,再关闭止水夹a
Fe+2H+= Fe2++H2↑、
Fe2++2OH-=Fe(OH)2↓
白色沉淀迅速变为灰绿色,最终变为红褐色
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(1)Fe2+极易被氧化,所以FeSO4溶液要现用现配。
(4)为防止Fe2+被氧化,还可以向盛有FeSO4溶液的试管中加入少量的煤油或其他密度小于水而不溶于水的有机物(如苯),以隔绝空气。
(3)为了防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管伸入FeSO4溶液的液面下,再挤出NaOH溶液。
(2)为了防止Fe2+被氧化,配制FeSO4溶液所用的蒸馏水和制备Fe(OH)2所用的NaOH溶液都要煮沸,尽可能除去O2。
制备氢氧化亚铁实验的四个关键点
