第2章元素与物质世界微项目—科学实使用含氯消毒剂 课件(共28张PPT) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第2章元素与物质世界微项目—科学实使用含氯消毒剂 课件(共28张PPT) 2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-04 22:39:36 | ||
图片预览








文档简介
(共28张PPT)
化学必修一
第二章元素与物质世界
微项目 科学使用含氯消毒剂
核心素养发展目标
1.宏观辨识与微观探析:能从物质类别、元素化合价的角度预测含氯消毒剂有效成分的性质,并能设计实验探究其性质。
2.科学探究与创新意识:利用氧化还原反应分析并解释消毒剂在使用过程中产生的现象和出现的问题。
3.科学态度与社会责任:增强合理使用化学品的意识,科学使用含氯消毒剂。
一、生活中常用的消毒产品及消毒原理
⑴医用酒精(C2H6O)(75%的乙醇溶液)
消毒原理:吸收细菌蛋白中的水分,使其脱水变性。
⑵二氯异氰尿酸钠(C3Cl2N3NaO3)具有很强的氧化性,是一种适用范围广,高效的杀菌剂。
1.无机消毒剂
⑴含氧消毒剂:臭氧(O3)双氧水(H2O2)
消毒原理:强氧化性使细菌等蛋白质变性,使其失去活性。
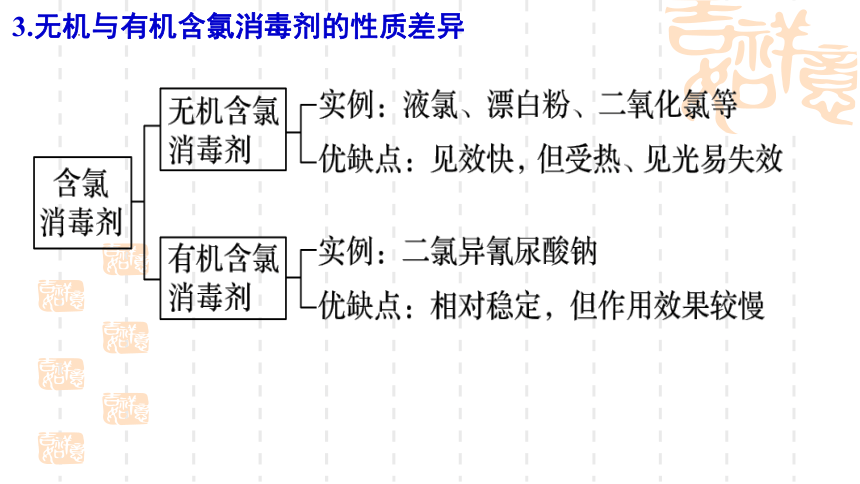
⑵含氯消毒剂:84消毒液(NaClO) 、漂白粉(Ca(ClO)2 )、二氧化氯(ClO2)、液氯(Cl2 )
消毒原理:强氧化性使细菌等蛋白质变性,使其失去活性。
2.有机消毒剂
3.无机与有机含氯消毒剂的性质差异
二、常用含氯消毒剂——84消毒液
(1)主要成分:NaCl和NaClO。有效成分:NaClO。
(2)制备:由Cl2和NaOH溶液反应制得
反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
1. 84消毒液:
资料:84消毒液的产品使用说明
2.探究84消毒液有效成分的性质
1.如原液接触皮肤,立即用清水冲洗。
2.本品易使有色衣物脱色,禁用于丝、毛、麻织物的消毒。
3.置于避光、阴凉处保存。
4.不得将本品与酸性产品(如洁厕类清洁产品)同时使用
阅读课本第76页,<84消毒液的产品说明>并完成下列探究任务:
1、84消毒液有效成分NaClO,它可能具有什么性质?
2、设计实验验证你对次氯酸钠性质的的预测是否正确?
项目活动1
③从使用说明看:NaClO有一定的漂白性。
①从类别上看:NaClO为一种弱酸盐(类比Na2CO3),溶液呈碱性,能和较强酸生成HClO。
②从价态上看:NaClO中的Cl元素为+1价,有降低到-1价或0价的趋势,有氧化性。
实验探究1、漂白性强氧化性
实验探究
实验操作 实验现象 结论
用胶头滴管滴一滴84消毒液于pH试纸上 试纸先变 蓝后褪色 消毒液具有 和_______
用胶头滴管滴一滴84消毒液于红纸上 红纸褪色 消毒液具有______
用胶头滴管滴一滴84消毒液于碘化钾试纸上 试纸变蓝 消毒液具有_______
碱性
漂白性
漂白性
氧化性
实验探究2、强氧化性
试管1溶液为紫色; 试管2溶液为蓝色,短时间内无明显变化; 试管3溶液先变蓝,滴2滴稀硫酸后快速褪色 NaClO与稀硫酸反应生成氧化性更强的______
试管中产生 气体,淀粉-KI试纸变蓝 NaClO和HCl反应生成 ,NaClO表现______
HClO
黄绿色
Cl2
氧化性
②NaClO有强氧化性,能氧化某些还原性物质。如KI、HCl等:
NaClO+2KI+H2O= ,
NaClO+2HCl(浓)=NaCl+Cl2↑+H2O。
①NaClO为弱酸盐,能和较强酸生成HClO:
2NaClO+H2SO4= 。
(1)NaClO的性质
Na2SO4+2HClO
I2+NaCl+2KOH
3.探究总结
④NaClO有漂白性。
③NaClO溶液碱性较强,有腐蚀性。
(2)次氯酸的性质①弱酸性:比碳酸弱。②氧化性:能与Fe2+、SO32-、I-等还原剂反应。③不稳定性:见光易分解:2HClO 2HCl+O2↑。④漂白性:次氯酸具有氧化性,能将某些有色物质氧化成无色物质。
思考:与HClO相比,次氯酸盐做消毒剂有哪些优点?
1.稳定性好,可长期保存。
2.容易储存、运输。
思考1:产品说明书中哪些注意事项可以用NaClO的性质来解释?
①次氯酸钠具有腐蚀性(强氧化性),接触皮肤时,应立即用清水冲洗。
②次氯酸钠的强氧化性也使其不适用于钢和铝制品的消毒。
③次氯酸钠与H2O和空气中的CO2反应生成的次氯酸具有漂白作用,禁用于丝、毛、麻织物的消毒;次氯酸见光易分解,故84消毒液应置于避光、阴凉处保存。
④次氯酸钠与浓盐酸反应生成有毒气体氯气,故不得将本品与酸性产品同时使用。
思考2:84消毒液的漂白原理?漂白粉的漂白原理和失效原理?
84消毒液的漂白原理: NaClO+CO2+H2O=NaHCO3+HClO
漂白粉的漂白原理: Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
漂白粉的失效原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO 2HCl+O2↑
3. 为什么84消毒液不能和“洁厕剂”(主要成分为浓盐酸)混合使用?写出反应的离子方程式。
NaClO有强氧化性,可以和浓盐酸生成Cl2,造成环境污染。
方程式为:NaClO+2HCl(浓)===NaCl+Cl2↑+H2O,
离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O
探究消毒剂的使用问题
有关负责人解释,绿色是藻类生长造成的;原来一直使用含氯消毒剂抑制藻类生长,但是工作人员误加H2O2消毒剂造成的。
项目活动2
2016年巴西里约热内卢奥运会的游泳池中的水变绿了
1.消毒剂使用问题
2.原因预测
游泳池
游泳池消毒,抑制藻类生长
游泳池中的水变绿
原有消毒剂不再起作用,两消毒剂间有反应发生
为什么2016年巴西里约热内卢奥运会的游泳池加入H2O2消毒剂后原有的含氯消毒剂不起作用了?发生了什么?
实验探究3、H2O2和NaClO反应
实验探究
探究内容 实验内容 实验现象
H2O2和NaClO反应原理 产生_____,能使带火星的木条______
H2O2对绿藻去除率的影响 H2O2消毒剂对绿藻去除率低
气泡
复燃
结论:(1)H2O2和NaClO反应,降低了NaClO的消毒效率。化学方程式:_________________________________。
H2O2+NaClO===H2O+O2↑+NaCl
“池水变绿”原因
(2)NaClO对绿藻的去除效果优于H2O2。
取NaClO溶液于试管中,向试管中加入足量的H2O2溶液,再向溶液中加入足量稀HNO3,最后滴入AgNO3,如有白色沉淀生成,则证明NaClO发生了还原反应。
深度思考
1.在探究H2O2和NaClO反应的实验中,怎样证明NaClO发生了还原反应?设计实验证明。(试剂:H2O2溶液、NaClO溶液、稀HNO3、AgNO3溶液)
不能,过氧乙酸呈酸性,次氯酸钠溶液呈碱性,若两者混合,则会发生反应而迅速失去消毒效果,故酸性消毒剂和碱性消毒剂也不能混合使用。
2.过氧化氢溶液和84消毒液都可以做杀菌消毒剂,也可以漂白,若将两者混合使用,还能起到杀菌、消毒效果吗?
不能,二者混合会发生氧化还原反应:NaClO+H2O2===NaCl+O2↑+H2O,从而都失去杀菌消毒效果。
3.在2003年的“非典”中,过氧乙酸是一种常用的环境消毒剂,过氧乙酸是一种高效、酸性消毒剂,有强氧化性,能和84消毒液混合使用吗?
(1)“混用更保险”:使用消毒剂一定要科学,使用前一定要认真了解各种消毒剂的成分及性质,有针对性的选择和使用,切不可混用,混用后有可能产生有毒物质或降低效果。
(2)“越浓越保险”:消毒剂浓度并不是越浓效果越好,例如75%的酒精可以吸收细菌蛋白中的水分,使其脱水变性,而纯酒精或95%的酒精会使菌体表面形成保护膜,阻止乙醇分子进一步渗入,影响杀菌效果,使其效果降低。
(3)同一时期使用消毒剂“多样化更高效”:如果同一时期频繁使用多种消毒剂,有可能使消毒剂消毒效果大大降低,还可能产生意想不到的严重后果,如先用84消毒液消毒,再用洁厕灵消毒,就有可能产生严重污染空气的氯气。
消毒剂的使用误区
有关消毒剂的使用的计算
示例1、⑴液氯也常用作自来水消毒。已知ClO2、Cl2的还原产物均为Cl-,则相同物质的量的ClO2的消毒效率是Cl2的____倍。(消毒效率指单位物质的量的物质的得电子数)。
⑵Cl2、 H2O2、 ClO2(还原产物为Cl-)等物质常被用作消毒剂,等物质的量的上述物质消毒效率最高的是 。
Cl2 2Cl-
ClO2 Cl-
H2O2 HO2
得2e-
得2e-
得5e-
1mol
~2mole-
1mol
~2mole-
1mol
~5mole-
2.5
ClO2
示例2.“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为 。(计算结果保留两位小数)
NaClO2 Cl-
得4e-
71 g
~2mole-
Cl2 2Cl-
得2e-
90.5 g
~4mole-
每克氧化能力:
每克氧化能力:
1.57
ClO2 Cl-
得5e-
67.5 g
~5mole-
每克氧化能力:
随堂训练
1.有经验的阿姨在用氯气消毒过的自来水洗有色衣服之前,都会将自来水在阳光下暴晒一段时间,其目的是
A.使水中的杂质沉淀
B.使水中的HClO分解
C.起到杀菌作用
D.增加水中O2的含量
B
2.地震、洪水等自然灾害过后,地下水等饮用水都会受到一定程度的污染,为了保证人们身体健康,下列物质不能用于水源消毒的是
A.氯气 B.漂白粉 C.烧碱 D.次氯酸钠
C
3.用漂白粉溶液浸泡过的有色布条,如果晾置在空气中一段时间后,其漂白效果会更好的原因可能是
A.漂白粉被氧化了
B .漂白粉跟空气中的CO2和水蒸气充分反应,生成了HClO
C.有色布条被空气中的氧气氧化了
D.漂白粉溶液蒸发掉部分水,其浓度增大
B
4.为预防“H1N1”甲型流感,同学们每天用84消毒液(NaClO溶液)消毒,下列说法不正确的是
A.NaClO溶液的消毒原理是HClO具有强氧化性
B.1 mol Cl2与足量NaOH溶液反应转移2 mol 电子
C.NaClO溶液的漂白原理与Na2O2相同
D.84消毒液与洁厕灵(盐酸)混合使用可能会产生有毒的氯气
B
5.前几年,部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。因此卫生部加紧调查巨能钙。下列有关说法错误的是
A.H2O2、Na2O2都属于过氧化物
B.双氧水是绿色氧化剂,可做医疗消毒剂
C.H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应时表现H2O2的氧化性
D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与活性炭不同
C
6.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳Ca(OH)2中制取漂白粉,化学方程式为_________________________________________。
(2)漂白粉的有效成分是________。
(3)漂白粉溶于水后,与空气中的CO2反应,产生有漂白、杀菌作用的次氯酸,化学方程式为_______________________________。
(4)已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是 (填字母)。①CO2②HCl③H2O④H2
A.①②③ B.②③④ C.②③ D.①④
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
A
7.二氧化氯是一种黄绿色的气体,自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,使碘游离出来。 已知:8HCl+2ClO2+10KI=5I2+10KCl+4H2O。
操作Ⅱ:加入一定量的Na2S2O3溶液。
已知:2Na2S2O3+I2=Na2S4O6+2NaI。
请回答下列问题。
①操作Ⅰ中反应的离子方程式是______________________。
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
8H++2ClO2+10I-=5I2+2Cl-+4H2O
0.135
化学必修一
第二章元素与物质世界
微项目 科学使用含氯消毒剂
核心素养发展目标
1.宏观辨识与微观探析:能从物质类别、元素化合价的角度预测含氯消毒剂有效成分的性质,并能设计实验探究其性质。
2.科学探究与创新意识:利用氧化还原反应分析并解释消毒剂在使用过程中产生的现象和出现的问题。
3.科学态度与社会责任:增强合理使用化学品的意识,科学使用含氯消毒剂。
一、生活中常用的消毒产品及消毒原理
⑴医用酒精(C2H6O)(75%的乙醇溶液)
消毒原理:吸收细菌蛋白中的水分,使其脱水变性。
⑵二氯异氰尿酸钠(C3Cl2N3NaO3)具有很强的氧化性,是一种适用范围广,高效的杀菌剂。
1.无机消毒剂
⑴含氧消毒剂:臭氧(O3)双氧水(H2O2)
消毒原理:强氧化性使细菌等蛋白质变性,使其失去活性。
⑵含氯消毒剂:84消毒液(NaClO) 、漂白粉(Ca(ClO)2 )、二氧化氯(ClO2)、液氯(Cl2 )
消毒原理:强氧化性使细菌等蛋白质变性,使其失去活性。
2.有机消毒剂
3.无机与有机含氯消毒剂的性质差异
二、常用含氯消毒剂——84消毒液
(1)主要成分:NaCl和NaClO。有效成分:NaClO。
(2)制备:由Cl2和NaOH溶液反应制得
反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
1. 84消毒液:
资料:84消毒液的产品使用说明
2.探究84消毒液有效成分的性质
1.如原液接触皮肤,立即用清水冲洗。
2.本品易使有色衣物脱色,禁用于丝、毛、麻织物的消毒。
3.置于避光、阴凉处保存。
4.不得将本品与酸性产品(如洁厕类清洁产品)同时使用
阅读课本第76页,<84消毒液的产品说明>并完成下列探究任务:
1、84消毒液有效成分NaClO,它可能具有什么性质?
2、设计实验验证你对次氯酸钠性质的的预测是否正确?
项目活动1
③从使用说明看:NaClO有一定的漂白性。
①从类别上看:NaClO为一种弱酸盐(类比Na2CO3),溶液呈碱性,能和较强酸生成HClO。
②从价态上看:NaClO中的Cl元素为+1价,有降低到-1价或0价的趋势,有氧化性。
实验探究1、漂白性强氧化性
实验探究
实验操作 实验现象 结论
用胶头滴管滴一滴84消毒液于pH试纸上 试纸先变 蓝后褪色 消毒液具有 和_______
用胶头滴管滴一滴84消毒液于红纸上 红纸褪色 消毒液具有______
用胶头滴管滴一滴84消毒液于碘化钾试纸上 试纸变蓝 消毒液具有_______
碱性
漂白性
漂白性
氧化性
实验探究2、强氧化性
试管1溶液为紫色; 试管2溶液为蓝色,短时间内无明显变化; 试管3溶液先变蓝,滴2滴稀硫酸后快速褪色 NaClO与稀硫酸反应生成氧化性更强的______
试管中产生 气体,淀粉-KI试纸变蓝 NaClO和HCl反应生成 ,NaClO表现______
HClO
黄绿色
Cl2
氧化性
②NaClO有强氧化性,能氧化某些还原性物质。如KI、HCl等:
NaClO+2KI+H2O= ,
NaClO+2HCl(浓)=NaCl+Cl2↑+H2O。
①NaClO为弱酸盐,能和较强酸生成HClO:
2NaClO+H2SO4= 。
(1)NaClO的性质
Na2SO4+2HClO
I2+NaCl+2KOH
3.探究总结
④NaClO有漂白性。
③NaClO溶液碱性较强,有腐蚀性。
(2)次氯酸的性质①弱酸性:比碳酸弱。②氧化性:能与Fe2+、SO32-、I-等还原剂反应。③不稳定性:见光易分解:2HClO 2HCl+O2↑。④漂白性:次氯酸具有氧化性,能将某些有色物质氧化成无色物质。
思考:与HClO相比,次氯酸盐做消毒剂有哪些优点?
1.稳定性好,可长期保存。
2.容易储存、运输。
思考1:产品说明书中哪些注意事项可以用NaClO的性质来解释?
①次氯酸钠具有腐蚀性(强氧化性),接触皮肤时,应立即用清水冲洗。
②次氯酸钠的强氧化性也使其不适用于钢和铝制品的消毒。
③次氯酸钠与H2O和空气中的CO2反应生成的次氯酸具有漂白作用,禁用于丝、毛、麻织物的消毒;次氯酸见光易分解,故84消毒液应置于避光、阴凉处保存。
④次氯酸钠与浓盐酸反应生成有毒气体氯气,故不得将本品与酸性产品同时使用。
思考2:84消毒液的漂白原理?漂白粉的漂白原理和失效原理?
84消毒液的漂白原理: NaClO+CO2+H2O=NaHCO3+HClO
漂白粉的漂白原理: Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
漂白粉的失效原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
2HClO 2HCl+O2↑
3. 为什么84消毒液不能和“洁厕剂”(主要成分为浓盐酸)混合使用?写出反应的离子方程式。
NaClO有强氧化性,可以和浓盐酸生成Cl2,造成环境污染。
方程式为:NaClO+2HCl(浓)===NaCl+Cl2↑+H2O,
离子方程式为:ClO-+Cl-+2H+=Cl2↑+H2O
探究消毒剂的使用问题
有关负责人解释,绿色是藻类生长造成的;原来一直使用含氯消毒剂抑制藻类生长,但是工作人员误加H2O2消毒剂造成的。
项目活动2
2016年巴西里约热内卢奥运会的游泳池中的水变绿了
1.消毒剂使用问题
2.原因预测
游泳池
游泳池消毒,抑制藻类生长
游泳池中的水变绿
原有消毒剂不再起作用,两消毒剂间有反应发生
为什么2016年巴西里约热内卢奥运会的游泳池加入H2O2消毒剂后原有的含氯消毒剂不起作用了?发生了什么?
实验探究3、H2O2和NaClO反应
实验探究
探究内容 实验内容 实验现象
H2O2和NaClO反应原理 产生_____,能使带火星的木条______
H2O2对绿藻去除率的影响 H2O2消毒剂对绿藻去除率低
气泡
复燃
结论:(1)H2O2和NaClO反应,降低了NaClO的消毒效率。化学方程式:_________________________________。
H2O2+NaClO===H2O+O2↑+NaCl
“池水变绿”原因
(2)NaClO对绿藻的去除效果优于H2O2。
取NaClO溶液于试管中,向试管中加入足量的H2O2溶液,再向溶液中加入足量稀HNO3,最后滴入AgNO3,如有白色沉淀生成,则证明NaClO发生了还原反应。
深度思考
1.在探究H2O2和NaClO反应的实验中,怎样证明NaClO发生了还原反应?设计实验证明。(试剂:H2O2溶液、NaClO溶液、稀HNO3、AgNO3溶液)
不能,过氧乙酸呈酸性,次氯酸钠溶液呈碱性,若两者混合,则会发生反应而迅速失去消毒效果,故酸性消毒剂和碱性消毒剂也不能混合使用。
2.过氧化氢溶液和84消毒液都可以做杀菌消毒剂,也可以漂白,若将两者混合使用,还能起到杀菌、消毒效果吗?
不能,二者混合会发生氧化还原反应:NaClO+H2O2===NaCl+O2↑+H2O,从而都失去杀菌消毒效果。
3.在2003年的“非典”中,过氧乙酸是一种常用的环境消毒剂,过氧乙酸是一种高效、酸性消毒剂,有强氧化性,能和84消毒液混合使用吗?
(1)“混用更保险”:使用消毒剂一定要科学,使用前一定要认真了解各种消毒剂的成分及性质,有针对性的选择和使用,切不可混用,混用后有可能产生有毒物质或降低效果。
(2)“越浓越保险”:消毒剂浓度并不是越浓效果越好,例如75%的酒精可以吸收细菌蛋白中的水分,使其脱水变性,而纯酒精或95%的酒精会使菌体表面形成保护膜,阻止乙醇分子进一步渗入,影响杀菌效果,使其效果降低。
(3)同一时期使用消毒剂“多样化更高效”:如果同一时期频繁使用多种消毒剂,有可能使消毒剂消毒效果大大降低,还可能产生意想不到的严重后果,如先用84消毒液消毒,再用洁厕灵消毒,就有可能产生严重污染空气的氯气。
消毒剂的使用误区
有关消毒剂的使用的计算
示例1、⑴液氯也常用作自来水消毒。已知ClO2、Cl2的还原产物均为Cl-,则相同物质的量的ClO2的消毒效率是Cl2的____倍。(消毒效率指单位物质的量的物质的得电子数)。
⑵Cl2、 H2O2、 ClO2(还原产物为Cl-)等物质常被用作消毒剂,等物质的量的上述物质消毒效率最高的是 。
Cl2 2Cl-
ClO2 Cl-
H2O2 HO2
得2e-
得2e-
得5e-
1mol
~2mole-
1mol
~2mole-
1mol
~5mole-
2.5
ClO2
示例2.“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为 。(计算结果保留两位小数)
NaClO2 Cl-
得4e-
71 g
~2mole-
Cl2 2Cl-
得2e-
90.5 g
~4mole-
每克氧化能力:
每克氧化能力:
1.57
ClO2 Cl-
得5e-
67.5 g
~5mole-
每克氧化能力:
随堂训练
1.有经验的阿姨在用氯气消毒过的自来水洗有色衣服之前,都会将自来水在阳光下暴晒一段时间,其目的是
A.使水中的杂质沉淀
B.使水中的HClO分解
C.起到杀菌作用
D.增加水中O2的含量
B
2.地震、洪水等自然灾害过后,地下水等饮用水都会受到一定程度的污染,为了保证人们身体健康,下列物质不能用于水源消毒的是
A.氯气 B.漂白粉 C.烧碱 D.次氯酸钠
C
3.用漂白粉溶液浸泡过的有色布条,如果晾置在空气中一段时间后,其漂白效果会更好的原因可能是
A.漂白粉被氧化了
B .漂白粉跟空气中的CO2和水蒸气充分反应,生成了HClO
C.有色布条被空气中的氧气氧化了
D.漂白粉溶液蒸发掉部分水,其浓度增大
B
4.为预防“H1N1”甲型流感,同学们每天用84消毒液(NaClO溶液)消毒,下列说法不正确的是
A.NaClO溶液的消毒原理是HClO具有强氧化性
B.1 mol Cl2与足量NaOH溶液反应转移2 mol 电子
C.NaClO溶液的漂白原理与Na2O2相同
D.84消毒液与洁厕灵(盐酸)混合使用可能会产生有毒的氯气
B
5.前几年,部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。因此卫生部加紧调查巨能钙。下列有关说法错误的是
A.H2O2、Na2O2都属于过氧化物
B.双氧水是绿色氧化剂,可做医疗消毒剂
C.H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应时表现H2O2的氧化性
D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与活性炭不同
C
6.洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳Ca(OH)2中制取漂白粉,化学方程式为_________________________________________。
(2)漂白粉的有效成分是________。
(3)漂白粉溶于水后,与空气中的CO2反应,产生有漂白、杀菌作用的次氯酸,化学方程式为_______________________________。
(4)已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是 (填字母)。①CO2②HCl③H2O④H2
A.①②③ B.②③④ C.②③ D.①④
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO
A
7.二氧化氯是一种黄绿色的气体,自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检测水中ClO2的浓度,步骤如下:
操作Ⅰ:取一定体积的水样,加入一定量的碘化钾,使碘游离出来。 已知:8HCl+2ClO2+10KI=5I2+10KCl+4H2O。
操作Ⅱ:加入一定量的Na2S2O3溶液。
已知:2Na2S2O3+I2=Na2S4O6+2NaI。
请回答下列问题。
①操作Ⅰ中反应的离子方程式是______________________。
②若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol·L-1的Na2S2O3溶液10 mL,则水样中ClO2的浓度是________mg·L-1。
8H++2ClO2+10I-=5I2+2Cl-+4H2O
0.135
