第三节 原子的结构课件(共33张PPT)-2023-2024学年九年级化学上册同步精品课堂(鲁教版)
文档属性
| 名称 | 第三节 原子的结构课件(共33张PPT)-2023-2024学年九年级化学上册同步精品课堂(鲁教版) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-05 21:42:21 | ||
图片预览










文档简介
(共33张PPT)
第三节 原子的结构
第二章 探秘水世界
学习目标
CONTENTS
1
知道原子由原子核和核外电子构成,记住核电荷数、质子数和核外电子数的关系
3
知道什么是相对原子质量,能根据相对原子质量的概念进行简单计算
2
知道原子是构成物质的一种基本微粒,知道原子的性质
4
知道原子和离子之间可以相互转化,初步认识核外电子在化学反应中的作用
课堂导入
从微观角度来看,化学反应的实质是分子分裂为原子,原子重新组合成新分子。化学变化中分子的种类一定变,而原子的种类。原子是化学变化中的最小粒子。
原子能不能再分呢?原子是由什么构成的呢?
一、原子的结构
1.原子结构认识历程
(1)公元前5世纪,希腊哲学家德谟克利特是“原子论”的创始者。他认为万物都是由原子所构成的。
(2)19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
一、原子的结构
1.原子结构认识历程
(3)1897年,英国科学家汤姆森发现了电子。 他提出原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子。
原子是可分的
一、原子的结构
1.原子结构认识历程
(4)α粒子散射实验(1909年)
卢瑟福和他的助手做了著名α粒子散射实验(α粒子轰击金箔)。根据实验,卢瑟
福在1911年提出
原子有核模型。
一、原子的结构
1.原子结构认识历程
(4)α粒子散射实验(1909年)
实验现象:
大多数α粒子穿过金箔未发生偏转;
少数α粒子穿过金箔方向发生偏转;
极少数α粒子被反弹回去。
绝大部分α粒子没有或遇到极小的阻力,而少数α粒子遇到了较大的阻力。这种阻力来自质量较大的原子核。
一、原子的结构
2.原子的构成
原子
原子核
核外电子
质子(每个质子带一个单位正电荷)
中子(不带电)
(每个电子带一个单位的负电荷)
(带正电)
(不显电性)
注:
(1)质子和中子的质量差不多,都比电子的质量大得多,约为电子质量的1836倍;
(2)原子核体积只占原子体积的几千亿分之一,却集中了99.96%以上原子的质量。
一、原子的结构
2.原子的构成
名称 符号 原子核 核外电子数
质子数 中子数 氢 H 1 0 1
碳 C 6 6 6
氧 O 8 8 8
钠 Na 11 12 11
氯 Cl 17 18 17
碳-12 C-12 6 6 6
碳-13 C-13 6 7 6
碳-14 C-14 6 8 6
分析表中信息,看看能得出哪些结论?
【活动天地】
(1)在原子里,核电荷数=核内质子数=核外电子数;
(2)质子数不一定等于中子数;
(3)原子中不一定含有中子;
(4)不同的原子其核内质子数(核电荷数)不同。
一、原子的结构
3.原子的性质
原子是构成物质的一种基本粒子
原子的性质:
(1)原子体积和质量很小;
(2)原子总在不断运动;
(3)原子之间有间隔。
①金属(金、汞等)
②稀有气体(氦气、氖气、氩气等)
③固态非金属单质(金刚石、硅等)
原子直接构成的三类物质
1.核外电子的分层排布
二、原子中的电子
电子层数:1、2、3、4、5、6、7
电子能量:
离核远近:
能量越低,离核越近;能量越高,离核越远。
低 高
近 远
2.原子结构示意图
二、原子中的电子
2
+8
6
原子核
质子数
第二层电子数
第一层
第二层(最外层)
3.核外电子与原子性质的关系
二、原子中的电子
电子不仅决定原子的体积,也决定原子在化学反应中的表现。
原子最外层电子数与结构、性质的关系
原 子 最外层 电子数 原 子 结 构 变 化 趋 势 化 学
性 质
稀 有 气 体
金 属
非 金属
8个(氦 为2个 )
稳定结构
稳 定
稳 定
一般<4 个
不稳定结构
易失去电子
活 泼
一般≥4个
不稳定结构
易获得电子
活 泼
4.离子
二、原子中的电子
在化学反应中,原子核是不变的,发生改变的只是核外电子。
(1)离子的形成
原子失去电子后变成带正电
荷的阳离子,原子得到电子
后变成带负电荷的阴离子。
4.离子
二、原子中的电子
离子是带电的原子或原子团
(2)离子符号的表示
Mg2+
Cl
Na+
O2-
镁离子
氯离子
钠离子
氧离子
离子符号右上角的数字表示离子所带的电荷数,正负号表示离子所带电荷的电性。
-
4.离子
二、原子中的电子
氯化钠的形成
e-
Na
Cl
4.离子
二、原子中的电子
(3)离子符号的意义
Mg2+
每个镁离子带2个单位的正电荷
表示2个镁离子(镁离子的个数)
2
4.离子
二、原子中的电子
(5)分子、原子、离子之间的关系
原子的质量
三、原子质量的计量
原子的质量非常微小,无论书写、记忆还是使用都极不方便
1.674×10-27
1.993×10-26
2.657×10-26
9.288×10-26
氢
碳
氧
铁
1个原子的质量/kg
原子种类
1.相对原子质量
三、原子质量的计量
以一个碳12原子的实际质量(约1.993×10-26 kg)的1/12作为标准, 其他原子的质量跟它的比值, 就是这种原子的相对原子质量。
相对原子质量 = -------------------
原子的实际质量
碳12原子质量的1/12
计算公式:
注意:
相对原子质量是一个比值,不是原子的实际质量,单位一般不写。
2.相对原子质量与原子的质量区别
三、原子质量的计量
(1)原子的质量是原子的实际存在的物质的多少,是实际质量;
(2)相对原子质量是以C原子质量的1/12为标准来表示物质质量多少的相对质量。原子质量的单位是kg,相对原子质量的单位是1。原子的质量主要集中在原子核上;
(3)构成原子的三种粒子中,1个质子和1个中子的质量跟相对原子质量的标准(即一个碳12原子质量的1/12)相比,均约等于1,电子的质量很小,可以忽略不计,故原子的质量主要集中在质子和中子(即原子核)上。
相对原子质量≈质子数+中子数。
典型例题
知识点一:原子的结构
【典例1】对“原子的构成”同学们有以下认识,其中错误的是( )
A.原子核中质子数一定等于中子数
B.核外电子在离核远近不同的区域中运动
C.原子由居于中心的原子核和核外电子构成
D.原子核的体积与整个原子的体积相比要小很多
A
典型例题
知识点二:原子中的电子
【典例2】科学家通过测定古生物遗骸中的碳14含量来推断古城年代。碳14原子的结构示意图为 ,下列关于碳14原子说法中,不正确的是( )
A.核外电子数是6
B.核电荷数等于核外电子数
C.质子数是6
D.核外有两个电子层,第一层上有4个电子
D
典型例题
知识点三:原子质量的计量
【典例3】关于相对原子质量,下列叙述正确的是( )
A.原子的质量就是相对原子质量
B.化学上采用相对原子质量,更便于比较和运算
C.碳原子的相对原子质量是 12g
D.两种原子的相对原子质量之比不等于它们的质量之比
B
课堂达标
(二)药理作用
1.如图是卢瑟福将带正电的a粒子流轰击金箔上出现散射的实验示意图。以下是根据该实验现象作出的推断,不合理的是( )
A.绝少数a粒子向两侧偏转,说明原子中心的“核”带正电
B.绝少数a粒子偏转的角度很大,说明原子“核”外有带负电的电子
C.绝大多数a粒子仍沿原来方向穿过,说明原子中绝大部分是“空”的
D.绝少数a粒子被反弹回来,说明原子中心有一个体积小而质量大的“核”
B
课堂达标
(二)药理作用
2.下列叙述中,错误的是( )
①原子是化学变化中的最小微粒;
②原子是不能再分的微粒;
③一切物质都是由原子直接构成的;
④一切原子核都是由质子和中子构成的;
⑤ 原子不显电性;
⑥原子之间有空隙
A.①② B.②③④ C.③⑤ D.③④⑥
B
课堂达标
(二)药理作用
3.如图是四种微粒的结构示意图,下列有关说法错误的是( )
A.③在化学反应中易失去电子
B.②是镁离子的结构示意图
C.当x=4时,①表示一种原子
D.③④属于同种元素
A
课堂达标
(二)药理作用
4.下列微粒结构示意图中,表示相对稳定的原子结构是( )
A. B. C. D.
5.下列关于Mg、Mg2+两种粒子的判断中正确的是( )
A.质子数相同 B.质量不相等
C.Mg2+比Mg活泼 D.电子层数相同
A
A
课堂达标
(二)药理作用
6.已知某碳原子的实际质量为mg,其相对原子质量为12。有一种硅原子(符号Si)的实际质量ng,则此种硅原子的相对原子质量的表达式为( )
A.12m/n g B.12n/m g C.12m/n D.12n/m
7.已知碘原子的核电荷数为53,相对原子质量为125,下列关于这种原子的说法中,错误的是( )
A.中子数是72 B.质子数是72
C.电子数是53 D.质子数和中子数之和是125
D
B
课堂达标
(二)药理作用
7.通过探究物质构成的奥秘,我们了解了物质的组成与结构。
(1)物质的组成和构成关系如图所示,
图中①表示 ______,②表示 _______。
(2)电子的质量很小,可以忽略不计,
所以原子的质量主要集中在 ___ 上,相
对原子质量近似等于 ___ 与中子数之和。
(3)金属铜是由 ________(选填“原子”、“分子”或“离子”)构成的。
质子
离子
原子核
质子数
原子
课堂达标
(二)药理作用
8.如下图所示,分别是钾元素、氢元素、氧元素、钠元素的原子结构
示意图。
(1)A 中 X 的值为_________;
(2)A、D 化学性质相似的原因是____________;
(3)B 形成的离子符号为____________;
(4)根据上图信息分析,1 个氢氧根离子中含有的电子数是_______。
19
最外层电子数相同
H+
10
课堂小结
不良反应
1.原子
原子核
核外电子
质子
(每个质子带一个单位正电荷)
(每个电子带一个单位负电荷)
2.在原子里,核电荷数=核内质子数=核外电子数
(不带电)
中子
3.原子在化学反应中的表现主要是由原子的最外层电子数决定的。
4.原子得到或失去电子后转变为离子。离子也是构成物质的一种微粒。
相对原子质量 =
某种原子的质量
碳12原子质量×1/12
2.相对原子质量 (近似值)≈ 质子数 + 中子数
5.相对原子质量:以碳12原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比。
谢谢观看
THANKS
第三节 原子的结构
第二章 探秘水世界
学习目标
CONTENTS
1
知道原子由原子核和核外电子构成,记住核电荷数、质子数和核外电子数的关系
3
知道什么是相对原子质量,能根据相对原子质量的概念进行简单计算
2
知道原子是构成物质的一种基本微粒,知道原子的性质
4
知道原子和离子之间可以相互转化,初步认识核外电子在化学反应中的作用
课堂导入
从微观角度来看,化学反应的实质是分子分裂为原子,原子重新组合成新分子。化学变化中分子的种类一定变,而原子的种类。原子是化学变化中的最小粒子。
原子能不能再分呢?原子是由什么构成的呢?
一、原子的结构
1.原子结构认识历程
(1)公元前5世纪,希腊哲学家德谟克利特是“原子论”的创始者。他认为万物都是由原子所构成的。
(2)19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
一、原子的结构
1.原子结构认识历程
(3)1897年,英国科学家汤姆森发现了电子。 他提出原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子。
原子是可分的
一、原子的结构
1.原子结构认识历程
(4)α粒子散射实验(1909年)
卢瑟福和他的助手做了著名α粒子散射实验(α粒子轰击金箔)。根据实验,卢瑟
福在1911年提出
原子有核模型。
一、原子的结构
1.原子结构认识历程
(4)α粒子散射实验(1909年)
实验现象:
大多数α粒子穿过金箔未发生偏转;
少数α粒子穿过金箔方向发生偏转;
极少数α粒子被反弹回去。
绝大部分α粒子没有或遇到极小的阻力,而少数α粒子遇到了较大的阻力。这种阻力来自质量较大的原子核。
一、原子的结构
2.原子的构成
原子
原子核
核外电子
质子(每个质子带一个单位正电荷)
中子(不带电)
(每个电子带一个单位的负电荷)
(带正电)
(不显电性)
注:
(1)质子和中子的质量差不多,都比电子的质量大得多,约为电子质量的1836倍;
(2)原子核体积只占原子体积的几千亿分之一,却集中了99.96%以上原子的质量。
一、原子的结构
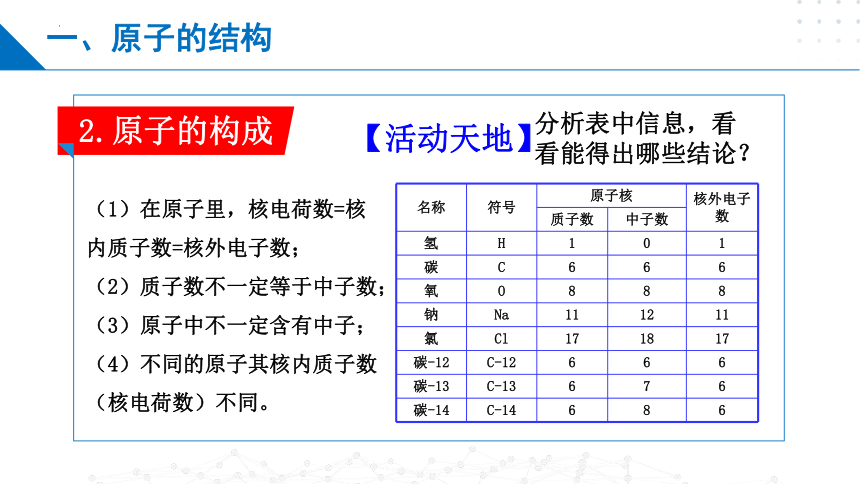
2.原子的构成
名称 符号 原子核 核外电子数
质子数 中子数 氢 H 1 0 1
碳 C 6 6 6
氧 O 8 8 8
钠 Na 11 12 11
氯 Cl 17 18 17
碳-12 C-12 6 6 6
碳-13 C-13 6 7 6
碳-14 C-14 6 8 6
分析表中信息,看看能得出哪些结论?
【活动天地】
(1)在原子里,核电荷数=核内质子数=核外电子数;
(2)质子数不一定等于中子数;
(3)原子中不一定含有中子;
(4)不同的原子其核内质子数(核电荷数)不同。
一、原子的结构
3.原子的性质
原子是构成物质的一种基本粒子
原子的性质:
(1)原子体积和质量很小;
(2)原子总在不断运动;
(3)原子之间有间隔。
①金属(金、汞等)
②稀有气体(氦气、氖气、氩气等)
③固态非金属单质(金刚石、硅等)
原子直接构成的三类物质
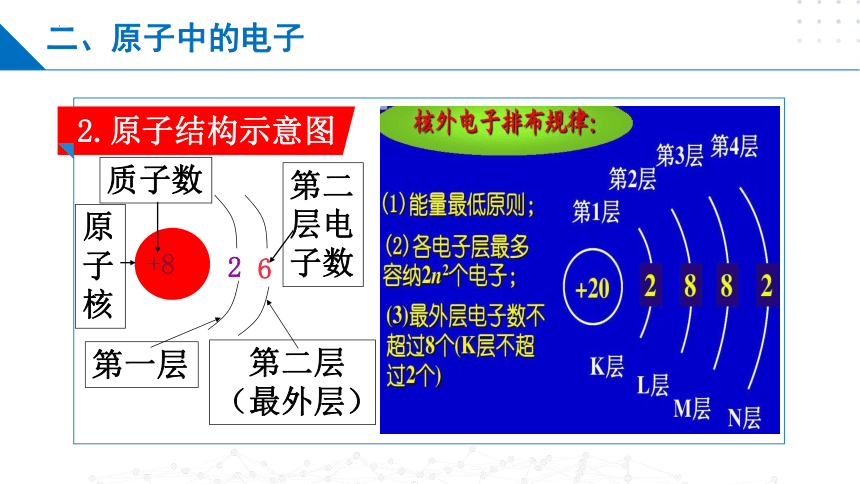
1.核外电子的分层排布
二、原子中的电子
电子层数:1、2、3、4、5、6、7
电子能量:
离核远近:
能量越低,离核越近;能量越高,离核越远。
低 高
近 远
2.原子结构示意图
二、原子中的电子
2
+8
6
原子核
质子数
第二层电子数
第一层
第二层(最外层)
3.核外电子与原子性质的关系
二、原子中的电子
电子不仅决定原子的体积,也决定原子在化学反应中的表现。
原子最外层电子数与结构、性质的关系
原 子 最外层 电子数 原 子 结 构 变 化 趋 势 化 学
性 质
稀 有 气 体
金 属
非 金属
8个(氦 为2个 )
稳定结构
稳 定
稳 定
一般<4 个
不稳定结构
易失去电子
活 泼
一般≥4个
不稳定结构
易获得电子
活 泼
4.离子
二、原子中的电子
在化学反应中,原子核是不变的,发生改变的只是核外电子。
(1)离子的形成
原子失去电子后变成带正电
荷的阳离子,原子得到电子
后变成带负电荷的阴离子。
4.离子
二、原子中的电子
离子是带电的原子或原子团
(2)离子符号的表示
Mg2+
Cl
Na+
O2-
镁离子
氯离子
钠离子
氧离子
离子符号右上角的数字表示离子所带的电荷数,正负号表示离子所带电荷的电性。
-
4.离子
二、原子中的电子
氯化钠的形成
e-
Na
Cl
4.离子
二、原子中的电子
(3)离子符号的意义
Mg2+
每个镁离子带2个单位的正电荷
表示2个镁离子(镁离子的个数)
2
4.离子
二、原子中的电子
(5)分子、原子、离子之间的关系
原子的质量
三、原子质量的计量
原子的质量非常微小,无论书写、记忆还是使用都极不方便
1.674×10-27
1.993×10-26
2.657×10-26
9.288×10-26
氢
碳
氧
铁
1个原子的质量/kg
原子种类
1.相对原子质量
三、原子质量的计量
以一个碳12原子的实际质量(约1.993×10-26 kg)的1/12作为标准, 其他原子的质量跟它的比值, 就是这种原子的相对原子质量。
相对原子质量 = -------------------
原子的实际质量
碳12原子质量的1/12
计算公式:
注意:
相对原子质量是一个比值,不是原子的实际质量,单位一般不写。
2.相对原子质量与原子的质量区别
三、原子质量的计量
(1)原子的质量是原子的实际存在的物质的多少,是实际质量;
(2)相对原子质量是以C原子质量的1/12为标准来表示物质质量多少的相对质量。原子质量的单位是kg,相对原子质量的单位是1。原子的质量主要集中在原子核上;
(3)构成原子的三种粒子中,1个质子和1个中子的质量跟相对原子质量的标准(即一个碳12原子质量的1/12)相比,均约等于1,电子的质量很小,可以忽略不计,故原子的质量主要集中在质子和中子(即原子核)上。
相对原子质量≈质子数+中子数。
典型例题
知识点一:原子的结构
【典例1】对“原子的构成”同学们有以下认识,其中错误的是( )
A.原子核中质子数一定等于中子数
B.核外电子在离核远近不同的区域中运动
C.原子由居于中心的原子核和核外电子构成
D.原子核的体积与整个原子的体积相比要小很多
A
典型例题
知识点二:原子中的电子
【典例2】科学家通过测定古生物遗骸中的碳14含量来推断古城年代。碳14原子的结构示意图为 ,下列关于碳14原子说法中,不正确的是( )
A.核外电子数是6
B.核电荷数等于核外电子数
C.质子数是6
D.核外有两个电子层,第一层上有4个电子
D
典型例题
知识点三:原子质量的计量
【典例3】关于相对原子质量,下列叙述正确的是( )
A.原子的质量就是相对原子质量
B.化学上采用相对原子质量,更便于比较和运算
C.碳原子的相对原子质量是 12g
D.两种原子的相对原子质量之比不等于它们的质量之比
B
课堂达标
(二)药理作用
1.如图是卢瑟福将带正电的a粒子流轰击金箔上出现散射的实验示意图。以下是根据该实验现象作出的推断,不合理的是( )
A.绝少数a粒子向两侧偏转,说明原子中心的“核”带正电
B.绝少数a粒子偏转的角度很大,说明原子“核”外有带负电的电子
C.绝大多数a粒子仍沿原来方向穿过,说明原子中绝大部分是“空”的
D.绝少数a粒子被反弹回来,说明原子中心有一个体积小而质量大的“核”
B
课堂达标
(二)药理作用
2.下列叙述中,错误的是( )
①原子是化学变化中的最小微粒;
②原子是不能再分的微粒;
③一切物质都是由原子直接构成的;
④一切原子核都是由质子和中子构成的;
⑤ 原子不显电性;
⑥原子之间有空隙
A.①② B.②③④ C.③⑤ D.③④⑥
B
课堂达标
(二)药理作用
3.如图是四种微粒的结构示意图,下列有关说法错误的是( )
A.③在化学反应中易失去电子
B.②是镁离子的结构示意图
C.当x=4时,①表示一种原子
D.③④属于同种元素
A
课堂达标
(二)药理作用
4.下列微粒结构示意图中,表示相对稳定的原子结构是( )
A. B. C. D.
5.下列关于Mg、Mg2+两种粒子的判断中正确的是( )
A.质子数相同 B.质量不相等
C.Mg2+比Mg活泼 D.电子层数相同
A
A
课堂达标
(二)药理作用
6.已知某碳原子的实际质量为mg,其相对原子质量为12。有一种硅原子(符号Si)的实际质量ng,则此种硅原子的相对原子质量的表达式为( )
A.12m/n g B.12n/m g C.12m/n D.12n/m
7.已知碘原子的核电荷数为53,相对原子质量为125,下列关于这种原子的说法中,错误的是( )
A.中子数是72 B.质子数是72
C.电子数是53 D.质子数和中子数之和是125
D
B
课堂达标
(二)药理作用
7.通过探究物质构成的奥秘,我们了解了物质的组成与结构。
(1)物质的组成和构成关系如图所示,
图中①表示 ______,②表示 _______。
(2)电子的质量很小,可以忽略不计,
所以原子的质量主要集中在 ___ 上,相
对原子质量近似等于 ___ 与中子数之和。
(3)金属铜是由 ________(选填“原子”、“分子”或“离子”)构成的。
质子
离子
原子核
质子数
原子
课堂达标
(二)药理作用
8.如下图所示,分别是钾元素、氢元素、氧元素、钠元素的原子结构
示意图。
(1)A 中 X 的值为_________;
(2)A、D 化学性质相似的原因是____________;
(3)B 形成的离子符号为____________;
(4)根据上图信息分析,1 个氢氧根离子中含有的电子数是_______。
19
最外层电子数相同
H+
10
课堂小结
不良反应
1.原子
原子核
核外电子
质子
(每个质子带一个单位正电荷)
(每个电子带一个单位负电荷)
2.在原子里,核电荷数=核内质子数=核外电子数
(不带电)
中子
3.原子在化学反应中的表现主要是由原子的最外层电子数决定的。
4.原子得到或失去电子后转变为离子。离子也是构成物质的一种微粒。
相对原子质量 =
某种原子的质量
碳12原子质量×1/12
2.相对原子质量 (近似值)≈ 质子数 + 中子数
5.相对原子质量:以碳12原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比。
谢谢观看
THANKS
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
