化学人教版(2019)选择性必修1 1.1.2热化学方程式 燃烧热 课件(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.2热化学方程式 燃烧热 课件(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 279.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-04 22:40:32 | ||
图片预览








文档简介
(共26张PPT)
第2课时
热化学方程式 燃烧热
H=
E(生成物的焓/总能量)- E(反应物的焓/总能量)
H=
E(反应物化学键断裂时所吸收的总能量)
- E (生成物化学键形成时所释放的总能量)
温故知新
(宏观——从焓的角度)
(微观——从化学键的角度)
=
反应物总键能- 生成物总键能
H有 “+” ”-”
1.在做中和反应反应热的测定实验时,关键是要比较准确地配制一定物质的量浓度的溶液,量热计要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)该实验用0.50 mol·L-1盐酸和0.55 mol·L-1的NaOH溶液各50 mL。NaOH溶液的浓度大于盐酸的浓度的目的是 。
当室温低于10 ℃时进行,对实验结果会造成较大误差的原因是 。
(2)若上述盐酸、NaOH溶液的密度都近似为1 g·cm-3,中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,实验前后的温度差为(t2-t1) ℃。则该中和反应放出热量
为 kJ(填表达式)。
根据热量计算式:cmΔt = 4.18 J·g-1·℃-1×(50+50) g×(t2-t1)℃×10-3 kJ/J
保证盐酸完全被中和
散热太快
0.418(t2-t1)
(3)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由: 。
中和热是指在稀溶液中强酸与强碱发生中和反应生成1 mol H2O时的反应热,与酸和碱的用量无关
新 知 检 测
不相等
相等
2.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)反应生成1 mol水的反应热ΔH=-52.3 kJ·mol-1,造成这一结果的原因不可能的是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
新 知 检 测
B
解析 若装置保温、隔热效果差,会造成较多的热量损失,测得的反应热数值偏小,A项可能;仰视读数时,实际量取的溶液体积多于应该量取的溶液体积,会导致放出的热量变多,B项不可能;C项操作会导致较多的热量损失,C项可能;D项操作会导致测得的NaOH溶液的初始温度偏高,最后计算出的反应放出的热量比实际放出的热量少,D项可能。
新 知 检 测
B
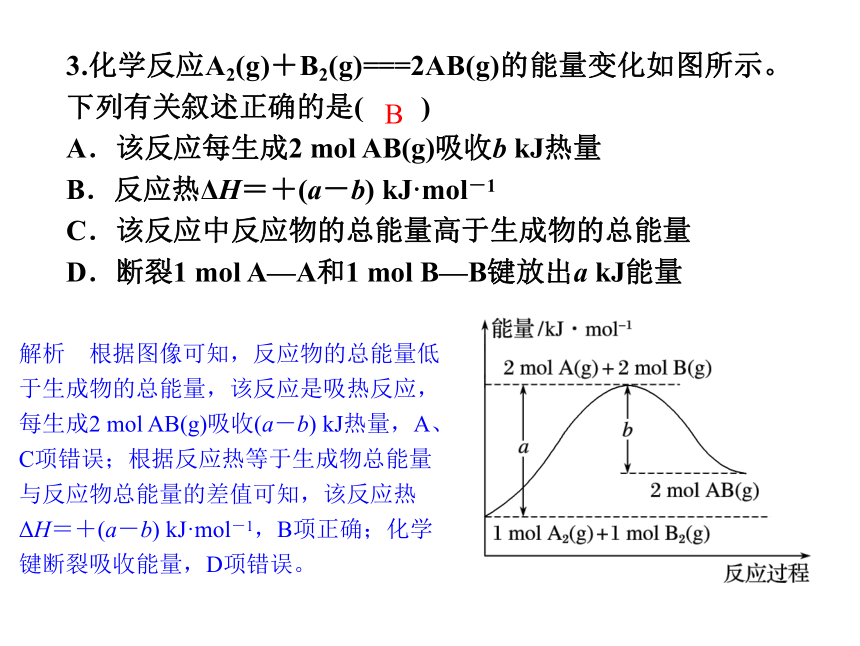
3.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A.该反应每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键放出a kJ能量
解析 根据图像可知,反应物的总能量低于生成物的总能量,该反应是吸热反应,每生成2 mol AB(g)吸收(a-b) kJ热量,A、C项错误;根据反应热等于生成物总能量与反应物总能量的差值可知,该反应热ΔH=+(a-b) kJ·mol-1,B项正确;化学键断裂吸收能量,D项错误。
新 知 检 测
4.在一定条件下,A和B反应可生成C和D,其能量变化如下:
若E1<E2,则该反应为 (填“吸热”或“放热”)反应,该反应的反应热为 。
A+B反应物总能量E1
C+D反应物总能量E2
A+B = C+D
解析 若E1<E2,反应吸收能量,ΔH=(E2-E1) kJ·mol-1>0;
相反,若E1>E2,反应放出能量,ΔH=(E2-E1) kJ·mol-1<0
吸热
ΔH=(E2-E1) kJ·mol-1
一. 热化学方程式
1.意义:
不仅可以表示化学反应过程中的物质变化,也可以表示反应中的能量变化。
2.定义:
能表示参加反应物质的量和反应热的关系的化学方程式。
热化学方程式:
H2(g)+C12(g)==2HC1(g) H =-184.6 kJ/mol
化学方程式 :H2+C12==2HC1
例1. 在25℃,101 kPa时,1 mol H2与氯气作用生成HC1的反应的热化学方程式。
例2. 在25℃、101 kPa时,有两个由H2和O2化合成1 mol H2O的反应,一个生成气态水,一个生成液态水,其化学方程式可表示为:
H2(g)+1/2O2(g)==H2O(g) H =-241.8 kJ/mol
H2(g)+1/2O2(g)==H2O (l) H =-285.8 kJ/mol
3.正确书写热化学方程式的注意事项 :
(1)物质后需标聚集状态(s、l、g、aq);生成物中不用“↑”和 ”↓” 。
(2)指明反应时的温度和压强(对于25 ℃、101 KPa时进行的反应,可以不注明。
(3)化学方程式的右边必须写上 H ,并用“空格”隔开, H :吸热用“+”,放热用“-”,单位是kJ/mol。
(4)热化学方程式中各物质化学式前面的化学计量数仅表示物质的量,并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数。SO2(g)+ 1/2O2(g)==SO3(g) H =-98.32kJ/mol
【温馨提示】
1. H单位kJ/mol中“每摩尔 ”指的不是每摩尔某物质,而是指每摩尔化学方程式。
2.对于可逆反应中的 H指的是正反应方向完全进行到底时的焓变。
3.可逆反应中,当反应逆向进行时,其反应热与正反应的反应热的数值大小相等,只是符号相反。
2H2(g)+O2(g)==2H2O(l) H =-571.6 kJ/mol
2H2O(l) == 2H2(g)+O2(g) H = +571.6 kJ/mol
问题:
热化学方程式中各物质前的化学计量数不表示分子个数,表示对应物质的物质的量。
H(kJ/mol)表示每摩尔反应所放出的热量, H的值与方程式中的计量系数有关,即对于相同的反应,当化学计量数不同时,其 H不同。
反应物和生成物前的系数它代表了什么?在方程式中 H表示了什么意义? H的值与什么有关系?
4.应用—— 反应热大小的比较:
(2) 同一反应生成物状态不同时
如:2H2(g)+O2(g) == 2H2O(1) H1 ;
2H2(g)+O2(g) == 2H2O(g) H2
(3) 同一反应反应物状态不同时
如:S(g)+O2(g) == SO2(g) H1 ;
S(s)+O2(g) == SO2(g) H2
因为气体变液体会放热,故: H1< H2
因为固体变气体会吸热,故: H1< H2
(1)P9相同的反应,化学计量数不同
(4) 两个相联系的不同反应比较
如: C(s)+O2(g) == CO2(g) H1 ;
C(s)+1/2O2(g) == CO(g) H2
可以设计成:C(s) —CO(g)—CO2(g) ,故: H1< H2
1. 1g氢气燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2 +O2 == 2H2 O H = -571.6 kJ/mol
B.2H2 (g)+O2 (g) == 2H2 O(l) H = -571.6 kJ/mol
C.H2 (g)+ 1/2O2 (g) == H2O(g) H =-285.8 kJ/mol
D.2H2 (g)+O2 (g) == 2H2 O(g) H=-571.6 kJ/mol
B
拓展演练
2. 写出下列反应的热化学方程式
(1)1 mol C(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3 kJ的热量
(2)0.5 mol Cu(固态) 与适量O2(气态) 反应,生成CuO(固态), 放出78.5 kJ的热量
C(s)+H2O(g)==CO(g)+H2(g) H=+131.3 kJ/mol
2Cu(s)+O2(g)==2CuO(s) H= - 314 kJ/mol
1. 定义:在 101 kPa时,l mol物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。
2. 单位是kJ/mol。
二. 燃烧热
H2的燃烧热的含义:
表示1 mol H2完全燃烧生成液态水放出的热量
C-CO2(g)
H-H2O(l)
S-SO2(g)
N-N2(g)
1)在101 kPa时,生成稳定的氧化物。
2)燃烧热通常是由实验测得的。(附录1)
在理解物质燃烧热的定义时,要注意以下几点:
3)可燃物以l mol作为标准进行测量。
4)计算燃烧热时,热化学方程式常以分数表示。
H=-285.8 kJ/mol
例:H2 (g) 十 O2 (g)==H2O (l)
5)生成物一定要稳定,状态要稳定,要完全燃烧(生成物不能再燃烧)。
新 知 学 习
已知C单质 和CH4的燃烧热分别为393.5 kJ/mol、890.3 kJ/mol,请写出表达其燃烧热的热化学方程式。
C(s) + O2(g) === CO2(g) ΔH = -393.5 kJ/mol
CH4(g) + 2O2(g) === CO2(g) +2H2O(l) ΔH = -890.3 kJ/mol
3.燃烧热热化学方程的书写
二、燃烧热
了解化学反应完成时产生热量的多少,以便更好地控制反应条件,充分利用能源。
4.燃烧热的意义:
如实际需要1000 kJ的热量,需要CH4的体积是多少?(标准状况)
n(CH4)=1000 kJ÷890.3 kJ/mol = 1.123 mol
V(CH4)=25.16 L
可以根据所需热量来计算需要的燃料的用量,给实际应用带来方便。
新 知 检 测
1.C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1表示( )
A.碳和水反应吸收131.3 kJ的热量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气,吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸收热量131.3 kJ
C
2.已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:
____________________________________________________
C(石墨,s)+H2O(g) === CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
新 知 检 测
3.已知3.0 g乙烷在常温下完全燃烧放出的热量为155.98 kJ,则表示乙烷燃烧热的热化学方程式是( )
A.2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-3 119.6 kJ·mol-1
B.C2H6(g)+ O2(g)===2CO(g)+3H2O(g) ΔH=-1 559.8 kJ·mol-1
C.C2H6(g)+ O2(g)===2CO2(g)+3H2O(g) ΔH=-1 559.8 kJ·mol-1
D.C2H6(g)+ O2(g)===2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
7
2
5
2
7
2
D
4.根据热化学方程式:S (s) + O2 (g) == SO2 (g) ΔH=a kJ/mol (a=-297.2),分析下列说法中不正确的是( )
A.S(s)在O2(g)中燃烧的反应是放热反应
B.S (g) + O2(g) == SO2(g) ΔH=b kJ/mol,则aC.1 mol SO2(g)所具有的能量低于1mol S(s)与1 mol O2(g)所具有的能量之和
D.16 g固体硫在空气中充分燃烧,可放出148.6 kJ的热量
B
1.根据化学反应的情况不同,反应热可分多种,例如___、___、___等,其中以跟燃料品质相关的___实际应用较广。
中和热
燃烧热
溶解热
燃烧热
拓展演练
2. 燃烧热数据对生产、生活有什么实际意义
提示:在生产和生活中,可以根据燃烧热的数据选择燃料。如甲烷、甲醇、氢气、乙烷、丙烷、乙醇、的燃烧热值均很高,它们是良好的燃料。
课 堂 小 结
二、燃烧热
1. 定义:表明反应所释放和吸收的热量的化学方程式
一、热化学方程式
2. 书写规则
注明物质的状态
有ΔH,与计量数成正比
计量数表示物质的量,可用分数
不是25℃,1大气压时,要注明条件
定义:1 mol 纯物质完全燃烧生成指定产物时所放出的热量
燃烧热的热化学方程式书写:
注意唯一性
3. 比较△H的大小
第2课时
热化学方程式 燃烧热
H=
E(生成物的焓/总能量)- E(反应物的焓/总能量)
H=
E(反应物化学键断裂时所吸收的总能量)
- E (生成物化学键形成时所释放的总能量)
温故知新
(宏观——从焓的角度)
(微观——从化学键的角度)
=
反应物总键能- 生成物总键能
H有 “+” ”-”
1.在做中和反应反应热的测定实验时,关键是要比较准确地配制一定物质的量浓度的溶液,量热计要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)该实验用0.50 mol·L-1盐酸和0.55 mol·L-1的NaOH溶液各50 mL。NaOH溶液的浓度大于盐酸的浓度的目的是 。
当室温低于10 ℃时进行,对实验结果会造成较大误差的原因是 。
(2)若上述盐酸、NaOH溶液的密度都近似为1 g·cm-3,中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,实验前后的温度差为(t2-t1) ℃。则该中和反应放出热量
为 kJ(填表达式)。
根据热量计算式:cmΔt = 4.18 J·g-1·℃-1×(50+50) g×(t2-t1)℃×10-3 kJ/J
保证盐酸完全被中和
散热太快
0.418(t2-t1)
(3)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由: 。
中和热是指在稀溶液中强酸与强碱发生中和反应生成1 mol H2O时的反应热,与酸和碱的用量无关
新 知 检 测
不相等
相等
2.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)反应生成1 mol水的反应热ΔH=-52.3 kJ·mol-1,造成这一结果的原因不可能的是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
新 知 检 测
B
解析 若装置保温、隔热效果差,会造成较多的热量损失,测得的反应热数值偏小,A项可能;仰视读数时,实际量取的溶液体积多于应该量取的溶液体积,会导致放出的热量变多,B项不可能;C项操作会导致较多的热量损失,C项可能;D项操作会导致测得的NaOH溶液的初始温度偏高,最后计算出的反应放出的热量比实际放出的热量少,D项可能。
新 知 检 测
B
3.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A.该反应每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键放出a kJ能量
解析 根据图像可知,反应物的总能量低于生成物的总能量,该反应是吸热反应,每生成2 mol AB(g)吸收(a-b) kJ热量,A、C项错误;根据反应热等于生成物总能量与反应物总能量的差值可知,该反应热ΔH=+(a-b) kJ·mol-1,B项正确;化学键断裂吸收能量,D项错误。
新 知 检 测
4.在一定条件下,A和B反应可生成C和D,其能量变化如下:
若E1<E2,则该反应为 (填“吸热”或“放热”)反应,该反应的反应热为 。
A+B反应物总能量E1
C+D反应物总能量E2
A+B = C+D
解析 若E1<E2,反应吸收能量,ΔH=(E2-E1) kJ·mol-1>0;
相反,若E1>E2,反应放出能量,ΔH=(E2-E1) kJ·mol-1<0
吸热
ΔH=(E2-E1) kJ·mol-1
一. 热化学方程式
1.意义:
不仅可以表示化学反应过程中的物质变化,也可以表示反应中的能量变化。
2.定义:
能表示参加反应物质的量和反应热的关系的化学方程式。
热化学方程式:
H2(g)+C12(g)==2HC1(g) H =-184.6 kJ/mol
化学方程式 :H2+C12==2HC1
例1. 在25℃,101 kPa时,1 mol H2与氯气作用生成HC1的反应的热化学方程式。
例2. 在25℃、101 kPa时,有两个由H2和O2化合成1 mol H2O的反应,一个生成气态水,一个生成液态水,其化学方程式可表示为:
H2(g)+1/2O2(g)==H2O(g) H =-241.8 kJ/mol
H2(g)+1/2O2(g)==H2O (l) H =-285.8 kJ/mol
3.正确书写热化学方程式的注意事项 :
(1)物质后需标聚集状态(s、l、g、aq);生成物中不用“↑”和 ”↓” 。
(2)指明反应时的温度和压强(对于25 ℃、101 KPa时进行的反应,可以不注明。
(3)化学方程式的右边必须写上 H ,并用“空格”隔开, H :吸热用“+”,放热用“-”,单位是kJ/mol。
(4)热化学方程式中各物质化学式前面的化学计量数仅表示物质的量,并不能表示物质的分子数或原子数,因此化学计量数可以是整数也可以是分数。SO2(g)+ 1/2O2(g)==SO3(g) H =-98.32kJ/mol
【温馨提示】
1. H单位kJ/mol中“每摩尔 ”指的不是每摩尔某物质,而是指每摩尔化学方程式。
2.对于可逆反应中的 H指的是正反应方向完全进行到底时的焓变。
3.可逆反应中,当反应逆向进行时,其反应热与正反应的反应热的数值大小相等,只是符号相反。
2H2(g)+O2(g)==2H2O(l) H =-571.6 kJ/mol
2H2O(l) == 2H2(g)+O2(g) H = +571.6 kJ/mol
问题:
热化学方程式中各物质前的化学计量数不表示分子个数,表示对应物质的物质的量。
H(kJ/mol)表示每摩尔反应所放出的热量, H的值与方程式中的计量系数有关,即对于相同的反应,当化学计量数不同时,其 H不同。
反应物和生成物前的系数它代表了什么?在方程式中 H表示了什么意义? H的值与什么有关系?
4.应用—— 反应热大小的比较:
(2) 同一反应生成物状态不同时
如:2H2(g)+O2(g) == 2H2O(1) H1 ;
2H2(g)+O2(g) == 2H2O(g) H2
(3) 同一反应反应物状态不同时
如:S(g)+O2(g) == SO2(g) H1 ;
S(s)+O2(g) == SO2(g) H2
因为气体变液体会放热,故: H1< H2
因为固体变气体会吸热,故: H1< H2
(1)P9相同的反应,化学计量数不同
(4) 两个相联系的不同反应比较
如: C(s)+O2(g) == CO2(g) H1 ;
C(s)+1/2O2(g) == CO(g) H2
可以设计成:C(s) —CO(g)—CO2(g) ,故: H1< H2
1. 1g氢气燃烧生成液态水放出142.9 kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2 +O2 == 2H2 O H = -571.6 kJ/mol
B.2H2 (g)+O2 (g) == 2H2 O(l) H = -571.6 kJ/mol
C.H2 (g)+ 1/2O2 (g) == H2O(g) H =-285.8 kJ/mol
D.2H2 (g)+O2 (g) == 2H2 O(g) H=-571.6 kJ/mol
B
拓展演练
2. 写出下列反应的热化学方程式
(1)1 mol C(固态)与适量H2O(气态) 反应,生成CO(气态)和H2(气态),吸收131.3 kJ的热量
(2)0.5 mol Cu(固态) 与适量O2(气态) 反应,生成CuO(固态), 放出78.5 kJ的热量
C(s)+H2O(g)==CO(g)+H2(g) H=+131.3 kJ/mol
2Cu(s)+O2(g)==2CuO(s) H= - 314 kJ/mol
1. 定义:在 101 kPa时,l mol物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。
2. 单位是kJ/mol。
二. 燃烧热
H2的燃烧热的含义:
表示1 mol H2完全燃烧生成液态水放出的热量
C-CO2(g)
H-H2O(l)
S-SO2(g)
N-N2(g)
1)在101 kPa时,生成稳定的氧化物。
2)燃烧热通常是由实验测得的。(附录1)
在理解物质燃烧热的定义时,要注意以下几点:
3)可燃物以l mol作为标准进行测量。
4)计算燃烧热时,热化学方程式常以分数表示。
H=-285.8 kJ/mol
例:H2 (g) 十 O2 (g)==H2O (l)
5)生成物一定要稳定,状态要稳定,要完全燃烧(生成物不能再燃烧)。
新 知 学 习
已知C单质 和CH4的燃烧热分别为393.5 kJ/mol、890.3 kJ/mol,请写出表达其燃烧热的热化学方程式。
C(s) + O2(g) === CO2(g) ΔH = -393.5 kJ/mol
CH4(g) + 2O2(g) === CO2(g) +2H2O(l) ΔH = -890.3 kJ/mol
3.燃烧热热化学方程的书写
二、燃烧热
了解化学反应完成时产生热量的多少,以便更好地控制反应条件,充分利用能源。
4.燃烧热的意义:
如实际需要1000 kJ的热量,需要CH4的体积是多少?(标准状况)
n(CH4)=1000 kJ÷890.3 kJ/mol = 1.123 mol
V(CH4)=25.16 L
可以根据所需热量来计算需要的燃料的用量,给实际应用带来方便。
新 知 检 测
1.C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1表示( )
A.碳和水反应吸收131.3 kJ的热量
B.1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气,吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气,吸收热量131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸收热量131.3 kJ
C
2.已知1 mol C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量,请写出该反应的热化学方程式:
____________________________________________________
C(石墨,s)+H2O(g) === CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
新 知 检 测
3.已知3.0 g乙烷在常温下完全燃烧放出的热量为155.98 kJ,则表示乙烷燃烧热的热化学方程式是( )
A.2C2H6(g)+7O2(g)===4CO2(g)+6H2O(g) ΔH=-3 119.6 kJ·mol-1
B.C2H6(g)+ O2(g)===2CO(g)+3H2O(g) ΔH=-1 559.8 kJ·mol-1
C.C2H6(g)+ O2(g)===2CO2(g)+3H2O(g) ΔH=-1 559.8 kJ·mol-1
D.C2H6(g)+ O2(g)===2CO2(g)+3H2O(l) ΔH=-1 559.8 kJ·mol-1
7
2
5
2
7
2
D
4.根据热化学方程式:S (s) + O2 (g) == SO2 (g) ΔH=a kJ/mol (a=-297.2),分析下列说法中不正确的是( )
A.S(s)在O2(g)中燃烧的反应是放热反应
B.S (g) + O2(g) == SO2(g) ΔH=b kJ/mol,则a
D.16 g固体硫在空气中充分燃烧,可放出148.6 kJ的热量
B
1.根据化学反应的情况不同,反应热可分多种,例如___、___、___等,其中以跟燃料品质相关的___实际应用较广。
中和热
燃烧热
溶解热
燃烧热
拓展演练
2. 燃烧热数据对生产、生活有什么实际意义
提示:在生产和生活中,可以根据燃烧热的数据选择燃料。如甲烷、甲醇、氢气、乙烷、丙烷、乙醇、的燃烧热值均很高,它们是良好的燃料。
课 堂 小 结
二、燃烧热
1. 定义:表明反应所释放和吸收的热量的化学方程式
一、热化学方程式
2. 书写规则
注明物质的状态
有ΔH,与计量数成正比
计量数表示物质的量,可用分数
不是25℃,1大气压时,要注明条件
定义:1 mol 纯物质完全燃烧生成指定产物时所放出的热量
燃烧热的热化学方程式书写:
注意唯一性
3. 比较△H的大小
